抗人肺癌mAbLC-1的人-鼠嵌合Fab片段基因表达质粒的构建与表达
作者:陈良 谢荷煌 王珏 范赵娟 林心楷 陈松华 刘伟 葛锡锐
单位:陈良 谢荷煌 王珏 范赵娟 林心楷 陈松华 刘伟 葛锡锐(中国科学院上海细胞生物学研究所,上海200031)
关键词:肺癌;单克隆抗体;质粒;原核表达
细胞与分子免疫学杂志000121
摘要:目的表达抗人肺癌单克隆抗体(mAb)LC-1的人-鼠嵌合基因工程抗体。方法将mAbLC-1的VL和VH基因插入质粒pWS1中,构建成表达mAbLC-1人-鼠嵌合Fab片段基因的质粒pLC-1,转化大肠杆菌TG-1并在其中表达。结果酶切鉴定表明,mAbLC-1的VL和VH基因插入方向正确,该载体能在大肠杆菌TG1中表达预期相对分子质量的蛋白,表达产物对mAb具有较强的竞争结合抗原的活性。结论成功地表达了具有较高亲和活性的人-鼠嵌合抗人肺癌的基因工程抗体。
, 百拇医药
中图号:Q78 文献标识码:A
文章编号:1007-8738(2000)01-0063-66
Construction and expression of recombinant plasmid pLC-1 bearing human-mouse chimeric Fab fragment gene of mAb LC-1 to human pulmonary carcinoma
CHEN Liang, XIE He-huang, WANG Jue, FAN Zhao-juan, LIN Xin-kai, CHEN Song-hua, LIU Wei, GE Xi-rui
Institute of Cell Biology, Chinese Academy of Sciences, Shanghai 200031, China
, 百拇医药
Abstract: Aim To express human-mouse chimeric genetic engineering antibody of monoclonal antibody(mAb)LC-1 to human pulmonary carcinoma. Methods VL and VH genes of the mAb LC-1 were cloned into plasmid pSW1 and then plasmid pLC-1 expressing human-mouse chimeric Fab fragment gene of the mAb LC-1 was constructed. The plasmid pLC-1 was transformed into E.coli TG-1 and expressed in it. Results Restriction enzyme digestion showed that the VL and VH genes of the mAb LC-1 were inserted into plasmid pSW1 in correct direction. Expression products of plasmid pSW1 in E.coli TG-1 could compete against mAb LC-1 in binding to antigen. Conclusion Human-mouse chimeric genetic engineering antibody to human pulmonary carcinoma is successfully expressed, with higher affinity activity.
, 百拇医药
Keywords: pulmonary carcinoma; monoclonal antibody; plasmid; prokaryotic expression
传统的Fab片段是将小鼠腹水中的mAb,经透析、提纯、酶切而得到,操作较繁。而原核表达系统则具有独特的优点,即操作简便、表达量大和费用低廉等。1988年,Skerra等〔1〕用大肠杆菌表达了Fv基因片段。实验证明,VL和VH都能正确地折叠,并可聚合成有功能的Fv。对VL和VH的蛋白测序证实,细菌对信号肽能正确地切除。Better等〔2〕也报道了有结合活性的Fab片段。此后,国际上许多实验室都用细菌来表达Fab片段。本实验室研制的mAb LC-1是分泌小鼠IgM的mAb,能对4种不同病理类型的肺癌起反应〔3〕。我们还构建了表达抗人肺癌mAb LC-1人鼠嵌合Fab片段基因的质粒pLC-1,并对表达的嵌合Fab片段做了初步的分析鉴定。
, http://www.100md.com
1 材料和方法
1.1 材料 大肠杆菌TG1由本实验室保存。pSW1质粒由英国Winter实验室构建,本所叶敏教授惠赠;质粒pSW1是表达人-鼠嵌合Fab片段基因的质粒,VL和VH为鼠源性的。CH为人源性HuCH1,CL为人源性HuCκ。嵌合性重链和嵌合性轻链分别由分泌到细菌周质的pelB信号肽引导,并都处在同一乳糖操纵子的控制下。人肺腺癌细胞株SPC-A-1细胞和分泌mAb LC-1的杂交瘤细胞株,均由本实验室提供。从LC-1杂交瘤细胞提取总RNA,经RT-PCR扩增并测序的VH基因和VL基因,分别以pBluescript-VH和pBluescript-VL的形式插入pBluescript质粒中〔4〕,由本实验室保存。限制酶Pst I,BstE II,Sac I和Xho I,以及T4DNA连接酶和低熔点胶,均为Promega公司的产品。酶标记的羊抗鼠IgM为Sigma公司产品。
, 百拇医药
1.2 方法
1.2.1 mAb LC-1人鼠嵌合Fab片段基因表达质粒的构建 用Sac I和Xho I双酶切质粒pBluescript-VL质粒,低熔点胶回收小片段;再用同样的双酶切质粒pSW1,回收大片段。将两者连接起来,构建成质粒pSW-VL,并按文献〔5〕的方法,转化大肠杆菌。用Pst I和BstE II对pSW-VL双酶切,并用低熔点胶回收大片段;再用同样的酶双酶切从质粒pBluescript-VH中,扩增的VH基因的PCR产物。将两者连接起来,构建成质粒pLC-1,转化大肠杆菌TG1。
1.2.2 细菌周质蛋白的抽提 挑取单个细菌克隆,接种于入LB培养液中,于37℃以250r/min振摇培养至A600nm为0.8。将此菌液以1/10的量接种入2×TY培养液(含终浓度为1 mmol/L的IPTG)中,37℃ 250 r/min振摇2.5 h。细菌周质蛋白的抽提按文献〔1〕的方法进行,抽提液装入透析袋,4℃过夜。
, 百拇医药
1.2.3 蛋白电泳 蛋白的还原性和非还原性SDS-PAGE,按文献〔6〕的方法进行。
1.2.4 竞争ELISA 以5万个SPC-A-1细胞/孔包被96孔板,按常规进行竞争ELISA。
2 结 果
2.1 质粒pLC-1的构建 质粒pLC-1的构建见图1。我们分别用Pst I和BstE II双酶切及Sac I,Xho I双酶切,能切出相应的相对分子质量的条带,证明LC-1的VL基因和VH基因已被正确地插入到质粒pSW1中(图2)。
图1 mAb LC-1的人-鼠嵌合性Fab片段的基因示意图
Fig 1 Schematic diagram of humanmouse chimeric Fab gene of mAb LC-1
, 百拇医药
图2 pLC1的限制内切产物的电泳
Fig 2 Electrophoresis of pLC-1 digested with restriction
enzymes
1:Digested with BstE II and Pst I; 2: Digested with Pst I; 3:Digested with Xho I and Sac I; 4:Digested with Xho I; 5:Standard DNA molecular marker(pBR322 DNA/Msp I).
2.2 蛋白电泳 从转染pLC-1的细菌表达物的还原性SDS-PAGE中可看到,在相对分子质量(Mr)为28处和23处有蛋白条带。从扫描图上也可以看到同样的峰值,和预期的嵌合性重链和嵌合性轻链的Mr相一致。而对照TG1细菌在该Mr处则没有蛋白条带。从转染pLC-1的细菌表达物的非还原性SDS-PAGE凝胶上可看出,转染pLC-1的细菌的Mr为51处有蛋白条带(图3)。从扫描图谱上也可看到同样的峰值,和预期的嵌合Fab片段的Mr相一致,而对照TG1细菌在该处没有蛋白条带(图4)。
, 百拇医药
2.3 竞争ELISA 所获结果表明,转染pLC-1的细菌的表达的Fab嵌合抗体对mAb LC-1有较强的竞争结合抗原的活性(图5),各组浓度依赖的A600nm值曲线见图6。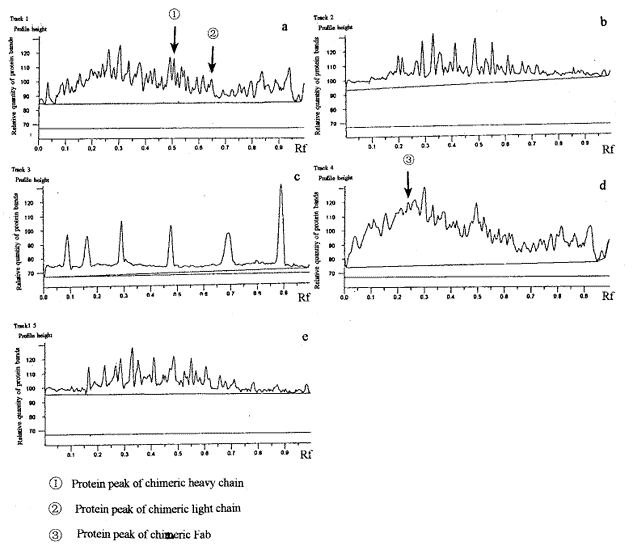
图3 细菌周质蛋白电泳的扫描
Fig 3 Scan of SDS-PAGE of periplasmic protiens of bacteria
a: Reductive SDS-PAGE of periplasmic proteins of bactertia pLC-1; b: Reductive SDS-PAGE of periplasmic protiens of bacteria TG1; c: Standard protien marker(Mr); d: Nonreductive SDSPAGE of periplasmic protiens of bacteria pLC-1; e: Nonreductive SDSPAGE of periplas
, 百拇医药
mic protiens of bacteria TG1.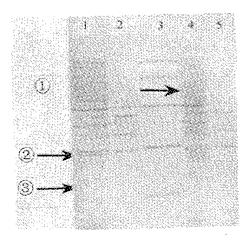
图4 细菌表达产物的SDS-PAGE
Fig 4 SDS-PAGE of periplasmic proteins of bacteria
1: Reductive SDS-PAGE of periplasmic proteins of bacteria pLC-1;
2: Reductive SDS-PAGE of periplasmic proteins of bacteria TG1;
3: Standard protein marker(Mr×103)(97.4,66.2,43.0,31.0,20.1,14.4);
, 百拇医药
4: Nonreductive SDS-PAGE of periplasmic proteins of bacteria pLC-1;
5: Nonreductive SDS-PAGE of periplasmic proteins of bacteria TG1;
1Protein band of chimeric Fab;2Protein band of chimeric heavy chain;3Protein band of chimeric light chain.
图5 嵌合性Fab片段对mAb LC-1的竞争抑制作用
Fig 5 Inhibitory effect of chimeric Fab on mAb LC-1
, http://www.100md.com
1:A 600 nm of mAb LC-1 at dilution of 10-3 by competitive ELISA; 2:A 600 nm of periplasmic proteins of bacteria pLC-1 by competitive ELISA; 3:A 600 nm of periplasmic proteins of bacteria pLC-1 against mAb LC-1 at dilution of 10-3 by competitive ELISA; 4: A 600 nm of PBS by competitive ELISA.
图6 各组浓度依赖的A600nm曲线
Fig 6 Concentrationdependent curve of A 600 nm in different
, http://www.100md.com
groups
◆A 600 nm of mAb LC-1 at different dilution(1.10-3, 2.10-4, 3.10-5, 4.10-6) by competitive ELISA.
■A 600 nm of serial 2fold dilution periplasmic proteins of bacteria pLC-1(from‘0’undiluted periplasmic extract to ‘5’, 2-5 dilution of periplasmic extract) by competitive ELISA.
▲A600 nm of mAb LC-1 against periplasmic proteins of bacteria pLC-1 by competitive ELISA(concentration of mAb LC-1 remains constant at 10-3, that of periplasmic extract of bacteria pLC-1 is serial 2fold dilution from ‘0’ undiluted extract to ‘5’,2-5 dilution of extract).
, 百拇医药
3 讨 论
我们所用VL基因和VH基因的引物设计,是参考Orlandi等〔7〕用计算机对Kabat的序列进行分析的结果;采用在VL基因和VH基因的第1框架区(framework1)和绞链区(joining region)处最保守的核苷酸序列作为引物。尽管这些序列中,有少数几个碱基(尤其在设计的酶切位点区)不严格配对,Froyen等〔8〕证明,这些突变不会影响克隆到的VL和VH对抗体片段结合抗原的活性。我们用Pst I和BstE II双酶切后,在电泳胶上能见到明亮的VH条带;而用Sac I和Xho I能切出明亮的VL条带,并经竞争ELISA实验证明,细菌表达物有竞争结合抗原的活性,说明这套引物适用于mAb LC-1的克隆。
我们所用的原核表达系统的质粒pSW1,是从pUC18改造而来,在其嵌合性重链和嵌合性轻链前均置pelB信号肽。在嵌合性重链后,还有1个16个氨基酸的标签肽,嵌合性轻链和嵌合性重链处于同一乳糖操纵子的控制下。用引导肽将轻链和重链分泌到细菌周质中形成Fab片段的过程,与真核细胞将轻链和重链分泌至内质网中形成抗体的过程相比较,二者有以下几个相似点:①合成的轻、重链大致相等;②可将轻链和重链分泌到即定的位置;③能正确切除N-端的信号肽;④均有蛋白折叠:⑤可形成二硫键;⑥可形成二聚体。在我们的表达系统中,嵌合性轻链和嵌合性重链均处于同一个操纵子的控制下,采用pelB信号肽,可合成大致相当量的轻重链,与Better等〔2〕报道的相似。对电泳条带的定量分析发现,Fab片段占周质总蛋白的1%。
, 百拇医药
本研究中采用人的抗体第1恒定区作为嵌合Fab片段的恒定区,是考虑到临床上出现的HACA反应。最近,Presta等〔9〕的工作证明,把鼠源性mAb改造成人源化的Fab片段和IgG1后,其结合抗原的活性与原mAb相当。我们在实验中发现,克隆到的抗体可变区基因片段构建成嵌合性Fab片段时,转染有该Fab片段基因质粒的细菌周质蛋白,对mAb LC-1有竞争结合抗原的活性。
在本实验中,细菌的表达产物是Fab片段,这为制备Fab片段省去了烦琐的准备工作,对细菌的表达产物直接纯化就能得到Fab片段。本实验中最大的特点是,用1个质粒可同时表达两条肽链,这为其它一些多亚基蛋白的表达又提供了一种借鉴。迄今,人们对细菌的操作已相当成熟,且因为从鼠中能得到针对任意给定抗原的抗体,而这些抗体又能人源化,并可保持活性基本不变,同时还使HACA反应降至最低,因此,预期基因工程制备的Fab片段有可能应用于临床。
基金项目:世界实验室MCD1B计划资助,No.1IV和上海市科技发展基金资助,No.984419071
, 百拇医药
作者简介:陈良,男,25岁,博士生
上海市岳阳路320号.Tel.(021)64315030-2109
2000byJCellMolImmunolPress
www.immunology.net/jcmi;Email.immuedit@fmmu.edu.cn
参考文献:
〔1〕 Skerra A, Pluckthun A.Assembly of a functional immunoglobulin Fv fragment in E.coli〔J〕 . Science, 1988; 240(4855):1038- 1041.
〔2〕 Better M, Chang CP, Robinson RR, et al. E.coli secretion of an active chimeric antibody fragment〔J〕 . Science, 1988; 240(4855):1041- 1043.
, 百拇医药
〔3〕葛锡锐,王珏,林斯骏,等.抗人肺癌单克隆抗体LC1〔J〕.实验生物学报,1989;22(3):359.
〔4〕谢荷煌,陈松华,王珏,等.单克隆抗体LC-1轻重链可变区基因的克隆及序列分析〔J〕.细胞与分子免疫学杂志,1998;14(2):89-92.
〔5〕 Inoue H, Nojima H, Okayama H. High efficiency transformation of E.coli with plasmids〔J〕 . Gene, 1990; 96(1):23- 28.
〔6〕 Bollag DM. Protein electrophoresis under denaturing and nondenaturing condition. Protein Methods〔M〕 . 2nd ed:Wiley-liss Inc. 1996:107- 155.
, 百拇医药
〔7〕 Orlandi R, Gussow DH, Jones PT, et al. Cloning immunoglobulin variable domains for expression by the polymerase chain reaction〔J〕 . Proc Natl Acad Sci USA, 1989; 86(10):3833- 3837.
〔8〕 Froyen G, Hendrix D, Ronsse I, et al. Effect of VH and VL consensus sequence-specific primers on the binding and neutralizing potential of a single-chain Fv directed towards HuIFN-gamma〔J〕 . Mol Immunol, 1995; 32(7):515- 521.
〔9〕 Presta LG, Chen H, O'Connor SJ, et al. Humanization of an anti-vascular endothelial growth factor monoclonal antibody for the therapy of solid tumors and other disorders〔J〕 . Cancer Res, 1997; 57(20):4593- 4599.
收稿日期:1999-01-28
修回日期:1999-04-19, http://www.100md.com
单位:陈良 谢荷煌 王珏 范赵娟 林心楷 陈松华 刘伟 葛锡锐(中国科学院上海细胞生物学研究所,上海200031)
关键词:肺癌;单克隆抗体;质粒;原核表达
细胞与分子免疫学杂志000121
摘要:目的表达抗人肺癌单克隆抗体(mAb)LC-1的人-鼠嵌合基因工程抗体。方法将mAbLC-1的VL和VH基因插入质粒pWS1中,构建成表达mAbLC-1人-鼠嵌合Fab片段基因的质粒pLC-1,转化大肠杆菌TG-1并在其中表达。结果酶切鉴定表明,mAbLC-1的VL和VH基因插入方向正确,该载体能在大肠杆菌TG1中表达预期相对分子质量的蛋白,表达产物对mAb具有较强的竞争结合抗原的活性。结论成功地表达了具有较高亲和活性的人-鼠嵌合抗人肺癌的基因工程抗体。
, 百拇医药
中图号:Q78 文献标识码:A
文章编号:1007-8738(2000)01-0063-66
Construction and expression of recombinant plasmid pLC-1 bearing human-mouse chimeric Fab fragment gene of mAb LC-1 to human pulmonary carcinoma
CHEN Liang, XIE He-huang, WANG Jue, FAN Zhao-juan, LIN Xin-kai, CHEN Song-hua, LIU Wei, GE Xi-rui
Institute of Cell Biology, Chinese Academy of Sciences, Shanghai 200031, China
, 百拇医药
Abstract: Aim To express human-mouse chimeric genetic engineering antibody of monoclonal antibody(mAb)LC-1 to human pulmonary carcinoma. Methods VL and VH genes of the mAb LC-1 were cloned into plasmid pSW1 and then plasmid pLC-1 expressing human-mouse chimeric Fab fragment gene of the mAb LC-1 was constructed. The plasmid pLC-1 was transformed into E.coli TG-1 and expressed in it. Results Restriction enzyme digestion showed that the VL and VH genes of the mAb LC-1 were inserted into plasmid pSW1 in correct direction. Expression products of plasmid pSW1 in E.coli TG-1 could compete against mAb LC-1 in binding to antigen. Conclusion Human-mouse chimeric genetic engineering antibody to human pulmonary carcinoma is successfully expressed, with higher affinity activity.
, 百拇医药
Keywords: pulmonary carcinoma; monoclonal antibody; plasmid; prokaryotic expression
传统的Fab片段是将小鼠腹水中的mAb,经透析、提纯、酶切而得到,操作较繁。而原核表达系统则具有独特的优点,即操作简便、表达量大和费用低廉等。1988年,Skerra等〔1〕用大肠杆菌表达了Fv基因片段。实验证明,VL和VH都能正确地折叠,并可聚合成有功能的Fv。对VL和VH的蛋白测序证实,细菌对信号肽能正确地切除。Better等〔2〕也报道了有结合活性的Fab片段。此后,国际上许多实验室都用细菌来表达Fab片段。本实验室研制的mAb LC-1是分泌小鼠IgM的mAb,能对4种不同病理类型的肺癌起反应〔3〕。我们还构建了表达抗人肺癌mAb LC-1人鼠嵌合Fab片段基因的质粒pLC-1,并对表达的嵌合Fab片段做了初步的分析鉴定。
, http://www.100md.com
1 材料和方法
1.1 材料 大肠杆菌TG1由本实验室保存。pSW1质粒由英国Winter实验室构建,本所叶敏教授惠赠;质粒pSW1是表达人-鼠嵌合Fab片段基因的质粒,VL和VH为鼠源性的。CH为人源性HuCH1,CL为人源性HuCκ。嵌合性重链和嵌合性轻链分别由分泌到细菌周质的pelB信号肽引导,并都处在同一乳糖操纵子的控制下。人肺腺癌细胞株SPC-A-1细胞和分泌mAb LC-1的杂交瘤细胞株,均由本实验室提供。从LC-1杂交瘤细胞提取总RNA,经RT-PCR扩增并测序的VH基因和VL基因,分别以pBluescript-VH和pBluescript-VL的形式插入pBluescript质粒中〔4〕,由本实验室保存。限制酶Pst I,BstE II,Sac I和Xho I,以及T4DNA连接酶和低熔点胶,均为Promega公司的产品。酶标记的羊抗鼠IgM为Sigma公司产品。
, 百拇医药
1.2 方法
1.2.1 mAb LC-1人鼠嵌合Fab片段基因表达质粒的构建 用Sac I和Xho I双酶切质粒pBluescript-VL质粒,低熔点胶回收小片段;再用同样的双酶切质粒pSW1,回收大片段。将两者连接起来,构建成质粒pSW-VL,并按文献〔5〕的方法,转化大肠杆菌。用Pst I和BstE II对pSW-VL双酶切,并用低熔点胶回收大片段;再用同样的酶双酶切从质粒pBluescript-VH中,扩增的VH基因的PCR产物。将两者连接起来,构建成质粒pLC-1,转化大肠杆菌TG1。
1.2.2 细菌周质蛋白的抽提 挑取单个细菌克隆,接种于入LB培养液中,于37℃以250r/min振摇培养至A600nm为0.8。将此菌液以1/10的量接种入2×TY培养液(含终浓度为1 mmol/L的IPTG)中,37℃ 250 r/min振摇2.5 h。细菌周质蛋白的抽提按文献〔1〕的方法进行,抽提液装入透析袋,4℃过夜。
, 百拇医药
1.2.3 蛋白电泳 蛋白的还原性和非还原性SDS-PAGE,按文献〔6〕的方法进行。
1.2.4 竞争ELISA 以5万个SPC-A-1细胞/孔包被96孔板,按常规进行竞争ELISA。
2 结 果
2.1 质粒pLC-1的构建 质粒pLC-1的构建见图1。我们分别用Pst I和BstE II双酶切及Sac I,Xho I双酶切,能切出相应的相对分子质量的条带,证明LC-1的VL基因和VH基因已被正确地插入到质粒pSW1中(图2)。

图1 mAb LC-1的人-鼠嵌合性Fab片段的基因示意图
Fig 1 Schematic diagram of humanmouse chimeric Fab gene of mAb LC-1

, 百拇医药
图2 pLC1的限制内切产物的电泳
Fig 2 Electrophoresis of pLC-1 digested with restriction
enzymes
1:Digested with BstE II and Pst I; 2: Digested with Pst I; 3:Digested with Xho I and Sac I; 4:Digested with Xho I; 5:Standard DNA molecular marker(pBR322 DNA/Msp I).
2.2 蛋白电泳 从转染pLC-1的细菌表达物的还原性SDS-PAGE中可看到,在相对分子质量(Mr)为28处和23处有蛋白条带。从扫描图上也可以看到同样的峰值,和预期的嵌合性重链和嵌合性轻链的Mr相一致。而对照TG1细菌在该Mr处则没有蛋白条带。从转染pLC-1的细菌表达物的非还原性SDS-PAGE凝胶上可看出,转染pLC-1的细菌的Mr为51处有蛋白条带(图3)。从扫描图谱上也可看到同样的峰值,和预期的嵌合Fab片段的Mr相一致,而对照TG1细菌在该处没有蛋白条带(图4)。
, 百拇医药
2.3 竞争ELISA 所获结果表明,转染pLC-1的细菌的表达的Fab嵌合抗体对mAb LC-1有较强的竞争结合抗原的活性(图5),各组浓度依赖的A600nm值曲线见图6。

图3 细菌周质蛋白电泳的扫描
Fig 3 Scan of SDS-PAGE of periplasmic protiens of bacteria
a: Reductive SDS-PAGE of periplasmic proteins of bactertia pLC-1; b: Reductive SDS-PAGE of periplasmic protiens of bacteria TG1; c: Standard protien marker(Mr); d: Nonreductive SDSPAGE of periplasmic protiens of bacteria pLC-1; e: Nonreductive SDSPAGE of periplas
, 百拇医药
mic protiens of bacteria TG1.

图4 细菌表达产物的SDS-PAGE
Fig 4 SDS-PAGE of periplasmic proteins of bacteria
1: Reductive SDS-PAGE of periplasmic proteins of bacteria pLC-1;
2: Reductive SDS-PAGE of periplasmic proteins of bacteria TG1;
3: Standard protein marker(Mr×103)(97.4,66.2,43.0,31.0,20.1,14.4);
, 百拇医药
4: Nonreductive SDS-PAGE of periplasmic proteins of bacteria pLC-1;
5: Nonreductive SDS-PAGE of periplasmic proteins of bacteria TG1;
1Protein band of chimeric Fab;2Protein band of chimeric heavy chain;3Protein band of chimeric light chain.

图5 嵌合性Fab片段对mAb LC-1的竞争抑制作用
Fig 5 Inhibitory effect of chimeric Fab on mAb LC-1
, http://www.100md.com
1:A 600 nm of mAb LC-1 at dilution of 10-3 by competitive ELISA; 2:A 600 nm of periplasmic proteins of bacteria pLC-1 by competitive ELISA; 3:A 600 nm of periplasmic proteins of bacteria pLC-1 against mAb LC-1 at dilution of 10-3 by competitive ELISA; 4: A 600 nm of PBS by competitive ELISA.

图6 各组浓度依赖的A600nm曲线
Fig 6 Concentrationdependent curve of A 600 nm in different
, http://www.100md.com
groups
◆A 600 nm of mAb LC-1 at different dilution(1.10-3, 2.10-4, 3.10-5, 4.10-6) by competitive ELISA.
■A 600 nm of serial 2fold dilution periplasmic proteins of bacteria pLC-1(from‘0’undiluted periplasmic extract to ‘5’, 2-5 dilution of periplasmic extract) by competitive ELISA.
▲A600 nm of mAb LC-1 against periplasmic proteins of bacteria pLC-1 by competitive ELISA(concentration of mAb LC-1 remains constant at 10-3, that of periplasmic extract of bacteria pLC-1 is serial 2fold dilution from ‘0’ undiluted extract to ‘5’,2-5 dilution of extract).
, 百拇医药
3 讨 论
我们所用VL基因和VH基因的引物设计,是参考Orlandi等〔7〕用计算机对Kabat的序列进行分析的结果;采用在VL基因和VH基因的第1框架区(framework1)和绞链区(joining region)处最保守的核苷酸序列作为引物。尽管这些序列中,有少数几个碱基(尤其在设计的酶切位点区)不严格配对,Froyen等〔8〕证明,这些突变不会影响克隆到的VL和VH对抗体片段结合抗原的活性。我们用Pst I和BstE II双酶切后,在电泳胶上能见到明亮的VH条带;而用Sac I和Xho I能切出明亮的VL条带,并经竞争ELISA实验证明,细菌表达物有竞争结合抗原的活性,说明这套引物适用于mAb LC-1的克隆。
我们所用的原核表达系统的质粒pSW1,是从pUC18改造而来,在其嵌合性重链和嵌合性轻链前均置pelB信号肽。在嵌合性重链后,还有1个16个氨基酸的标签肽,嵌合性轻链和嵌合性重链处于同一乳糖操纵子的控制下。用引导肽将轻链和重链分泌到细菌周质中形成Fab片段的过程,与真核细胞将轻链和重链分泌至内质网中形成抗体的过程相比较,二者有以下几个相似点:①合成的轻、重链大致相等;②可将轻链和重链分泌到即定的位置;③能正确切除N-端的信号肽;④均有蛋白折叠:⑤可形成二硫键;⑥可形成二聚体。在我们的表达系统中,嵌合性轻链和嵌合性重链均处于同一个操纵子的控制下,采用pelB信号肽,可合成大致相当量的轻重链,与Better等〔2〕报道的相似。对电泳条带的定量分析发现,Fab片段占周质总蛋白的1%。
, 百拇医药
本研究中采用人的抗体第1恒定区作为嵌合Fab片段的恒定区,是考虑到临床上出现的HACA反应。最近,Presta等〔9〕的工作证明,把鼠源性mAb改造成人源化的Fab片段和IgG1后,其结合抗原的活性与原mAb相当。我们在实验中发现,克隆到的抗体可变区基因片段构建成嵌合性Fab片段时,转染有该Fab片段基因质粒的细菌周质蛋白,对mAb LC-1有竞争结合抗原的活性。
在本实验中,细菌的表达产物是Fab片段,这为制备Fab片段省去了烦琐的准备工作,对细菌的表达产物直接纯化就能得到Fab片段。本实验中最大的特点是,用1个质粒可同时表达两条肽链,这为其它一些多亚基蛋白的表达又提供了一种借鉴。迄今,人们对细菌的操作已相当成熟,且因为从鼠中能得到针对任意给定抗原的抗体,而这些抗体又能人源化,并可保持活性基本不变,同时还使HACA反应降至最低,因此,预期基因工程制备的Fab片段有可能应用于临床。
基金项目:世界实验室MCD1B计划资助,No.1IV和上海市科技发展基金资助,No.984419071
, 百拇医药
作者简介:陈良,男,25岁,博士生
上海市岳阳路320号.Tel.(021)64315030-2109
2000byJCellMolImmunolPress
www.immunology.net/jcmi;Email.immuedit@fmmu.edu.cn
参考文献:
〔1〕 Skerra A, Pluckthun A.Assembly of a functional immunoglobulin Fv fragment in E.coli〔J〕 . Science, 1988; 240(4855):1038- 1041.
〔2〕 Better M, Chang CP, Robinson RR, et al. E.coli secretion of an active chimeric antibody fragment〔J〕 . Science, 1988; 240(4855):1041- 1043.
, 百拇医药
〔3〕葛锡锐,王珏,林斯骏,等.抗人肺癌单克隆抗体LC1〔J〕.实验生物学报,1989;22(3):359.
〔4〕谢荷煌,陈松华,王珏,等.单克隆抗体LC-1轻重链可变区基因的克隆及序列分析〔J〕.细胞与分子免疫学杂志,1998;14(2):89-92.
〔5〕 Inoue H, Nojima H, Okayama H. High efficiency transformation of E.coli with plasmids〔J〕 . Gene, 1990; 96(1):23- 28.
〔6〕 Bollag DM. Protein electrophoresis under denaturing and nondenaturing condition. Protein Methods〔M〕 . 2nd ed:Wiley-liss Inc. 1996:107- 155.
, 百拇医药
〔7〕 Orlandi R, Gussow DH, Jones PT, et al. Cloning immunoglobulin variable domains for expression by the polymerase chain reaction〔J〕 . Proc Natl Acad Sci USA, 1989; 86(10):3833- 3837.
〔8〕 Froyen G, Hendrix D, Ronsse I, et al. Effect of VH and VL consensus sequence-specific primers on the binding and neutralizing potential of a single-chain Fv directed towards HuIFN-gamma〔J〕 . Mol Immunol, 1995; 32(7):515- 521.
〔9〕 Presta LG, Chen H, O'Connor SJ, et al. Humanization of an anti-vascular endothelial growth factor monoclonal antibody for the therapy of solid tumors and other disorders〔J〕 . Cancer Res, 1997; 57(20):4593- 4599.
收稿日期:1999-01-28
修回日期:1999-04-19, http://www.100md.com