7-取代-1-(2-氟乙基)-6,8-二氟-1,4-二氢-4-氧-3-喹啉羧酸化合物的合成及其抗菌活性
作者:姚斌 赵京浦 徐炳祥
单位:姚斌(第二军医大学药学院有机化学教研室,上海 200433);赵京浦(第二军医大学药学院有机化学教研室,上海 200433);徐炳祥(第二军医大学药学院有机化学教研室,上海 200433)
关键词:氟喹诺酮;化学合成;抗菌活性
第二军医大学学报001008 [摘要] 目的:研究7-取代-1-(2-氟 乙基)-6,8-二氟-1,4-二氢-4-氧-3-喹啉羧酸的合成及其抗菌活性。方 法:通过高温下缩合、环化、亲核取代得到关键中间体,然后通过反应制得目 标化合物。选用临床常见的6株致病菌的标准菌株进行体外抗菌活性测定。结果: 设计合成11个化合物,均为首次报道。通过IR,1HNMR和元素分析来确证化合 物的结构。体外抗菌活性实验以氟罗沙星为对照品,其中化合物Ⅰ1,Ⅰ2,Ⅱ4的抗 菌活性较强。结论:合成的11个化合物中有一些化合物显示较好的抗 菌活性,值得进一步深入研究。
, 百拇医药
[中图分类号] R 978.19 [文献标识码] A
[文章编号] 0258-879X(2000)10-0928-04
Synthesis and antibacterial activity of 7-substituted-1-(2 -fluoroethyl)-6,8-difluoro-1,4-dihydro-4-oxo-3-quinolone carboxylic acid compounds
YAO Bin, ZHAO Jing-Pu, XU Bing-Xiang
(Department of Organic Chemistry, College of Pharmacy, Second Military Medical University, Shanghai 200433, China)
, http://www.100md.com
[ABSTRACT] Objective: To study the synthesis and antibacteria l activity of 7-substituted-1- (2-fluoroethyl)-6,8-difluoro-1, 4-dihyd ro-4-oxo-3-quinolone carboxylic acid compounds. Methods: The title compounds were synthesized by condensation,cyclization, nucleophilic s ubstitution. Antibacterial activity in vitro was determined with 6 kinds of common pathogenic bacteria. Results: Eleven compounds of 7-subs tituted-1-(2-fluoroethyl)-6,8-difluoro-1,4-dihydro-4-oxo-3-quinolon e carboxylic acid were designed and synthesized. These compounds were firstly re ported. The chemical structures of all compounds were determined by IR, 1 HNMR and elementary analysis. CompoundⅠ1,Ⅰ2,Ⅱ4 showed better an tibacterial activities than that of fleroxacin. Conclusion: Some of the title compounds show potent antibacterial activities and should be furth er studied.
, http://www.100md.com
[KEY WORDS] fluoroquinolones;chemical synthesis; antibacterial acti vity
氟喹诺酮是目前广泛应用于临床的一大类抗感染药物,目前仍存在着对G+菌的抗菌谱 较窄,对某些特定菌活性不够,生物利用度及血药浓度较低,毒副作用较大,安全性不高等 缺点[1,2],因此寻找高效、广谱、低毒性的喹诺酮类药物仍是一个热点课题。
目前已上市的绝大多数喹诺酮类药物是以1,4-二氢-4-氧-3-喹啉羧酸为母体,其中氟 罗沙星的抗菌谱广,有效血药浓度维持时间长的特点较为突出。文献报道7位取代基与药物 的抗菌谱、作用强度、药物动力学密切相关。根据国内外对其构效关系的研究[3] ,我们设计一优化的母体化合物(Ⅰ)。本文选用7-杂环和7-取代哌嗪进行结构修饰,以期 获得在抗菌谱、抗菌活性、毒副作用方面较为满意的化合物。
, 百拇医药
1 材料和方法
1.1 仪器和试剂 Yamato model MP-21型熔点测定仪(温度计未经校正); MOD -1106型元素分析仪; Hitachi 270-50型红外光谱仪,KBr压片法测定; Bruker Spectro spin AC-p300型磁共振仪,以DMSO-d6为溶剂,DDS为内标。氟罗沙星为无锡第二制药厂 产品,批号 970410。
1.2 合成方法 合成路线见图1。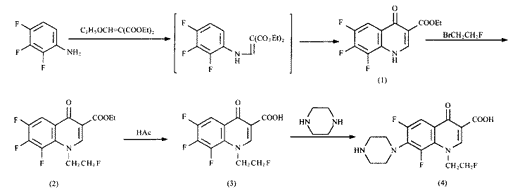
图 1 化合物的合成路线
Fig 1 Synthetic route of the compounds
1.2.1 6,7,8-三氟-1,4-二氢-4-氧-3- 喹啉羧酸乙酯[4](1)的制备 在四颈瓶中加入2,3,4-三氟苯胺4.15 g( 0.028 mol) ,乙氧基亚甲基丙二酸二乙酯6.71 g(0.031 mol),搅拌,缓慢升温至13 0℃,加入十六烷20.7 g,缓慢升温至250℃反应70 min,冷却,过滤,得浅咖啡色晶体,mp .>250℃, 产率 98.06%。
, http://www.100md.com
1.2.2 1-(2-氟乙基)-6,7,8-三氟-1,4-二氢-4-氧-3-喹啉羧酸 乙酯(2)的制备 取化合物(1)5.3 g(0.019 5 mol), DMF 40 ml,搅拌,在 80℃滴加1,2-氟溴乙烷4.7 g(0.037 mol),反应8 h,过滤,冷却,得白色结晶4.85 g,m p.175~178℃,产率78.23%。
1.2.3 1-(2-氟乙基)-6,7,8-三氟-1, 4-二氢-4-氧-3-喹啉羧酸(3)的制备 取化合物(2)2 g(0.006 3 mol),加 入水10 ml,冰醋酸3 ml,浓盐酸3 ml, 80℃反应2 h,倒入冰水中,得白色粉末1.5 g,mp . 206~210℃(文献mp. 213~215℃[5]), 产率82.26%。
1.2.4 7-(1-哌嗪基)-1-(2-氟乙基)-6,8-二氟-1,4-二氢-4-氧-3-喹啉羧 酸(4)的制备 取化合物(3)1.9 g(0.006 6 mol) , 加入DMSO 20 ml,无水哌嗪 3 g(0.034 9 mol),磁力搅拌,95℃反应6 h,冷却,用醋酸调pH=7,过滤,得淡黄色粉末 ,用DMF重结晶,烘干得1.15 g,mp. 259~261.5℃,产率83.98%。
, 百拇医药
1.2.5 7-[4′-(3″,5″-二氯苯甲酰基)-1′-哌嗪基]-1-(2-氟乙基) - 6,8-二氟-1,4-二氢-4-氧-3-喹啉羧酸(Ⅱ6)的制备 将化合物(4)0. 5 g(0.001 4 mol)置于反应瓶中,加入无水二氧六环10 ml,加入三乙胺适量,搅拌,滴加3 ,5-二氯苯甲酰氯0.9 g(0.004 3 mol,预先溶于5 ml DMF中),回流反应3 h。加适量的水 ,用醋酸调pH=6,过滤,得0.35 g固体,产率47.07%,用DMF重结晶,烘干得0.25 g, mp. 219~221℃。
Ⅰ1,Ⅰ2,Ⅱ1~Ⅱ9仍按上述类似方法制备。
1.2.6 7-(4′-亚硝基-1′-哌嗪基)-1-(2-氟乙基)-6,8-二氟-1,4-二氢-4 -氧-3-喹啉羧酸(Ⅱ4)的制备[6] 将化合物(4)0.5 g(0.001 4 m ol)置反应瓶中,加冰醋酸15 ml,搅拌,分批加入亚硝酸钠0.3 g(0.004 3 mol),室温反应 3 h,加适量水,过滤,烘干得0.5 g固体,mp. 283~284℃,收率92.45%。
, 百拇医药
1.3 抗菌实验 本研究采用临床常见细菌标准菌株6株:大肠杆菌(Escherichia coli )、金黄色葡萄球菌(Staphylococcus aureus)、巨大芽胞杆菌(Bacillus megatherium)、绿脓杆菌(Pseudomonas aeruginose)、克雷伯肺炎杆菌( Klebsiella pneumonia)和肺炎链球菌(Streptococcus pneumoniae),均由上海市 工业微生物研究所提供。用液体振荡培养法,采用MH(Muller-Hiatron)培养基, 把上述合成品配制成8.0,4.0,2.0,1.0,0.5,0.25,0.125 ,0.06,0.03 μg/ml溶液。同时设立空白组和以氟罗沙星标准品的对照组 。向每支试管中注入0.2 ml细菌混悬液(5×105个/ml),于适宜温度下置往 复式摇床上振荡培养一定的时间,取出,观察试管中细菌的生长情况,判断出药物的MIC。
2 结果和讨论
, 百拇医药
所合成的11个化合物均为首次报道,化合物结构经元素分析、IR,1HNMR确证,见表1。对 于目标化合物中7-位哌嗪基的引入,目前文献[7,8]中一般先与三乙酸硼酐形成 螯合物,然后接哌嗪基。考虑到7位处于4-位羰基的对位,电子云密度较低,易发生亲核取 代反应。文献报道[9,10]3-位为羧酸比3-位羧酸酯更有利于7-位的取代反应, 因此我们先水解后亲核取代,缩短反应步骤,操作简单,收率也较好。合成的11个化合物对 6种常见细菌的最低抑菌浓度(MIC)见表2。
表 1 目标化合物的物理数据
Tab 1 Physical data of the title compounds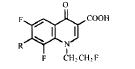 Compounda
Compounda
R
, http://www.100md.com
MP(t/℃)
Yield(%)
IR (λ/cm-1)
1 HNMR
(DMSO-d6/DDS,δ)
Ⅰ1
281-282
64.90
3 451, 1 732,1 621, 1 437
, http://www.100md.com 8.86(1H,s, 2-H); 7.91(1H,d, 5-H);5.49(1H,s,-OH); 4.82-4.98(4H,m, CH2CH2F);3.20(1H,m, 4′-H); 2.69(4H,m, 3′,5′-H);1.58(4H,m, 2′,6′-H)
Ⅰ2
293-295
65.71
3 450,1 725,1 620,1 412
9.1 6(1H,s, 2-H ); 8.09(1H,d, 5-H); 4.84-5.16(4H,m,CH2CH2F); 3.41-4.33 (9H,m,piperidinyl-H);2.10 (3H, s, -COCH3)
, 百拇医药
Ⅱ1
279-281
67.33
3 435,1 728,1 625,1 525,865
8.80(1H,s, 2-H); 7.93(1H,d, 5-H);7.35(1H,t,phenyl-5′-H); 7.20(1H,s,phenyl-2′-H); 7.16 (1H,d, phenyl- 6′-H);6.94(1H,d, phenyl- 4′-H);4.90-5.10 (4H,m,CH2CH2F); 3.21-3.87(8H,m,piperazinyl-H); 3.70(3H,s, CH3O)
, 百拇医药
Ⅱ2
284-286
81.90
3 435,1 725,1 628,1 387,807
8.8 6(1H,s, 2-H); 8.07(1H,d, 5-H); 8.17(1H,d,phenyl- 6′-H); 8.15(1H,s, phenyl - 2′-H); 7.72(1H,d, phenyl- 4′-H); 7.58(1H,m, phenyl- 5′-H); 4.84-5.10(4H,m,CH2CH2F); 3.60-4.14(8H,m, piperazinyl-H)
Ⅱ3
, 百拇医药
277-279
85.42
3 450,1 725,1 621,1 546,740
9.2 3(1H,s, 2-H); 8.24(1H,d, 5-H); 4.89-5.30(4H,m,CH2CH2F); 4.39(2H,s,COCH2 - piperazine); 3.65-4.10(8H,m, piperazinyl-H)
Ⅱ4
283-284
92.45
, 百拇医药
3 435,3 057,2 918,1 724,1 620, 740
9.23(1H,s,2-H); 8.23(1H,d, 5-H); 4.89-5.32(4H,m,CH2CH2F)); 3.73-4.56(8H,m, piperazinyl-H)
Ⅱ5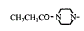
251-254
91.33
3 435,1 625,1 525, 806
9.23(1H,s,2-H); 8. 10(1H,d,JH-F=12 Hz,5-H);4.90-5.06(4H,m,CH2CH2F); 3.27-3.54(8H, m,piperazinyl-H); 2.33(2H,q, CH3CH2CO);1.20(3H,t, CH3CH2CO)
, http://www.100md.com
Ⅱ6
219-221
47.07
3 443,2 852,1 725,1 628,1 562, 743
9.20(1H,s, 2-H); 8.19(1H,d, 5-H); 7.56(1H,s, phenyl-4′-H); 7.40(2H,s, phenyl-2′6′ -H); 4.89-5.29(4H,m,CH2CH2F); 3. 76-4.16(8H,m,piperazinyl-H);
Ⅱ7
, http://www.100md.com
224-226
34.86
3 435,1 725,1 350,1 162,820
9.16(1H,s,2-H); 8.11(1H,d,5-H); 7.72(2H,d,phenyl-2′6′-H); 7.45(2H,d, phenyl-3 ′5′-H); 4.84-5.25(4H,m,CH2CH2F); 3.18 -3.71(8H,m,piperazinyl-H);2.46(3H,s, CH3Ar)
Ⅱ8
173-175
, http://www.100md.com
95.58
3 435,3 107,2 926,1 725,1 162, 7403.72
9.15(1H,s,2-H); 8.12(1H,d,5-H);7.86(4H,m, phenyl-H); 4.84-5.24(4H,m,CH2CH2F); 3.20 -(8H,m, piperazinyl-H); 2.473H,s, CH 3CO)
Ⅱ9
227-230
39.07
3 435,3 057,1 725,1 352,1 170, 820
, 百拇医药
9.1 4(1H,s,2-H); 8.11(1H,d,5-H); 7.46-8.01(7H,m,naphthyl-H); 4.98-5.23(4H,m, CH2CH2F); 3.74-4.08(8H,m,piperazinyl-H)
a Elemental analysis for C,H,N of all compounds are within 0.5% of calcula ted values表 2 化合物的体外抗菌活性
Tab 2 Antibacterial activity of the title compounds in vitro (MIC)
(ρB/μg.ml-1) Compound
, http://www.100md.com
Escherichia coli(ATCC25922)
Staphylococcus
aureus
(ATCC25923)
Bacillus
megatherium
[CMCC(B)63013]
Pseudomonas
aeruginose
(ATCC27853)
Klebsiella
, 百拇医药
pneumoniae
[ATCC(10031)]
Streptococcus
pneumoniae
(ATCC49619)
Ⅰ1
0.25
0.06
0.25
0.06
0.06
0.06
, http://www.100md.com
Ⅰ2
0.5
0.06
0.5
0.125
0.03
0.5
Ⅱ1
4.0
4.0
>8.0
>8.0
>8.0
, 百拇医药
>8.0
Ⅱ2
4.0
2.0
8.0
>8.0
>8.0
>8. 0
Ⅱ3
2.0
>8.0
4.0
4.0
, 百拇医药
4.0
>8.0
Ⅱ4
0.125
0.5
0.5
1.0
0.25
1.0
Ⅱ5
2.0
>8.0
4.0
, http://www.100md.com
4.0
4.0
>8.0
Ⅱ6
4.0
>8.0
4.0
>8.0
>8.0
>8.0
Ⅱ7
1.0
4.0
, 百拇医药
1.0
2.0
2.0
4.0
Ⅱ8
0.25
2.0
1.0
1.0
0.25
1.0
Ⅱ9
2.0
, http://www.100md.com
4.0
2.0
2.0
4.0
>8.0
Fleroxacin
0.06
0.125
0.125
0.25
0.06
0.125
体外抗菌活性实验以氟罗沙星为对照品,发现在母体化合物的7位引入吸电子的取代哌 啶基的化合物如Ⅰ1,Ⅰ2抗菌活性增强,优于其他取代基取代的目标化合物。化合物Ⅰ 1对肺炎杆菌抗菌效果与氟罗沙星相当,对金黄色葡萄球菌、绿脓杆菌、肺炎链球菌抗菌 效果明显优于氟罗沙星;化合物Ⅰ2对金黄色葡萄球菌、绿脓杆菌、克雷伯肺炎杆菌抗菌 效果优于氟罗沙星,化合物Ⅰ1,Ⅰ2值得进一步深入研究。以酰基或磺酰基取代的哌嗪 类目标化合物抗菌活性一般,与氟罗沙星相比抗菌效果较弱,但其中Ⅱ4,Ⅱ8对某些菌 如大肠杆菌、克雷伯肺炎杆菌的抗菌效果也较好。
, http://www.100md.com
[作者简介] 姚斌(1969-),男(汉族),硕士,讲师.
[参 考 文 献]
[1] Chu DTW, Plattner JJ, Katz L. New directions in antibacterial r esearch[J]. J Med Chem, 1996, 39(20):3853-3874.
[2] Byrskier A. Novelties in the field of fluoroquinolones[J].Exp Opin Invest Drugs, 1997, 30(6):1227-1232.
[3] 郭惠元. 吡酮酸类抗菌药及其发展方向[J]. 国外医药*合成药 生化药 制 剂分册, 1990, 11(2):68-74.
, http://www.100md.com
[4] 王尔华,金 熔. 氟喹诺酮类抗菌剂氟罗沙星合成工艺研究[J]. 中国药科 大学学报, 1995, 26(6):321-323.
[5] Irikura T, Koga H, Murayama S.Quinoline carboxylic acid derivatives w ith antibacterial activity[P].US Pat 4398029,1981-02-27.
[6] Irikara T, Sarue S, Ito A, et al. Substituted quinoline carboxyl ic acid derivatives[P].US Pat 4448962,1981-10-14.
[7] 周伟澄. 氟喹诺酮类抗菌药物的合成[J]. 中国医药工业杂志, 1992, 23(5) :226-237.
, 百拇医药
[8] 张洪北. 新喹诺酮类抗菌药合成路线概述[J]. 中国医药工业杂志, 1991, 2 2(1):37-43.
[9] Moran DB, Ziegler CB Jr, Dunne TS, et al. Synthesis of novel 5-f luoro-analogues of norfloxacin and ciprofloxacin[J]. J Med Chem, 1989, 32(6) :1313-1318.
[10] Miyamoto T, Matsumoto JI, Chiba K, et al. Sy nthesis and structive-activity relationships of 5-substituted 6,8-difluoroqui nolones, including sparfloxacin, a new quinolone antibacterial agent with improv ed potency[J]. J Med Chem, 1990, 33(6):1645-1655.
[收稿日期] 2000-02-23
[修回日期] 2000-07-20, 百拇医药
单位:姚斌(第二军医大学药学院有机化学教研室,上海 200433);赵京浦(第二军医大学药学院有机化学教研室,上海 200433);徐炳祥(第二军医大学药学院有机化学教研室,上海 200433)
关键词:氟喹诺酮;化学合成;抗菌活性
第二军医大学学报001008 [摘要] 目的:研究7-取代-1-(2-氟 乙基)-6,8-二氟-1,4-二氢-4-氧-3-喹啉羧酸的合成及其抗菌活性。方 法:通过高温下缩合、环化、亲核取代得到关键中间体,然后通过反应制得目 标化合物。选用临床常见的6株致病菌的标准菌株进行体外抗菌活性测定。结果: 设计合成11个化合物,均为首次报道。通过IR,1HNMR和元素分析来确证化合 物的结构。体外抗菌活性实验以氟罗沙星为对照品,其中化合物Ⅰ1,Ⅰ2,Ⅱ4的抗 菌活性较强。结论:合成的11个化合物中有一些化合物显示较好的抗 菌活性,值得进一步深入研究。
, 百拇医药
[中图分类号] R 978.19 [文献标识码] A
[文章编号] 0258-879X(2000)10-0928-04
Synthesis and antibacterial activity of 7-substituted-1-(2 -fluoroethyl)-6,8-difluoro-1,4-dihydro-4-oxo-3-quinolone carboxylic acid compounds
YAO Bin, ZHAO Jing-Pu, XU Bing-Xiang
(Department of Organic Chemistry, College of Pharmacy, Second Military Medical University, Shanghai 200433, China)
, http://www.100md.com
[ABSTRACT] Objective: To study the synthesis and antibacteria l activity of 7-substituted-1- (2-fluoroethyl)-6,8-difluoro-1, 4-dihyd ro-4-oxo-3-quinolone carboxylic acid compounds. Methods: The title compounds were synthesized by condensation,cyclization, nucleophilic s ubstitution. Antibacterial activity in vitro was determined with 6 kinds of common pathogenic bacteria. Results: Eleven compounds of 7-subs tituted-1-(2-fluoroethyl)-6,8-difluoro-1,4-dihydro-4-oxo-3-quinolon e carboxylic acid were designed and synthesized. These compounds were firstly re ported. The chemical structures of all compounds were determined by IR, 1 HNMR and elementary analysis. CompoundⅠ1,Ⅰ2,Ⅱ4 showed better an tibacterial activities than that of fleroxacin. Conclusion: Some of the title compounds show potent antibacterial activities and should be furth er studied.
, http://www.100md.com
[KEY WORDS] fluoroquinolones;chemical synthesis; antibacterial acti vity
氟喹诺酮是目前广泛应用于临床的一大类抗感染药物,目前仍存在着对G+菌的抗菌谱 较窄,对某些特定菌活性不够,生物利用度及血药浓度较低,毒副作用较大,安全性不高等 缺点[1,2],因此寻找高效、广谱、低毒性的喹诺酮类药物仍是一个热点课题。
目前已上市的绝大多数喹诺酮类药物是以1,4-二氢-4-氧-3-喹啉羧酸为母体,其中氟 罗沙星的抗菌谱广,有效血药浓度维持时间长的特点较为突出。文献报道7位取代基与药物 的抗菌谱、作用强度、药物动力学密切相关。根据国内外对其构效关系的研究[3] ,我们设计一优化的母体化合物(Ⅰ)。本文选用7-杂环和7-取代哌嗪进行结构修饰,以期 获得在抗菌谱、抗菌活性、毒副作用方面较为满意的化合物。

, 百拇医药
1 材料和方法
1.1 仪器和试剂 Yamato model MP-21型熔点测定仪(温度计未经校正); MOD -1106型元素分析仪; Hitachi 270-50型红外光谱仪,KBr压片法测定; Bruker Spectro spin AC-p300型磁共振仪,以DMSO-d6为溶剂,DDS为内标。氟罗沙星为无锡第二制药厂 产品,批号 970410。
1.2 合成方法 合成路线见图1。

图 1 化合物的合成路线
Fig 1 Synthetic route of the compounds
1.2.1 6,7,8-三氟-1,4-二氢-4-氧-3- 喹啉羧酸乙酯[4](1)的制备 在四颈瓶中加入2,3,4-三氟苯胺4.15 g( 0.028 mol) ,乙氧基亚甲基丙二酸二乙酯6.71 g(0.031 mol),搅拌,缓慢升温至13 0℃,加入十六烷20.7 g,缓慢升温至250℃反应70 min,冷却,过滤,得浅咖啡色晶体,mp .>250℃, 产率 98.06%。
, http://www.100md.com
1.2.2 1-(2-氟乙基)-6,7,8-三氟-1,4-二氢-4-氧-3-喹啉羧酸 乙酯(2)的制备 取化合物(1)5.3 g(0.019 5 mol), DMF 40 ml,搅拌,在 80℃滴加1,2-氟溴乙烷4.7 g(0.037 mol),反应8 h,过滤,冷却,得白色结晶4.85 g,m p.175~178℃,产率78.23%。
1.2.3 1-(2-氟乙基)-6,7,8-三氟-1, 4-二氢-4-氧-3-喹啉羧酸(3)的制备 取化合物(2)2 g(0.006 3 mol),加 入水10 ml,冰醋酸3 ml,浓盐酸3 ml, 80℃反应2 h,倒入冰水中,得白色粉末1.5 g,mp . 206~210℃(文献mp. 213~215℃[5]), 产率82.26%。
1.2.4 7-(1-哌嗪基)-1-(2-氟乙基)-6,8-二氟-1,4-二氢-4-氧-3-喹啉羧 酸(4)的制备 取化合物(3)1.9 g(0.006 6 mol) , 加入DMSO 20 ml,无水哌嗪 3 g(0.034 9 mol),磁力搅拌,95℃反应6 h,冷却,用醋酸调pH=7,过滤,得淡黄色粉末 ,用DMF重结晶,烘干得1.15 g,mp. 259~261.5℃,产率83.98%。
, 百拇医药
1.2.5 7-[4′-(3″,5″-二氯苯甲酰基)-1′-哌嗪基]-1-(2-氟乙基) - 6,8-二氟-1,4-二氢-4-氧-3-喹啉羧酸(Ⅱ6)的制备 将化合物(4)0. 5 g(0.001 4 mol)置于反应瓶中,加入无水二氧六环10 ml,加入三乙胺适量,搅拌,滴加3 ,5-二氯苯甲酰氯0.9 g(0.004 3 mol,预先溶于5 ml DMF中),回流反应3 h。加适量的水 ,用醋酸调pH=6,过滤,得0.35 g固体,产率47.07%,用DMF重结晶,烘干得0.25 g, mp. 219~221℃。
Ⅰ1,Ⅰ2,Ⅱ1~Ⅱ9仍按上述类似方法制备。
1.2.6 7-(4′-亚硝基-1′-哌嗪基)-1-(2-氟乙基)-6,8-二氟-1,4-二氢-4 -氧-3-喹啉羧酸(Ⅱ4)的制备[6] 将化合物(4)0.5 g(0.001 4 m ol)置反应瓶中,加冰醋酸15 ml,搅拌,分批加入亚硝酸钠0.3 g(0.004 3 mol),室温反应 3 h,加适量水,过滤,烘干得0.5 g固体,mp. 283~284℃,收率92.45%。
, 百拇医药
1.3 抗菌实验 本研究采用临床常见细菌标准菌株6株:大肠杆菌(Escherichia coli )、金黄色葡萄球菌(Staphylococcus aureus)、巨大芽胞杆菌(Bacillus megatherium)、绿脓杆菌(Pseudomonas aeruginose)、克雷伯肺炎杆菌( Klebsiella pneumonia)和肺炎链球菌(Streptococcus pneumoniae),均由上海市 工业微生物研究所提供。用液体振荡培养法,采用MH(Muller-Hiatron)培养基, 把上述合成品配制成8.0,4.0,2.0,1.0,0.5,0.25,0.125 ,0.06,0.03 μg/ml溶液。同时设立空白组和以氟罗沙星标准品的对照组 。向每支试管中注入0.2 ml细菌混悬液(5×105个/ml),于适宜温度下置往 复式摇床上振荡培养一定的时间,取出,观察试管中细菌的生长情况,判断出药物的MIC。
2 结果和讨论
, 百拇医药
所合成的11个化合物均为首次报道,化合物结构经元素分析、IR,1HNMR确证,见表1。对 于目标化合物中7-位哌嗪基的引入,目前文献[7,8]中一般先与三乙酸硼酐形成 螯合物,然后接哌嗪基。考虑到7位处于4-位羰基的对位,电子云密度较低,易发生亲核取 代反应。文献报道[9,10]3-位为羧酸比3-位羧酸酯更有利于7-位的取代反应, 因此我们先水解后亲核取代,缩短反应步骤,操作简单,收率也较好。合成的11个化合物对 6种常见细菌的最低抑菌浓度(MIC)见表2。
表 1 目标化合物的物理数据
Tab 1 Physical data of the title compounds
 Compounda
CompoundaR
, http://www.100md.com
MP(t/℃)
Yield(%)
IR (λ/cm-1)
1 HNMR
(DMSO-d6/DDS,δ)
Ⅰ1

281-282
64.90
3 451, 1 732,1 621, 1 437
, http://www.100md.com 8.86(1H,s, 2-H); 7.91(1H,d, 5-H);5.49(1H,s,-OH); 4.82-4.98(4H,m, CH2CH2F);3.20(1H,m, 4′-H); 2.69(4H,m, 3′,5′-H);1.58(4H,m, 2′,6′-H)
Ⅰ2
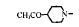
293-295
65.71
3 450,1 725,1 620,1 412
9.1 6(1H,s, 2-H ); 8.09(1H,d, 5-H); 4.84-5.16(4H,m,CH2CH2F); 3.41-4.33 (9H,m,piperidinyl-H);2.10 (3H, s, -COCH3)
, 百拇医药
Ⅱ1

279-281
67.33
3 435,1 728,1 625,1 525,865
8.80(1H,s, 2-H); 7.93(1H,d, 5-H);7.35(1H,t,phenyl-5′-H); 7.20(1H,s,phenyl-2′-H); 7.16 (1H,d, phenyl- 6′-H);6.94(1H,d, phenyl- 4′-H);4.90-5.10 (4H,m,CH2CH2F); 3.21-3.87(8H,m,piperazinyl-H); 3.70(3H,s, CH3O)
, 百拇医药
Ⅱ2

284-286
81.90
3 435,1 725,1 628,1 387,807
8.8 6(1H,s, 2-H); 8.07(1H,d, 5-H); 8.17(1H,d,phenyl- 6′-H); 8.15(1H,s, phenyl - 2′-H); 7.72(1H,d, phenyl- 4′-H); 7.58(1H,m, phenyl- 5′-H); 4.84-5.10(4H,m,CH2CH2F); 3.60-4.14(8H,m, piperazinyl-H)
Ⅱ3
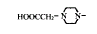
, 百拇医药
277-279
85.42
3 450,1 725,1 621,1 546,740
9.2 3(1H,s, 2-H); 8.24(1H,d, 5-H); 4.89-5.30(4H,m,CH2CH2F); 4.39(2H,s,COCH2 - piperazine); 3.65-4.10(8H,m, piperazinyl-H)
Ⅱ4

283-284
92.45
, 百拇医药
3 435,3 057,2 918,1 724,1 620, 740
9.23(1H,s,2-H); 8.23(1H,d, 5-H); 4.89-5.32(4H,m,CH2CH2F)); 3.73-4.56(8H,m, piperazinyl-H)
Ⅱ5
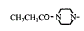
251-254
91.33
3 435,1 625,1 525, 806
9.23(1H,s,2-H); 8. 10(1H,d,JH-F=12 Hz,5-H);4.90-5.06(4H,m,CH2CH2F); 3.27-3.54(8H, m,piperazinyl-H); 2.33(2H,q, CH3CH2CO);1.20(3H,t, CH3CH2CO)
, http://www.100md.com
Ⅱ6

219-221
47.07
3 443,2 852,1 725,1 628,1 562, 743
9.20(1H,s, 2-H); 8.19(1H,d, 5-H); 7.56(1H,s, phenyl-4′-H); 7.40(2H,s, phenyl-2′6′ -H); 4.89-5.29(4H,m,CH2CH2F); 3. 76-4.16(8H,m,piperazinyl-H);
Ⅱ7

, http://www.100md.com
224-226
34.86
3 435,1 725,1 350,1 162,820
9.16(1H,s,2-H); 8.11(1H,d,5-H); 7.72(2H,d,phenyl-2′6′-H); 7.45(2H,d, phenyl-3 ′5′-H); 4.84-5.25(4H,m,CH2CH2F); 3.18 -3.71(8H,m,piperazinyl-H);2.46(3H,s, CH3Ar)
Ⅱ8

173-175
, http://www.100md.com
95.58
3 435,3 107,2 926,1 725,1 162, 7403.72
9.15(1H,s,2-H); 8.12(1H,d,5-H);7.86(4H,m, phenyl-H); 4.84-5.24(4H,m,CH2CH2F); 3.20 -(8H,m, piperazinyl-H); 2.473H,s, CH 3CO)
Ⅱ9

227-230
39.07
3 435,3 057,1 725,1 352,1 170, 820
, 百拇医药
9.1 4(1H,s,2-H); 8.11(1H,d,5-H); 7.46-8.01(7H,m,naphthyl-H); 4.98-5.23(4H,m, CH2CH2F); 3.74-4.08(8H,m,piperazinyl-H)
a Elemental analysis for C,H,N of all compounds are within 0.5% of calcula ted values表 2 化合物的体外抗菌活性
Tab 2 Antibacterial activity of the title compounds in vitro (MIC)
(ρB/μg.ml-1) Compound
, http://www.100md.com
Escherichia coli(ATCC25922)
Staphylococcus
aureus
(ATCC25923)
Bacillus
megatherium
[CMCC(B)63013]
Pseudomonas
aeruginose
(ATCC27853)
Klebsiella
, 百拇医药
pneumoniae
[ATCC(10031)]
Streptococcus
pneumoniae
(ATCC49619)
Ⅰ1
0.25
0.06
0.25
0.06
0.06
0.06
, http://www.100md.com
Ⅰ2
0.5
0.06
0.5
0.125
0.03
0.5
Ⅱ1
4.0
4.0
>8.0
>8.0
>8.0
, 百拇医药
>8.0
Ⅱ2
4.0
2.0
8.0
>8.0
>8.0
>8. 0
Ⅱ3
2.0
>8.0
4.0
4.0
, 百拇医药
4.0
>8.0
Ⅱ4
0.125
0.5
0.5
1.0
0.25
1.0
Ⅱ5
2.0
>8.0
4.0
, http://www.100md.com
4.0
4.0
>8.0
Ⅱ6
4.0
>8.0
4.0
>8.0
>8.0
>8.0
Ⅱ7
1.0
4.0
, 百拇医药
1.0
2.0
2.0
4.0
Ⅱ8
0.25
2.0
1.0
1.0
0.25
1.0
Ⅱ9
2.0
, http://www.100md.com
4.0
2.0
2.0
4.0
>8.0
Fleroxacin
0.06
0.125
0.125
0.25
0.06
0.125
体外抗菌活性实验以氟罗沙星为对照品,发现在母体化合物的7位引入吸电子的取代哌 啶基的化合物如Ⅰ1,Ⅰ2抗菌活性增强,优于其他取代基取代的目标化合物。化合物Ⅰ 1对肺炎杆菌抗菌效果与氟罗沙星相当,对金黄色葡萄球菌、绿脓杆菌、肺炎链球菌抗菌 效果明显优于氟罗沙星;化合物Ⅰ2对金黄色葡萄球菌、绿脓杆菌、克雷伯肺炎杆菌抗菌 效果优于氟罗沙星,化合物Ⅰ1,Ⅰ2值得进一步深入研究。以酰基或磺酰基取代的哌嗪 类目标化合物抗菌活性一般,与氟罗沙星相比抗菌效果较弱,但其中Ⅱ4,Ⅱ8对某些菌 如大肠杆菌、克雷伯肺炎杆菌的抗菌效果也较好。
, http://www.100md.com
[作者简介] 姚斌(1969-),男(汉族),硕士,讲师.
[参 考 文 献]
[1] Chu DTW, Plattner JJ, Katz L. New directions in antibacterial r esearch[J]. J Med Chem, 1996, 39(20):3853-3874.
[2] Byrskier A. Novelties in the field of fluoroquinolones[J].Exp Opin Invest Drugs, 1997, 30(6):1227-1232.
[3] 郭惠元. 吡酮酸类抗菌药及其发展方向[J]. 国外医药*合成药 生化药 制 剂分册, 1990, 11(2):68-74.
, http://www.100md.com
[4] 王尔华,金 熔. 氟喹诺酮类抗菌剂氟罗沙星合成工艺研究[J]. 中国药科 大学学报, 1995, 26(6):321-323.
[5] Irikura T, Koga H, Murayama S.Quinoline carboxylic acid derivatives w ith antibacterial activity[P].US Pat 4398029,1981-02-27.
[6] Irikara T, Sarue S, Ito A, et al. Substituted quinoline carboxyl ic acid derivatives[P].US Pat 4448962,1981-10-14.
[7] 周伟澄. 氟喹诺酮类抗菌药物的合成[J]. 中国医药工业杂志, 1992, 23(5) :226-237.
, 百拇医药
[8] 张洪北. 新喹诺酮类抗菌药合成路线概述[J]. 中国医药工业杂志, 1991, 2 2(1):37-43.
[9] Moran DB, Ziegler CB Jr, Dunne TS, et al. Synthesis of novel 5-f luoro-analogues of norfloxacin and ciprofloxacin[J]. J Med Chem, 1989, 32(6) :1313-1318.
[10] Miyamoto T, Matsumoto JI, Chiba K, et al. Sy nthesis and structive-activity relationships of 5-substituted 6,8-difluoroqui nolones, including sparfloxacin, a new quinolone antibacterial agent with improv ed potency[J]. J Med Chem, 1990, 33(6):1645-1655.
[收稿日期] 2000-02-23
[修回日期] 2000-07-20, 百拇医药