HIV-1整合酶单链抗体在大肠杆菌中的表达、纯化与鉴定
作者:张健慧 宋晓国 孟莉 冯玉英 韩保光 凌世淦 马贤凯
单位:张健慧 宋晓国 孟莉 冯玉英 韩保光 凌世淦 马贤凯(军事医学科学院基础医学研究所,北京100850)
关键词:人类免疫缺陷病毒;整合酶;单链抗体
细胞与分子免疫学杂志990104
摘要 将具有HIV-1整合酶结合活性的单链抗体重组噬菌体感染HB2151大肠杆菌,经IPTG诱导,在周质腔萃取物及培养基上清中,均检测到有较特异与整合酶结合的可溶性单链抗体的表达。利用HiTrapAntiEtag柱对单链抗体进行了亲和层析纯化。Western-blot结果初步表明,单链抗体不仅可与整合酶的单体反应,而且也可与其二聚体结合。提示:研制的单链抗体可用于对HIV-1整合酶活性影响的研究。
中国图书资料分类号 Q78
, http://www.100md.com
Expression, purification and identification of single chain fragments variable(ScFv) antibody against HIV-1 integrase(IN)
Zhang Jianhui, Song Xiaoguo, Meng Li, Feng Yuying, Han Baoguang, Ling Shigan, Ma Xiankai (Institute of Basic Medical Sciences, Academy of Military Medical Sciences, Beijing 100850)
Keywords HIV integrase ScFv
Abstract E. coli HB2151 was infected with recombinant HIV-1 integrase binding ScFv phages. After induced by IPTG, expression of soluble ScFv characterized by specific binding to IN protein was detected in the bacteria periplasm and supernatant of culture medium. Using HiTrap Anti-E tag column, the ScFv was purified by affinity chromatography. The preliminary results of Western-blot showed that the ScFv could bind to both oligomer and dimer of IN protein. It was indicated that the ScFv could be used for study its possible role in inhibiting IN activities.
, 百拇医药
目前,AIDS的治疗尚无特效疗法。因病毒基因突变致机体迅速产生的抗药性,要求不断研制作用于HIV多个靶位的新制剂。HIV整合酶(integrase,IN)为HIVpol基因3'端编码的Mr为32000的蛋白质,它介导的病毒cDNA与宿主细胞染色体DNA的整合过程为HIV复制的基本步骤,因此,IN为治疗AIDS的理想靶位之一〔1〕。为探索AIDS治疗的新途径,我们研制了HIV-1IN的噬菌体单链可变区抗体(single chain fragments variable,ScFv)。本研究将此ScFv在大肠杆菌中进行了可溶性表达与亲和层析纯化,并证明有较特异结合IN的活性。
1 材料和方法
1.1 材料 所用试剂均为AR或分子生物学纯。重组HIV-1IN,由本实验室制备。噬菌体单链可变区抗体:以重组IN免疫的Balb/c小鼠脾脏mRNA为来源,利用噬菌体表面呈现技术,获得了ScFv重组噬菌体库。经抗原亲和富集,筛选出具有IN结合活性的单链噬菌体抗体,ScFvDNA序列分析表明,符合鼠的抗体序列,详见参考文献〔2〕。
, 百拇医药
1.2 方法
1.2.1 ScFv的可溶性表达 将与IN有结合活性的重组噬菌体感染培养至对数生长期的HB2151宿主菌(Pharmacia),30℃振摇1h。以感染菌涂布SOBAGN平板,30℃温育过夜。挑取单个菌落以2×YT培养基于30℃培养过夜。将过夜培养物以1∶10接种于2×YTAG培养基中,37℃培养至A600值为0.8,更换为2×YTAI培养基,于30℃温育20h~24h。
1.2.2大肠杆菌周质腔分泌物的萃取将过夜培养物以1500×g离心20min,菌体重悬于2%培养基体积的TES(0.2mol/LTrisHC1,0.5mmol/LEDTA,0.5mol/Lsucrose)中,再加入3.3%体积的1/5×TES混匀,置冰上40min,同上离心,以0.45μm滤膜过滤后,4℃保存。
1.2.3 培养基上清的硫酸铵沉淀 于培养基上清中,加入50%饱和度的硫酸铵,室温搅拌1h,2500×g离心40min,沉淀重悬于PBS中,并以PBS反复透析24h。
, 百拇医药
1.2.4 ScFv的纯化 由于ScFv的C端带有13个氨基酸残基的Etag肽,故利用HRP标记的鼠抗Tag IgG,用ELISA方法可检测与IN结合的ScFv的表达情况,并可用HiTrapAnti-ETag亲和层析柱对ScFv纯化。
将1L培养菌的周质腔萃取物及经硫酸铵沉淀的培养基上清混合并超滤至10ml,上样于已经结合缓冲液(0.2mol/LPB,pH7.0)平衡的HiTrapAnti-Etag亲和层析柱(Pharmacia)上,样品流速为5ml/min。先以结合缓冲液洗去杂蛋白后,再以洗脱缓冲液(1.0mol/L甘氨酸,pH3.0)洗脱结合在柱上的ScFv。将含有ScFv的组分立即以中和缓冲液(1.0mol/LTris,0.05%NaN3,pH8.2)调整至pH7.2,经紫外分光光度计定量后,4℃保存备用。
1.2.5 ELISA 纯化的IN蛋白以0.05mol/LpH9.6碳酸盐缓冲液稀释至2μg/ml后包被酶联板,37℃2h,用1%BSA4℃封闭过夜。加入以2%BSA稀释的大肠杆菌周质腔萃取物或培养上清,室温作用2h。洗涤后,加入稀释的HRP标记的鼠抗ETagIgG,室温继续孵育1h~2h,洗涤后,OPD显色10min,测A490nm值。
, 百拇医药
1.2.6 SDS-PAGE 参照文献〔3〕进行。
1.2.7 Westernblot分析 ①ScFv表达产物的分析:将可溶性表达、纯化的ScFv以SDS-PAGE分离后,转移到硝酸纤维素膜上,加5%脱脂奶粉封闭过夜后,继加鼠抗ETagIgG,室温孵育2h,洗涤后用DAB底物显色。②ScFv与IN结合活性的分析:纯化的IN蛋白以SDS-PAGE分离后转膜,同上封闭后,加入1∶100稀释的纯化ScFv,室温作用2h,洗涤后加入HRP标记的鼠抗ETagIgG,同上孵育及显色。
2 结果
2.1 ScFv的可溶性表达 克隆在pCANTAB5E噬菌粒(图1)上的ScFv基因,其5'端与基因3蛋白的分泌信号融合;3'端通过ETagDNA片段与基因3结构基因融合。ETag与基因3间有一琥珀终止密码子。在该终止密码子非抑制表型HB2151大肠杆菌中,ScFv以游离形式表达,并在基因3信号肽介导下分泌到周质腔中进行折叠,形成功能性的ScFv。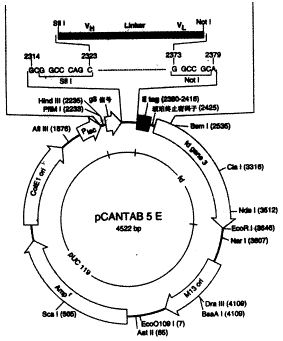
, 百拇医药
图1pCANTAB5EScFv表达质粒的结构(示意图)
Fig 1 Construction of pCANTAB 5E-ScFv expression vector
我们将76个与IN有结合活性克隆的重组噬菌体进行了ScFv的可溶性表达。ELISA结果显示,59个克隆的培养基上清及周质腔萃取物经1∶100稀释后,均可检出有IN结合活性的ScFv;而HB2151空菌的培养上清与周质腔萃取物均不与IN起反应。
根据测序结果,ScFv基因的全长为768bp(包括ScFv基因C端的ETagDNA片段),编码256个氨基酸,经推算其表达产物的Mr为28000。由SDS-PAGE的结果(图2)可见,ScFv的周质腔萃取物及培养上清经亲和层析纯化后,得到较纯的Mr为28000的条带,其下方还有两条Mr较小的带,推测可能为培养及纯化过程中ScFv的降解产物。经Western-blot分析证实,Mr为28000的蛋白即为带有E-Tag的ScFv;而其降解产物与Anti-ETag的结合活性较弱,仅见痕量的显色带。以Western-blot证实于上样前的样品中,也可测到明显的Mr为28000的ScFv带。
, 百拇医药
图 2 ScFv的表达及其纯化产物的Western-blot分析
Fig 2 Western-blot analysis of the expressed and purified ScFv
1:Protein relative molecular mass(Mr); 2:ScFv before purification (mixture of periplasmic extract and culture medium concentrated by (NH)2SO4 precipitation); 3:ScFv purified by HiTrap Anti-E Tag affinity column; 4:Anti-E Tag binding characteristic of ScFv 23 loaded on lane 2; 5:Anti-E Tag binding characteristic of ScFv 23 loaded on lane 3
, 百拇医药
2.2 ScFv与IN蛋白的结合活性与特异性鉴定 如图3所示,纯化后的IN蛋白在SDSPAGE分析时,除Mr为32000的带外,在Mr约64000处还有1条很浅的蛋白带,推测可能为IN蛋白的二聚体。以等量的标本上样,经Western-blot分析鉴定证明,纯化的ScFv不仅能与Mr为32000的IN蛋白结合,而且也可与微量存在的IN蛋白的二聚体起反应。
图 3 ScFv与IN结合特性的Western-blot分析
Fig 3 Western-blot analysis of IN binding characteristic of ScFv
1:Protein relative molecular mass (Mr); 2:SDS PAGE analysis of purified IN; 3: Western blot analysis of IN binding characteristic of purified ScFv
, http://www.100md.com
为鉴定ScFv与IN结合的特异性,我们分别以IN蛋白及等量的重组HIV穿膜蛋白(GP41)、重组HBV前S抗原(C/2)及人前列腺特异性抗原单克隆抗体(PSA)3种无关蛋白包被酶联板,将1株纯化的ScFv以BSA倍比稀释后,同时进行ELISA检测(图4)。结果显示,即使在较高稀释浓度(1∶212)时,ScFv仍有结合IN蛋白的活性;仅在较高浓度(1∶23稀释度以下)时,才显示ScFv与GP41和C/2有轻微的交叉反应,而各浓度的ScFv与PSA蛋白均无反应。
图4 ScFv与几种蛋白的ELISA的反应性
Fig 4 Binding of the ScFv to various proteins showed by ELISA
3 讨论
, http://www.100md.com
IN蛋白的难溶性是其晶体结构及活性位点的天然构象尚未完全明确,因而IN抑制物的发展及应用也受到了限制〔4,5〕。单链可变区抗体为近年来出现的基因工程小分子抗体,具有穿透性强、代谢快,对人体免疫原性弱等特点〔6〕。因此,研制IN特异性的ScFv,观察其对IN生物学活性的影响,对发现新的IN抑制剂,探索AIDS治疗的新途径具有重要的意义。
以重组IN蛋白免疫的Balb/c小鼠mRNA为来源,我们利用噬菌体表面呈现技术,获得了具有IN结合活性的ScFv重组噬菌体。经感染HB2151大肠杆菌,在周质腔及培养上清中,得到了可溶性表达的ScFv。将其以亲和层析纯化后证明,有较好的IN结合特异性。免疫印迹的结果初步表明,ScFv不仅可与IN蛋白的单体起反应,而且也可很好地与IN蛋白的二聚体结合。根据文献报
道〔7〕,IN蛋白至少以二聚体的形式发挥其生物学功能。因此,和其二聚体结合是抑制IN活性的基础,同时和IN单体结合也可能通过影响二聚体或多聚体的形成而发挥对IN的抑制作用。目前,我们正在设法提高ScFv的表达量及纯化效率,鉴定ScFv的IN作用表位,观察其体外对IN生物学活性的影响,从而探索其在AIDS治疗中的作用。
, 百拇医药
作者简介:张健慧,女,34岁,助理研究员,博士
北京市太平路27号,Tel.(010)66932307
参考文献
[1]Katz RA, Skalka AM. The retroviral enzymes. Annu Rev Biochem,1994; 63: 133~ 173
[2]张健慧,孟莉,韩保光,等.利用噬菌体表面呈现技术制备HIV-1整合酶单链抗体的初步研究.军事医学科学院院刊,1998;22:248~252
[3]金冬雁,黎孟枫译.《分子克隆实验指南》.北京:中国科学出版社,1992:880~887
[4]Thomas M, Brady L. HIV integrase: a target for AIDS therapeutics. Tibtech, 1997; 15: 167~ 171
, http://www.100md.com
[5]Eich E, Pertz H, Kaloga M, et al.(-)-Arctigenin as a lead structure for inhibitors of human immunodeficiency virus type-1 integrase. J Med Chem, 1996; 39:86~ 95
[6]Winter G, Griffiths AD, Hawkins RE, et al. Making antibodies by phage display technology. Annu Rev Immunol,1994;12: 433~ 455
[7]Ellison V, Gerton J, Vincent KA, et al. An essential interaction between distinct domains of HIV-1 integrase mediates assembly of the active multimer. J Biol Chem, 1995; 270:3320~ 3326
(收稿 1998-05-25 修回 1998-06-26), http://www.100md.com
单位:张健慧 宋晓国 孟莉 冯玉英 韩保光 凌世淦 马贤凯(军事医学科学院基础医学研究所,北京100850)
关键词:人类免疫缺陷病毒;整合酶;单链抗体
细胞与分子免疫学杂志990104
摘要 将具有HIV-1整合酶结合活性的单链抗体重组噬菌体感染HB2151大肠杆菌,经IPTG诱导,在周质腔萃取物及培养基上清中,均检测到有较特异与整合酶结合的可溶性单链抗体的表达。利用HiTrapAntiEtag柱对单链抗体进行了亲和层析纯化。Western-blot结果初步表明,单链抗体不仅可与整合酶的单体反应,而且也可与其二聚体结合。提示:研制的单链抗体可用于对HIV-1整合酶活性影响的研究。
中国图书资料分类号 Q78
, http://www.100md.com
Expression, purification and identification of single chain fragments variable(ScFv) antibody against HIV-1 integrase(IN)
Zhang Jianhui, Song Xiaoguo, Meng Li, Feng Yuying, Han Baoguang, Ling Shigan, Ma Xiankai (Institute of Basic Medical Sciences, Academy of Military Medical Sciences, Beijing 100850)
Keywords HIV integrase ScFv
Abstract E. coli HB2151 was infected with recombinant HIV-1 integrase binding ScFv phages. After induced by IPTG, expression of soluble ScFv characterized by specific binding to IN protein was detected in the bacteria periplasm and supernatant of culture medium. Using HiTrap Anti-E tag column, the ScFv was purified by affinity chromatography. The preliminary results of Western-blot showed that the ScFv could bind to both oligomer and dimer of IN protein. It was indicated that the ScFv could be used for study its possible role in inhibiting IN activities.
, 百拇医药
目前,AIDS的治疗尚无特效疗法。因病毒基因突变致机体迅速产生的抗药性,要求不断研制作用于HIV多个靶位的新制剂。HIV整合酶(integrase,IN)为HIVpol基因3'端编码的Mr为32000的蛋白质,它介导的病毒cDNA与宿主细胞染色体DNA的整合过程为HIV复制的基本步骤,因此,IN为治疗AIDS的理想靶位之一〔1〕。为探索AIDS治疗的新途径,我们研制了HIV-1IN的噬菌体单链可变区抗体(single chain fragments variable,ScFv)。本研究将此ScFv在大肠杆菌中进行了可溶性表达与亲和层析纯化,并证明有较特异结合IN的活性。
1 材料和方法
1.1 材料 所用试剂均为AR或分子生物学纯。重组HIV-1IN,由本实验室制备。噬菌体单链可变区抗体:以重组IN免疫的Balb/c小鼠脾脏mRNA为来源,利用噬菌体表面呈现技术,获得了ScFv重组噬菌体库。经抗原亲和富集,筛选出具有IN结合活性的单链噬菌体抗体,ScFvDNA序列分析表明,符合鼠的抗体序列,详见参考文献〔2〕。
, 百拇医药
1.2 方法
1.2.1 ScFv的可溶性表达 将与IN有结合活性的重组噬菌体感染培养至对数生长期的HB2151宿主菌(Pharmacia),30℃振摇1h。以感染菌涂布SOBAGN平板,30℃温育过夜。挑取单个菌落以2×YT培养基于30℃培养过夜。将过夜培养物以1∶10接种于2×YTAG培养基中,37℃培养至A600值为0.8,更换为2×YTAI培养基,于30℃温育20h~24h。
1.2.2大肠杆菌周质腔分泌物的萃取将过夜培养物以1500×g离心20min,菌体重悬于2%培养基体积的TES(0.2mol/LTrisHC1,0.5mmol/LEDTA,0.5mol/Lsucrose)中,再加入3.3%体积的1/5×TES混匀,置冰上40min,同上离心,以0.45μm滤膜过滤后,4℃保存。
1.2.3 培养基上清的硫酸铵沉淀 于培养基上清中,加入50%饱和度的硫酸铵,室温搅拌1h,2500×g离心40min,沉淀重悬于PBS中,并以PBS反复透析24h。
, 百拇医药
1.2.4 ScFv的纯化 由于ScFv的C端带有13个氨基酸残基的Etag肽,故利用HRP标记的鼠抗Tag IgG,用ELISA方法可检测与IN结合的ScFv的表达情况,并可用HiTrapAnti-ETag亲和层析柱对ScFv纯化。
将1L培养菌的周质腔萃取物及经硫酸铵沉淀的培养基上清混合并超滤至10ml,上样于已经结合缓冲液(0.2mol/LPB,pH7.0)平衡的HiTrapAnti-Etag亲和层析柱(Pharmacia)上,样品流速为5ml/min。先以结合缓冲液洗去杂蛋白后,再以洗脱缓冲液(1.0mol/L甘氨酸,pH3.0)洗脱结合在柱上的ScFv。将含有ScFv的组分立即以中和缓冲液(1.0mol/LTris,0.05%NaN3,pH8.2)调整至pH7.2,经紫外分光光度计定量后,4℃保存备用。
1.2.5 ELISA 纯化的IN蛋白以0.05mol/LpH9.6碳酸盐缓冲液稀释至2μg/ml后包被酶联板,37℃2h,用1%BSA4℃封闭过夜。加入以2%BSA稀释的大肠杆菌周质腔萃取物或培养上清,室温作用2h。洗涤后,加入稀释的HRP标记的鼠抗ETagIgG,室温继续孵育1h~2h,洗涤后,OPD显色10min,测A490nm值。
, 百拇医药
1.2.6 SDS-PAGE 参照文献〔3〕进行。
1.2.7 Westernblot分析 ①ScFv表达产物的分析:将可溶性表达、纯化的ScFv以SDS-PAGE分离后,转移到硝酸纤维素膜上,加5%脱脂奶粉封闭过夜后,继加鼠抗ETagIgG,室温孵育2h,洗涤后用DAB底物显色。②ScFv与IN结合活性的分析:纯化的IN蛋白以SDS-PAGE分离后转膜,同上封闭后,加入1∶100稀释的纯化ScFv,室温作用2h,洗涤后加入HRP标记的鼠抗ETagIgG,同上孵育及显色。
2 结果
2.1 ScFv的可溶性表达 克隆在pCANTAB5E噬菌粒(图1)上的ScFv基因,其5'端与基因3蛋白的分泌信号融合;3'端通过ETagDNA片段与基因3结构基因融合。ETag与基因3间有一琥珀终止密码子。在该终止密码子非抑制表型HB2151大肠杆菌中,ScFv以游离形式表达,并在基因3信号肽介导下分泌到周质腔中进行折叠,形成功能性的ScFv。

, 百拇医药
图1pCANTAB5EScFv表达质粒的结构(示意图)
Fig 1 Construction of pCANTAB 5E-ScFv expression vector
我们将76个与IN有结合活性克隆的重组噬菌体进行了ScFv的可溶性表达。ELISA结果显示,59个克隆的培养基上清及周质腔萃取物经1∶100稀释后,均可检出有IN结合活性的ScFv;而HB2151空菌的培养上清与周质腔萃取物均不与IN起反应。
根据测序结果,ScFv基因的全长为768bp(包括ScFv基因C端的ETagDNA片段),编码256个氨基酸,经推算其表达产物的Mr为28000。由SDS-PAGE的结果(图2)可见,ScFv的周质腔萃取物及培养上清经亲和层析纯化后,得到较纯的Mr为28000的条带,其下方还有两条Mr较小的带,推测可能为培养及纯化过程中ScFv的降解产物。经Western-blot分析证实,Mr为28000的蛋白即为带有E-Tag的ScFv;而其降解产物与Anti-ETag的结合活性较弱,仅见痕量的显色带。以Western-blot证实于上样前的样品中,也可测到明显的Mr为28000的ScFv带。

, 百拇医药
图 2 ScFv的表达及其纯化产物的Western-blot分析
Fig 2 Western-blot analysis of the expressed and purified ScFv
1:Protein relative molecular mass(Mr); 2:ScFv before purification (mixture of periplasmic extract and culture medium concentrated by (NH)2SO4 precipitation); 3:ScFv purified by HiTrap Anti-E Tag affinity column; 4:Anti-E Tag binding characteristic of ScFv 23 loaded on lane 2; 5:Anti-E Tag binding characteristic of ScFv 23 loaded on lane 3
, 百拇医药
2.2 ScFv与IN蛋白的结合活性与特异性鉴定 如图3所示,纯化后的IN蛋白在SDSPAGE分析时,除Mr为32000的带外,在Mr约64000处还有1条很浅的蛋白带,推测可能为IN蛋白的二聚体。以等量的标本上样,经Western-blot分析鉴定证明,纯化的ScFv不仅能与Mr为32000的IN蛋白结合,而且也可与微量存在的IN蛋白的二聚体起反应。

图 3 ScFv与IN结合特性的Western-blot分析
Fig 3 Western-blot analysis of IN binding characteristic of ScFv
1:Protein relative molecular mass (Mr); 2:SDS PAGE analysis of purified IN; 3: Western blot analysis of IN binding characteristic of purified ScFv
, http://www.100md.com
为鉴定ScFv与IN结合的特异性,我们分别以IN蛋白及等量的重组HIV穿膜蛋白(GP41)、重组HBV前S抗原(C/2)及人前列腺特异性抗原单克隆抗体(PSA)3种无关蛋白包被酶联板,将1株纯化的ScFv以BSA倍比稀释后,同时进行ELISA检测(图4)。结果显示,即使在较高稀释浓度(1∶212)时,ScFv仍有结合IN蛋白的活性;仅在较高浓度(1∶23稀释度以下)时,才显示ScFv与GP41和C/2有轻微的交叉反应,而各浓度的ScFv与PSA蛋白均无反应。

图4 ScFv与几种蛋白的ELISA的反应性
Fig 4 Binding of the ScFv to various proteins showed by ELISA
3 讨论
, http://www.100md.com
IN蛋白的难溶性是其晶体结构及活性位点的天然构象尚未完全明确,因而IN抑制物的发展及应用也受到了限制〔4,5〕。单链可变区抗体为近年来出现的基因工程小分子抗体,具有穿透性强、代谢快,对人体免疫原性弱等特点〔6〕。因此,研制IN特异性的ScFv,观察其对IN生物学活性的影响,对发现新的IN抑制剂,探索AIDS治疗的新途径具有重要的意义。
以重组IN蛋白免疫的Balb/c小鼠mRNA为来源,我们利用噬菌体表面呈现技术,获得了具有IN结合活性的ScFv重组噬菌体。经感染HB2151大肠杆菌,在周质腔及培养上清中,得到了可溶性表达的ScFv。将其以亲和层析纯化后证明,有较好的IN结合特异性。免疫印迹的结果初步表明,ScFv不仅可与IN蛋白的单体起反应,而且也可很好地与IN蛋白的二聚体结合。根据文献报
道〔7〕,IN蛋白至少以二聚体的形式发挥其生物学功能。因此,和其二聚体结合是抑制IN活性的基础,同时和IN单体结合也可能通过影响二聚体或多聚体的形成而发挥对IN的抑制作用。目前,我们正在设法提高ScFv的表达量及纯化效率,鉴定ScFv的IN作用表位,观察其体外对IN生物学活性的影响,从而探索其在AIDS治疗中的作用。
, 百拇医药
作者简介:张健慧,女,34岁,助理研究员,博士
北京市太平路27号,Tel.(010)66932307
参考文献
[1]Katz RA, Skalka AM. The retroviral enzymes. Annu Rev Biochem,1994; 63: 133~ 173
[2]张健慧,孟莉,韩保光,等.利用噬菌体表面呈现技术制备HIV-1整合酶单链抗体的初步研究.军事医学科学院院刊,1998;22:248~252
[3]金冬雁,黎孟枫译.《分子克隆实验指南》.北京:中国科学出版社,1992:880~887
[4]Thomas M, Brady L. HIV integrase: a target for AIDS therapeutics. Tibtech, 1997; 15: 167~ 171
, http://www.100md.com
[5]Eich E, Pertz H, Kaloga M, et al.(-)-Arctigenin as a lead structure for inhibitors of human immunodeficiency virus type-1 integrase. J Med Chem, 1996; 39:86~ 95
[6]Winter G, Griffiths AD, Hawkins RE, et al. Making antibodies by phage display technology. Annu Rev Immunol,1994;12: 433~ 455
[7]Ellison V, Gerton J, Vincent KA, et al. An essential interaction between distinct domains of HIV-1 integrase mediates assembly of the active multimer. J Biol Chem, 1995; 270:3320~ 3326
(收稿 1998-05-25 修回 1998-06-26), http://www.100md.com