奇异变形杆菌潜生体与繁殖体的耐药性差异及其机制探讨
作者:黄春基 徐启旺 解晓珍 丛延广
单位:黄春基 徐启旺 丛延广 第三军医大学生物波研究中心 重庆,400038;解晓珍 附属新桥医院检验科 重庆,400037
关键词:奇异变形杆菌;潜生体;繁殖体;耐药性
提要 目的
提要 目的:观察奇异变形杆菌潜生体与繁殖体的耐药性差异并探讨其发生机制。方法:采用一株自己构建的标准产酶菌株和一株临床分离菌株,经波动培养法诱导产生潜生体及繁殖体,检测二者的耐药性差异,并通过β-内酰胺酶活性分析、外膜通透率测定及外膜蛋白SDS-PAGE检测来探讨其发生机制。结果:潜生体的耐药程度普遍高于繁殖体,二者的β-内酰胺酶活性差异不显著(P>0.05),潜生体外膜通透率降低且有多种外膜蛋白减少或缺失。结论:外膜蛋白的大面积减少或缺失对潜生体耐药程度的提高可能起着重要作用。
, http://www.100md.com
中图法分类号 R378.2
Difference of drug resistance between cryptic growth cells and vegetative cells of P. mirabilis and its mechanism
Huang Chunji, Xu Qiwang, Xie Xiaozhen, Cong Yanguang
(Research Center of Biowaves, Third Military Medical University, Chongqing, 400038)
Abstract Objective: To investigate the difference of drug resistance between cryptic growth cells (CGCs) and vegetative cells (VCs) of P. mirabilis and explore its mechanism. Methods: A standard strain of P. mirabilis producing β-lactamase and a clinical isolate of P. mirabilis were used to induce CGCs and VCs under wave-culture condition, the minimum inhibitory concentration (MIC) of CGCs and VCs was measured to observe their difference of drug resistance. The mechanism of the difference was explored through analysis β-lactamase activity, test of outer membrane (OM) permeability and SDS-PAGE of OM protein. Results: The level of drug resistance was higher in CGCs than in VCs but no significant difference in β-lactamase activity was found between the two (P>0.05). OM permeability and the contents of many kinds of OM protein were significantly decreased. Conclusion: The decrease of a wide range of OM protein may play an important role in the increase of drug resistance of CGCs.
, 百拇医药
Key words Proteus mirabilis; cryptic growth cell; vegetative cell; drug resistance
奇异变形杆菌在固体培养基上生长或感染组织时,形态上会出现纤细状长条菌与短杆菌之间的交替变化[1],国外一般将其命名为Swarmmer细胞及Swimmer细胞,国内也有研究者依据Swarmmer细胞及Swimmer细胞的生物学特性,将它们分别命名为潜生体(Cryptic growth cells, CGC)及繁殖体(Vegetative cells, VC)[2]。本研究采用了两株不同的奇异变形杆菌标准菌株,在特定培养条件下诱导产生潜生体和繁殖体,对二者的耐药性进行了比较,旨在初步探讨这种耐药性差异的存在与否及其发生机制。
1 材料与方法
1.1 主要药品与试剂
, http://www.100md.com
青霉素G(PenicillinG, PCG),氨苄西林(Ampicillin,AMP),头孢噻吩(Cephalothin, CPT),头孢孟多(Cefamandole,CMD),四环素(Tetracycline,TC),均由上海第三制药厂生产。氯霉素(Chloramphenical,CP),南京第一制药厂产品。诺氟沙星(Norfloxacin,NFLX),太原制药厂产品。
丙烯酰胺,Serva产品。N,N′-亚甲双丙烯酰胺,Fluka产品,N,N,N′,N′-四甲基乙二胺(TEMED)和过硫酸胺均为E Merck产品。十二烷基硫酸钠(SDS),Sigma产品。中分子量标准蛋白质,中科院上海生化所产品。其余试剂均为国产AR级。
1.2 仪器与设备
DU-7紫外分光光度计,JA-21高速低温离心机,Beckman公司产品。Gene PulsarTM电穿孔仪,Bio-Rad公司产品。UR-200P超声破碎仪,日本Tomy Seiko公司产品。
, 百拇医药
1.3 菌株及培养基
1.3.1 标准产酶菌株P.mirabilis VIr的构建 奇异变形杆菌P.mirabilis VI由本室保存,耐药质粒PMD101由德国达木土塔微生物研究所Martin教授惠赠。PMD101经高压电穿孔法导入P.mirabilis VI构建成标准产酶菌株P.mirabilis VIr,产β-内酰胺酶AmpC。构建的新菌经抗性筛选、尿素酶试验、吲哚试验等生化试验及药敏试验和棒酸抑制试验鉴定后用于本实验。
1.3.2 奇异变形杆菌临床分离菌株106 s 由第三军医大学第二附属医院检验科分离鉴定,编号为106,对本实验中采用的各种抗生素均敏感。
1.3.3 波动Ⅰ号平板 胰蛋白胨1%,酵母抽提物0.5%,氯化钠1%,氯化三苯基四氮唑(TTC)0.01%,葡萄糖0.1%,TTC及葡萄糖于倒平板前加。
, 百拇医药
1.4 细菌潜生体及繁殖体的制备[3]
将形态均一的短杆状奇异变形杆菌点种于波动Ⅰ号平板中心,置每2h在34℃~39℃波动一个周期的孵箱中培养18~24 h,待平板上出现红、黄交替的细菌环后,取红环细菌即得繁殖体,取黄环细菌即得潜生体。
1.5 最低抑菌浓度(MIC)的测定
采用试管二倍稀释法,细菌终浓度取105CFU/ml,18~24 h后观察结果,MIC测定均重复3次。
1.6 β-内酰胺酶制备及活性测定
从波动平板上分别收集细菌潜生体和繁殖体,于冰水浴中超声破碎,裂解液于4℃,20000 g条件下超速离心1h,上清液即为粗酶液。以APC为底物,37℃条件下记录单位时间内APC在204 nm处的吸光度变化,计算酶活性。酶活性单位为每毫克蛋白酶在37℃,pH7.0条件下,每分钟水解APC的纳摩尔数。酶活性测定均重复3次。
, http://www.100md.com
1.7 外膜通透性的测定
根据文献[4]报道方法略加改进。将潜生体及繁殖体细胞用pH7.0 PBS缓冲液洗涤2次后,将菌体重新悬浮于PBS中,制成D600=0.55的细菌悬液。加入一定浓度APC溶液,此时取出0 min样品,离心取上清液,用紫外分光光度计于204 nm处测定上清液中抗生素含量。余下的菌悬液置37℃恒温摇床上放置30 min后,再测定上清液中抗生素含量。前后两次测定结果比较,以细菌细胞对抗生素的吸收率代表细菌的外膜通透率。
1.8 外膜蛋白提取及电泳
相同浊度的潜生体及繁殖体菌悬液于冰水浴条件下超声破碎,5000 r/min离心15 min以除去未破碎细胞。上清液于4℃,40000 r/min离心40 min得细胞膜沉淀,加入终浓度为1%的十二烷基肌氨酸钠,室温放置30 min,溶解内膜,经16400 r/min,室温离心40 min得外膜沉淀,沉淀外膜蛋白用pH7.0 PBS悬浮,加0.5 mmol/L苯*****置-70℃保存[5]。
, http://www.100md.com
SDS-PAGE按文献[6]方法进行。
2 结果
2.1 奇异变形杆菌的潜生体与繁殖体
将奇异变形杆菌点种于波动Ⅰ号平板中心,24 h后平板上出现红、黄交替的细菌环,红环上的短小杆菌即繁殖体,黄环上的纤细状长条菌即潜生体。
2.2 潜生体与繁殖体MIC比较,见表1
表1 奇异变形杆菌潜生体与繁殖体的MIC
Tab 1 The MIC of cryptic-growth cells and vegetative cells of P.mirabilis
Strains and
, http://www.100md.com
type of cells
MIC(ρB/μg.ml-1)
PCG
APC
CPT
CMD
TC
CP
NFLX
P.mirabilis VIr
CGC
3 200
, http://www.100md.com
3 200
3 200
1 600
6.3
3.2
0.4
VC
3 200
1 600
800
800
3.2
0.8
, http://www.100md.com
0.05
P.mirabilis 106 s
CGC
200
200
12.5
12.5
6.3
6.3
0.2
VC
50
25
, 百拇医药
3.2
3.2
3.2
0.8
0.05
由表1可看出,潜生体MIC普遍高于繁殖体,差异程度为2~8倍不等。
2.3 潜生体与繁殖体的β-内酰胺酶活性比较
β-内酰胺酶活性测定结果显示,P.mirabilis潜生体与繁殖体酶活性分别为1220±55.1和1200±32.5,P.mirabilis 106 s潜生体与繁殖体酶活性为22±7.94和27.7±6.66,经Newman-Keuls法检验,两个菌株的潜生体及繁殖体之间β-内酰胺酶活性均差异不显著(P>0.05)。
, 百拇医药
2.4 潜生体与繁殖体的外膜通透性
外膜通透性检测结果显示,P.mirabilis VIr及P.mirabilis 106 s繁殖体外膜通透率为56.2%和62.4%,而二者潜生体的外膜通透率则仅为31.6%和27.4%,潜生体的外膜通透性较之繁殖体有较大幅度的减低。
2.5 SDS-PAGE检测外膜蛋白
对P.mirabilis VIr及P.mirabilis 106 s的潜生体、繁殖体外膜蛋白进行了SDS-PAGE检测,电泳之前,将外膜蛋白样品置于1×SDS凝胶加样缓冲液中,100℃加热3min使蛋白质变性,凝胶电泳结果见图1。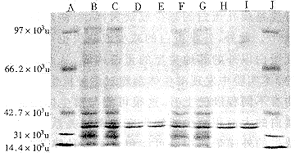
, http://www.100md.com
图1 奇异变形杆菌繁殖体与潜生体的外膜蛋白电泳
Fig 1 SDS-PAGE of outer membrane protein of Proteus mirabilis vegetative cells and cryptic growth cells
Lanes:A,J: middle molecular weight standards
B,C: vegetative cells of P.mirabilis VIr
D,E: cryptic growth cells of P.mirabilis VIr
F,G: vegetative cells of P.mirabilis 106 s
, 百拇医药
H,I: cryptic growth cells of P.mirabilis 106 s
从图1中可看出,P.mirabilis VIr及P.mirabilis 106 s菌株中,潜生体除位于(34~38)×103u的蛋白带与每殖体含量大致相同外(38×103u蛋白带还略有增加),其余各蛋白带仅隐约可见,含量明显低于繁殖体,表现为外膜蛋白的大面积减少。
3 讨论
已有研究表明[7],奇异变形杆菌所导致的感染特别是上尿路感染与潜生体细胞的出现有密切关系,同时,有潜生体细胞存在的感染往往更为严重,在治疗上也更为困难。这一方面是由于潜生体细胞的鞭毛数量、尿素酶、苯丙氨酸脱氨酶及溶血素的产生量都大大多于繁殖体,毒力较强[8];另一方面,也可能存在潜生体与繁殖体耐药性差异上的原因。本实验结果显示潜生体细胞对本实验中所采用的各种抗生素的MIC值普遍高于繁殖体,表明这种耐药性差异是存在的。
, 百拇医药
关于革兰氏阴性菌的耐药机制,普遍认为主要涉及灭活酶的产生及外膜通透性两个方面[9]。本研究选取了β-内酰胺酶作为灭活酶的代表,对产AmpC β-内酰胺酶的标准耐药菌株P.mirabilis VIr及敏感菌株P.mirabilis 106 s中潜生体、繁殖体的β-内酰胺酶活性进行了比较,结果差异并不显著(P>0.05),提示β-内酰胺酶等灭活酶的产生可能在潜生体与繁殖体间耐药差异的发生中不起主要作用。在对潜生体与繁殖体外膜通透率的比较中,发现潜生体外膜通透率明显低于繁殖体,进一步进行外膜蛋白的提取与电泳发现,两个实验菌株的潜生体细胞较之繁殖体细胞有大面积的外膜蛋白表达减少或缺失。已有研究表明,革兰氏阴性菌外膜蛋白中的膜孔蛋白(Porins)是许多物质包括抗生素进入胞内的重要通道,外膜蛋白的减少或缺失可能是膜孔蛋白的减少或缺失,从而使外膜通透率降低[10]。此外,外膜蛋白的减少或缺失也可能影响除膜孔蛋白以外的其他类型的蛋白构成,从而影响膜通透性。本实验中发现潜生体细胞对多种抗生素的MIC值均有不同程度的上升,这很可能与潜生体细胞中外膜蛋白的大面积减少或缺失有着密切关系,因为减少或缺失的外膜蛋白中既可能包含了多种膜孔蛋白,也可能影响了其他类型的蛋白构成,表现出一种非特异性的耐药程度提高。
, 百拇医药
奇异变形杆菌潜生体耐药程度普遍高于繁殖体且二者之间可相互转化的特性,很可能是奇异变形杆菌机会致病及导致慢性尿路感染的机制之一。当奇异变形杆菌处于营养缺乏的环境或应用了抗生素的条件下时,它很可能主要以潜生体细胞的形式存在,以一种代偿性代谢转变(如外膜蛋白的减少或缺失,合成鞭毛能力大大增强等)、抵抗力增强的方式存在,从而生存下来并导致疾病的发生。
国家自然科学基金资助项目,No.39370008
作者简介:黄春基,男,26岁,助教,硕士
参考文献
1 Belas R. The swarming phenomenon of Proteus mirabilis. A S M News,1992,58(1):15
2 刘俊康,王 源,黄春基,等.细菌波动潜生体增殖方式的观察研究.中华流行病学杂志,1996,17(3-C):134
, http://www.100md.com
3 刘俊康,郭 刚,徐启旺,等.生物波理论的研究.中国微生态学杂志,1994,6(6):40
4 程晓梅,宋建新,王以光,等.检测铜绿色假单胞菌临床分离菌株外膜通透性的方法.中国抗生素杂志,1997,22(2):99
5 Masuda N, Sakagawa E, Ohya S. Outer membrane proteins responsible for multiple drug resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother,1995,39(3):645
6 Sambrook T, Fritsh E F, Maniatis T. 分子克隆实验指南.第2版.北京:科学出版社,1992.880~886
7 Senior B W. Proteus morgani is less frequently associated with urinary tract infections than Proteus mirabilis-an explanation. J Med Microbiol,1983,16(4):317
, 百拇医药
8 Belas R, Erskine D, Flaherty D. Proteus mirabilis mutants defective in swarmer cell differentition and multicellular behavior. J Bacteriol,1991,173(19):6279
9 Coleman K, Athalye M, Clancey A, et al. Bacterial resistance mechanisms as therapeutic target. J Antimicrob Chemother,1994,33(9):1091
10 Nikaido H. Outer membrane barrier as a mechanism of antimicrobial resistance. Antimicrob Agents Chemother,1989,33(11):1831
(收稿:1998-06-29;修回:1998-10-16), 百拇医药
单位:黄春基 徐启旺 丛延广 第三军医大学生物波研究中心 重庆,400038;解晓珍 附属新桥医院检验科 重庆,400037
关键词:奇异变形杆菌;潜生体;繁殖体;耐药性
提要 目的
提要 目的:观察奇异变形杆菌潜生体与繁殖体的耐药性差异并探讨其发生机制。方法:采用一株自己构建的标准产酶菌株和一株临床分离菌株,经波动培养法诱导产生潜生体及繁殖体,检测二者的耐药性差异,并通过β-内酰胺酶活性分析、外膜通透率测定及外膜蛋白SDS-PAGE检测来探讨其发生机制。结果:潜生体的耐药程度普遍高于繁殖体,二者的β-内酰胺酶活性差异不显著(P>0.05),潜生体外膜通透率降低且有多种外膜蛋白减少或缺失。结论:外膜蛋白的大面积减少或缺失对潜生体耐药程度的提高可能起着重要作用。
, http://www.100md.com
中图法分类号 R378.2
Difference of drug resistance between cryptic growth cells and vegetative cells of P. mirabilis and its mechanism
Huang Chunji, Xu Qiwang, Xie Xiaozhen, Cong Yanguang
(Research Center of Biowaves, Third Military Medical University, Chongqing, 400038)
Abstract Objective: To investigate the difference of drug resistance between cryptic growth cells (CGCs) and vegetative cells (VCs) of P. mirabilis and explore its mechanism. Methods: A standard strain of P. mirabilis producing β-lactamase and a clinical isolate of P. mirabilis were used to induce CGCs and VCs under wave-culture condition, the minimum inhibitory concentration (MIC) of CGCs and VCs was measured to observe their difference of drug resistance. The mechanism of the difference was explored through analysis β-lactamase activity, test of outer membrane (OM) permeability and SDS-PAGE of OM protein. Results: The level of drug resistance was higher in CGCs than in VCs but no significant difference in β-lactamase activity was found between the two (P>0.05). OM permeability and the contents of many kinds of OM protein were significantly decreased. Conclusion: The decrease of a wide range of OM protein may play an important role in the increase of drug resistance of CGCs.
, 百拇医药
Key words Proteus mirabilis; cryptic growth cell; vegetative cell; drug resistance
奇异变形杆菌在固体培养基上生长或感染组织时,形态上会出现纤细状长条菌与短杆菌之间的交替变化[1],国外一般将其命名为Swarmmer细胞及Swimmer细胞,国内也有研究者依据Swarmmer细胞及Swimmer细胞的生物学特性,将它们分别命名为潜生体(Cryptic growth cells, CGC)及繁殖体(Vegetative cells, VC)[2]。本研究采用了两株不同的奇异变形杆菌标准菌株,在特定培养条件下诱导产生潜生体和繁殖体,对二者的耐药性进行了比较,旨在初步探讨这种耐药性差异的存在与否及其发生机制。
1 材料与方法
1.1 主要药品与试剂
, http://www.100md.com
青霉素G(PenicillinG, PCG),氨苄西林(Ampicillin,AMP),头孢噻吩(Cephalothin, CPT),头孢孟多(Cefamandole,CMD),四环素(Tetracycline,TC),均由上海第三制药厂生产。氯霉素(Chloramphenical,CP),南京第一制药厂产品。诺氟沙星(Norfloxacin,NFLX),太原制药厂产品。
丙烯酰胺,Serva产品。N,N′-亚甲双丙烯酰胺,Fluka产品,N,N,N′,N′-四甲基乙二胺(TEMED)和过硫酸胺均为E Merck产品。十二烷基硫酸钠(SDS),Sigma产品。中分子量标准蛋白质,中科院上海生化所产品。其余试剂均为国产AR级。
1.2 仪器与设备
DU-7紫外分光光度计,JA-21高速低温离心机,Beckman公司产品。Gene PulsarTM电穿孔仪,Bio-Rad公司产品。UR-200P超声破碎仪,日本Tomy Seiko公司产品。
, 百拇医药
1.3 菌株及培养基
1.3.1 标准产酶菌株P.mirabilis VIr的构建 奇异变形杆菌P.mirabilis VI由本室保存,耐药质粒PMD101由德国达木土塔微生物研究所Martin教授惠赠。PMD101经高压电穿孔法导入P.mirabilis VI构建成标准产酶菌株P.mirabilis VIr,产β-内酰胺酶AmpC。构建的新菌经抗性筛选、尿素酶试验、吲哚试验等生化试验及药敏试验和棒酸抑制试验鉴定后用于本实验。
1.3.2 奇异变形杆菌临床分离菌株106 s 由第三军医大学第二附属医院检验科分离鉴定,编号为106,对本实验中采用的各种抗生素均敏感。
1.3.3 波动Ⅰ号平板 胰蛋白胨1%,酵母抽提物0.5%,氯化钠1%,氯化三苯基四氮唑(TTC)0.01%,葡萄糖0.1%,TTC及葡萄糖于倒平板前加。
, 百拇医药
1.4 细菌潜生体及繁殖体的制备[3]
将形态均一的短杆状奇异变形杆菌点种于波动Ⅰ号平板中心,置每2h在34℃~39℃波动一个周期的孵箱中培养18~24 h,待平板上出现红、黄交替的细菌环后,取红环细菌即得繁殖体,取黄环细菌即得潜生体。
1.5 最低抑菌浓度(MIC)的测定
采用试管二倍稀释法,细菌终浓度取105CFU/ml,18~24 h后观察结果,MIC测定均重复3次。
1.6 β-内酰胺酶制备及活性测定
从波动平板上分别收集细菌潜生体和繁殖体,于冰水浴中超声破碎,裂解液于4℃,20000 g条件下超速离心1h,上清液即为粗酶液。以APC为底物,37℃条件下记录单位时间内APC在204 nm处的吸光度变化,计算酶活性。酶活性单位为每毫克蛋白酶在37℃,pH7.0条件下,每分钟水解APC的纳摩尔数。酶活性测定均重复3次。
, http://www.100md.com
1.7 外膜通透性的测定
根据文献[4]报道方法略加改进。将潜生体及繁殖体细胞用pH7.0 PBS缓冲液洗涤2次后,将菌体重新悬浮于PBS中,制成D600=0.55的细菌悬液。加入一定浓度APC溶液,此时取出0 min样品,离心取上清液,用紫外分光光度计于204 nm处测定上清液中抗生素含量。余下的菌悬液置37℃恒温摇床上放置30 min后,再测定上清液中抗生素含量。前后两次测定结果比较,以细菌细胞对抗生素的吸收率代表细菌的外膜通透率。
1.8 外膜蛋白提取及电泳
相同浊度的潜生体及繁殖体菌悬液于冰水浴条件下超声破碎,5000 r/min离心15 min以除去未破碎细胞。上清液于4℃,40000 r/min离心40 min得细胞膜沉淀,加入终浓度为1%的十二烷基肌氨酸钠,室温放置30 min,溶解内膜,经16400 r/min,室温离心40 min得外膜沉淀,沉淀外膜蛋白用pH7.0 PBS悬浮,加0.5 mmol/L苯*****置-70℃保存[5]。
, http://www.100md.com
SDS-PAGE按文献[6]方法进行。
2 结果
2.1 奇异变形杆菌的潜生体与繁殖体
将奇异变形杆菌点种于波动Ⅰ号平板中心,24 h后平板上出现红、黄交替的细菌环,红环上的短小杆菌即繁殖体,黄环上的纤细状长条菌即潜生体。
2.2 潜生体与繁殖体MIC比较,见表1
表1 奇异变形杆菌潜生体与繁殖体的MIC
Tab 1 The MIC of cryptic-growth cells and vegetative cells of P.mirabilis
Strains and
, http://www.100md.com
type of cells
MIC(ρB/μg.ml-1)
PCG
APC
CPT
CMD
TC
CP
NFLX
P.mirabilis VIr
CGC
3 200
, http://www.100md.com
3 200
3 200
1 600
6.3
3.2
0.4
VC
3 200
1 600
800
800
3.2
0.8
, http://www.100md.com
0.05
P.mirabilis 106 s
CGC
200
200
12.5
12.5
6.3
6.3
0.2
VC
50
25
, 百拇医药
3.2
3.2
3.2
0.8
0.05
由表1可看出,潜生体MIC普遍高于繁殖体,差异程度为2~8倍不等。
2.3 潜生体与繁殖体的β-内酰胺酶活性比较
β-内酰胺酶活性测定结果显示,P.mirabilis潜生体与繁殖体酶活性分别为1220±55.1和1200±32.5,P.mirabilis 106 s潜生体与繁殖体酶活性为22±7.94和27.7±6.66,经Newman-Keuls法检验,两个菌株的潜生体及繁殖体之间β-内酰胺酶活性均差异不显著(P>0.05)。
, 百拇医药
2.4 潜生体与繁殖体的外膜通透性
外膜通透性检测结果显示,P.mirabilis VIr及P.mirabilis 106 s繁殖体外膜通透率为56.2%和62.4%,而二者潜生体的外膜通透率则仅为31.6%和27.4%,潜生体的外膜通透性较之繁殖体有较大幅度的减低。
2.5 SDS-PAGE检测外膜蛋白
对P.mirabilis VIr及P.mirabilis 106 s的潜生体、繁殖体外膜蛋白进行了SDS-PAGE检测,电泳之前,将外膜蛋白样品置于1×SDS凝胶加样缓冲液中,100℃加热3min使蛋白质变性,凝胶电泳结果见图1。

, http://www.100md.com
图1 奇异变形杆菌繁殖体与潜生体的外膜蛋白电泳
Fig 1 SDS-PAGE of outer membrane protein of Proteus mirabilis vegetative cells and cryptic growth cells
Lanes:A,J: middle molecular weight standards
B,C: vegetative cells of P.mirabilis VIr
D,E: cryptic growth cells of P.mirabilis VIr
F,G: vegetative cells of P.mirabilis 106 s
, 百拇医药
H,I: cryptic growth cells of P.mirabilis 106 s
从图1中可看出,P.mirabilis VIr及P.mirabilis 106 s菌株中,潜生体除位于(34~38)×103u的蛋白带与每殖体含量大致相同外(38×103u蛋白带还略有增加),其余各蛋白带仅隐约可见,含量明显低于繁殖体,表现为外膜蛋白的大面积减少。
3 讨论
已有研究表明[7],奇异变形杆菌所导致的感染特别是上尿路感染与潜生体细胞的出现有密切关系,同时,有潜生体细胞存在的感染往往更为严重,在治疗上也更为困难。这一方面是由于潜生体细胞的鞭毛数量、尿素酶、苯丙氨酸脱氨酶及溶血素的产生量都大大多于繁殖体,毒力较强[8];另一方面,也可能存在潜生体与繁殖体耐药性差异上的原因。本实验结果显示潜生体细胞对本实验中所采用的各种抗生素的MIC值普遍高于繁殖体,表明这种耐药性差异是存在的。
, 百拇医药
关于革兰氏阴性菌的耐药机制,普遍认为主要涉及灭活酶的产生及外膜通透性两个方面[9]。本研究选取了β-内酰胺酶作为灭活酶的代表,对产AmpC β-内酰胺酶的标准耐药菌株P.mirabilis VIr及敏感菌株P.mirabilis 106 s中潜生体、繁殖体的β-内酰胺酶活性进行了比较,结果差异并不显著(P>0.05),提示β-内酰胺酶等灭活酶的产生可能在潜生体与繁殖体间耐药差异的发生中不起主要作用。在对潜生体与繁殖体外膜通透率的比较中,发现潜生体外膜通透率明显低于繁殖体,进一步进行外膜蛋白的提取与电泳发现,两个实验菌株的潜生体细胞较之繁殖体细胞有大面积的外膜蛋白表达减少或缺失。已有研究表明,革兰氏阴性菌外膜蛋白中的膜孔蛋白(Porins)是许多物质包括抗生素进入胞内的重要通道,外膜蛋白的减少或缺失可能是膜孔蛋白的减少或缺失,从而使外膜通透率降低[10]。此外,外膜蛋白的减少或缺失也可能影响除膜孔蛋白以外的其他类型的蛋白构成,从而影响膜通透性。本实验中发现潜生体细胞对多种抗生素的MIC值均有不同程度的上升,这很可能与潜生体细胞中外膜蛋白的大面积减少或缺失有着密切关系,因为减少或缺失的外膜蛋白中既可能包含了多种膜孔蛋白,也可能影响了其他类型的蛋白构成,表现出一种非特异性的耐药程度提高。
, 百拇医药
奇异变形杆菌潜生体耐药程度普遍高于繁殖体且二者之间可相互转化的特性,很可能是奇异变形杆菌机会致病及导致慢性尿路感染的机制之一。当奇异变形杆菌处于营养缺乏的环境或应用了抗生素的条件下时,它很可能主要以潜生体细胞的形式存在,以一种代偿性代谢转变(如外膜蛋白的减少或缺失,合成鞭毛能力大大增强等)、抵抗力增强的方式存在,从而生存下来并导致疾病的发生。
国家自然科学基金资助项目,No.39370008
作者简介:黄春基,男,26岁,助教,硕士
参考文献
1 Belas R. The swarming phenomenon of Proteus mirabilis. A S M News,1992,58(1):15
2 刘俊康,王 源,黄春基,等.细菌波动潜生体增殖方式的观察研究.中华流行病学杂志,1996,17(3-C):134
, http://www.100md.com
3 刘俊康,郭 刚,徐启旺,等.生物波理论的研究.中国微生态学杂志,1994,6(6):40
4 程晓梅,宋建新,王以光,等.检测铜绿色假单胞菌临床分离菌株外膜通透性的方法.中国抗生素杂志,1997,22(2):99
5 Masuda N, Sakagawa E, Ohya S. Outer membrane proteins responsible for multiple drug resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother,1995,39(3):645
6 Sambrook T, Fritsh E F, Maniatis T. 分子克隆实验指南.第2版.北京:科学出版社,1992.880~886
7 Senior B W. Proteus morgani is less frequently associated with urinary tract infections than Proteus mirabilis-an explanation. J Med Microbiol,1983,16(4):317
, 百拇医药
8 Belas R, Erskine D, Flaherty D. Proteus mirabilis mutants defective in swarmer cell differentition and multicellular behavior. J Bacteriol,1991,173(19):6279
9 Coleman K, Athalye M, Clancey A, et al. Bacterial resistance mechanisms as therapeutic target. J Antimicrob Chemother,1994,33(9):1091
10 Nikaido H. Outer membrane barrier as a mechanism of antimicrobial resistance. Antimicrob Agents Chemother,1989,33(11):1831
(收稿:1998-06-29;修回:1998-10-16), 百拇医药