P53融合蛋白的原核表达及其单克隆抗体的制备
作者:刘彩云 寿成超 孙素莲 张蕾 曾荔
单位:刘彩云 寿成超 孙素莲 张蕾(北京医科大学肿瘤临床学院,北京肿瘤防治研究所,北京100034)曾荔(北京医科大学第一医院泌尿外科研究所,北京)
关键词:P53融合蛋白;单克隆抗体;免疫组织化学
解剖学报990116
【摘要】 目的 为研制出能特异与P53结合的单克隆抗体,使对P53的检测得到更为广泛的应用。 方法 用PCR技术扩增编码人P53N-端180个氨基酸的DNA片段并将其克隆在谷胱苷肽转移酶(GST)表达质粒PGEX-2T中。用该重组质粒转化大肠杆菌JM109,并经异丙基β-D硫代半乳糖苷(IPTG)诱导产生P53-GST融合蛋白。用P53-GST免疫BALB/c小鼠。常规细胞融合,间接酶联免疫吸附试验(ELISA)双筛和免疫组织化学(IHC)筛选。 结果 获得一株能稳定分泌抗P53单抗的杂交瘤细胞株,其分泌的单抗(命名为M126),亚类为IgG2b。用单抗M126与常用P53进口单抗PAB1801(ZYMED公司)同时对52例乳腺癌的石蜡切片标本进行IHC分析,阳性检测率分别为48.1%(25/52)和42.3(22/52),与PAB1801相比M126表现出更强的反应特异性,在一定程度上优于PAB1801。 结论 M126可替代进口单抗PAB1801用于P53免疫组织化学研究。
, 百拇医药
EXPRESSION OF P53 FUSION PROTEIN IN PROKARYOTE AND
PREPARATION OF MONOCLONAL ANTIBODY TO P53
Liu CaiyunΔ, Shou Chengchao, Sun Sulian, Zhang Lei, Zeng Li*
(The School of Oncology, Beijing Medical University, Beijing Institute for Cancer Research, Beijing;*Institute of Urology, Beijing Medical University,Beijing)
, 百拇医药
【Abstract】 Objective The aim in this paper was to prepare anti-P53 monoclonal antibody, which can specifically bind to human P53, and made it widely useful in P53 detection by immunohistochemistry(IHC). Methods The P53 DNA fragment encoding N-terminal 180 amino acid was obtained by PCR and was cloned into PG EX-2T plasmid expressing glutathione S-transferase(GST); The P53-GST fusion proteins expressed by JM109 was used for immunizing BALB/c mice. Results We have raised one hybridoma strain secreting McAb to human P53 (named M126); the IHC analysis of 52 praffin-embedded sections from human breast cancer with M126 and PAB 1801 has shown that the positive immunoreactions were shown in 25 cases (48.1%) and 22 cases (42.3%) respectively; the staining of M126 was stronger and preferable to import P53 McAb PAB 1801. Conclusion M126 can be used instead of PAB 1801 for studying immunohistochemical analysis on P53 protein.
, 百拇医药
【Key words】 P53 fusion protein; Monoclonal antibody; Immunohistochemistry
野生型P53基因是一种抑癌基团,编码53kD的核蛋白,在正常细胞中参予细胞周期的负调节而控制细胞的增殖[1]。正常P53蛋白半衰期短不能用IHC法检测出,而突变的P53蛋白因半衰期延长而导致P53蛋白在细胞中的累积,很容易用IHC法检测出[2]。Barnes等[3]对1千多例组织学标本进行了回顾性研究,发现有40%以上的恶性肿瘤组织能见到P53阳性染色,进一步研究发现肿瘤组织中P53高度表达的患者其预后差。因此,用IHC法检测肿瘤组织内P53蛋白表达,早期制定合理治疗方案,将有助于改善患者的预后。制备特异性强、亲和力好的抗体为检测突变的P53蛋白提供了基本保证。我们就P53cDNA的扩增、重组、表达、单抗的制备及在组织化学检测中的结果报告如下。
, 百拇医药
材料和方法
1.P53-PGEx-2T重组质粒的构建
根据人P53cDNA序列,设计两个分别带有BamHI和EcoRI酶切位点能扩增编码N-端180个氨基酸cDNA的引物,P53上游引物:5′ AACGGATCCATGTGCAATACCACCATG3′,下游引物5′ACGAATTCACCAGATAATTCATCTGA3′,PCR扩增条件为:95℃变性5min,94℃变性45s,48℃退火1min30s,72℃延伸1min30s(3个循环),94℃变性45s,56℃退火1min30s, 72℃延伸1min 30s(30个循环),72℃延伸10 min; 4℃冰浴。获得相应的cDNA片段,将该片段分别用BamHI/EcoRI消化,根据阅读框架,将其克隆在经酶切(BamHI/EcoRI)的PGEX-2T表达质粒中(图1)。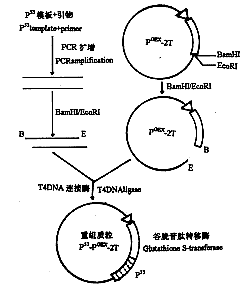
, http://www.100md.com
图1 P53cDNA片段的PCR扩增及克隆
Fig.1 The amplification by PCR and the cloning of P53 cDNA fragment
2.感受态细胞制备及重组质粒的转化
将冻存于-70℃的JM109菌复苏划LB板37℃过夜,次日挑选单一菌落于LB培养液中37℃振荡培养,待菌液OD600为0.2~0.6h,5 000r/min离心10min,沉淀用1/2培养体积的4℃25m mol/LCaCl2悬浮,冰浴30min后离心10min,沉淀用1/10培养体积的预冷CaCl2混悬,冰浴40min,备用。将50ng重组质粒P53-PGEX-2T和0.1ml感受态JM109混合,置于冰上30min,转入42℃水浴2min,加入37℃预温的LB0.9ml,37℃缓慢轻摇45min,接种到含有氨苄青霉素的LB(LB/Amp+)培养皿中,37℃过夜。
, 百拇医药
3.融合蛋白的制备及特性鉴定
挑选几个上述LB/Amp+板中的单个菌落分别置于LB/Amp+培养液中,37℃250r/min振摇培养至OD600约1h,加入IPTG诱导(终浓度为0.5mol/L),不加入IPTG者为阴性对照,继续振摇1~2h。经SDS-PAGE后,将表达融合蛋白的菌落用微量碱变性法提取DNA,进行酶谱分析。提纯重组质粒P53-PGEX-2T,再进行转化、诱导,挑选表达融合蛋白量多者,进行大量扩增诱导、离心,用含1%Triton X-100的溶菌酶裂解细菌、超声破碎,取其少量及离心后的沉淀、上清行SDS-PAGE,确定融合蛋白的溶解性;大量裂解液行SDS-PAGE,用预冷的0.1mol/L KCl染色,切下融合蛋白带,电洗脱过夜,收集蛋白液,PEG浓缩,PBS透析,以BSA为标准,确定P53蛋白量。用间接ELISA法测定此融合蛋白与进口单抗DO1、PAB1801反应性。
, 百拇医药
4.抗P53蛋白单抗的制备
用P53-GST融合蛋白为免疫原,免疫6~8周龄BALB/c小鼠3次,每次50μg/只鼠。末次免疫1月后,腹腔注射融合蛋白50μg/鼠,3d后取脾制成细胞悬液与SP2/0细胞常规融合。分别用融合蛋白P21-GST及P53-GST包被酶标板,间接ELISA法双筛挑选与P53-GST强阳性而与P21-GST不反应的细胞上清再行IHC染色,将IHC染色阳性孔的细胞进行克隆,待细胞分泌抗体的能力稳定之后,制备小鼠腹水;并用间接ELISA法对抗体亚类进行测定。
5.乳腺癌石蜡切片免疫组织化学研究
采用SP法将石蜡切片常规脱蜡入水,甲醇-0.3%H2O2阻断内源性过氧化物酶,PBS洗2次,0.1%人血清白蛋白(HSA)封闭0.5h,每例石蜡切片分别加入自制单抗M126(杂交瘤细胞培养上清)及进口单抗PAB1801(1:50),37℃ 1h,或4℃过夜;PBS洗3次,加入Bio-马抗小鼠IgG(1∶500)(ZYMED公司产品),37℃,0.5h,PBS洗3次;加入HRP-SA(1∶1 000)(ZYMED公司产品),37℃,0.5h,PBS洗3次;加入二氨基联苯胺(DAB)0.5g/L和0.03%H2O染色5min。苏木精复染,盐酸-酒精分色,脱水、透明、封片、镜检。进行抗原修复需在甲醇-H2O2之后,将片子置于pH6.0,0.01mol/L枸橼酸缓冲液中煮沸10min,再用0.1%HSA封闭,以后各步同上。
, 百拇医药
结 果
1.重组质粒的构建及融合蛋白表达
图2结果表明重组质粒转化的JM109克隆经IPTG诱导后其细菌裂解液在50kD处多1条蛋白带,与P53-GST的预计分子量(约48kD)相符,蛋白表达约为15mg/L菌液。从表达该蛋白的细胞中提取的质粒DNA经用内切酶BamHI/EcoRI消化鉴定,含有550bp左右大小的插入片段(图略),表明PCR产物已克隆在PGEX-2T中并得到表达。图2结果也显示转化细菌在IPTG诱导后经溶菌酶裂解、超声破碎,融合蛋白主要存在于经离心后的上清中,沉淀中几乎没有。融合蛋白的纯度在95%以上。所制备的融合蛋白P53-GST能特异与进口P53单抗有较强的反应。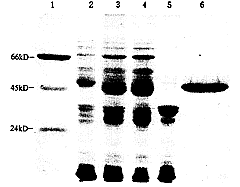
图2 10%SDS-PAGE分析P53-GST在细菌裂解液中的溶解性
, http://www.100md.com
胶用考马斯亮蓝染色;1.分子量标准,2,3.IPTG不诱导
与诱导时细菌裂解液,4,5.IPTG诱导时细菌裂解液上清
及沉淀,6.纯化的P53-GST融合蛋白
Fig.2 SDS-PAGE analysis of P53-GST in bacterial lysates.
Samples were run on a 10% gel, gel was stained with Coomassie blue;
lanel:molecular weight standard; lane2-3; bacterial lysates without or
, http://www.100md.com
with IPTG induction, respectively; lane 4-5; the supematant and the
sediment of induced bacterial lysates; lane 6:purified fusion protein P53-GST
2.分泌抗人P53单抗杂交瘤的制备
经1次细胞融合后融合率为100%(472/472),与P53反应ELISA阳性率为28%(150/472),IHC阳性率5%(1/20)。此细胞株经多次克隆后仍保持稳定分泌抗人P53单抗的特性(ELISA、IHC法均保持阳性),其单抗免疫球蛋白亚类为IgG2b。
3.自制单抗M126和进口单抗PAB1801的IHC比较
, 百拇医药
对52例乳腺癌石蜡切片分别用自制单抗M126和进口单抗PAB1801与P53反应,阳性率分别为42.3%(22/52)和48.1%(25/52)。阳性显色均为细胞核棕黄色颗粒状着色,癌细胞着色显示出异质性。其中有3例用进口单抗PAB1801细胞没有着色,而用自制单抗M126却显示细胞核阳性着色。用进口单抗PAB1801时石蜡切片经抗原修复后着色强度和面积均有不同程度的提高,而用自制单抗M126石蜡切片不经抗原修复也得到很好的结果。自制单抗M126和进口单抗PAB1801对乳腺癌冰冻切片,膀胱癌石蜡切片均显示了癌细胞核的阳性着色,两者的阴阳符合率基本吻合(乳腺癌冰冻切片阳性率分别为M126 45%(9/20),PAB1801 40%(8/20);膀胱癌石蜡切片阳率性分别为M126 37.5%(3/8),PAB1801 37.5%(3/8)。图3中A、B分别为自制单抗M126和进口单抗PAB1801对同一块乳腺癌石蜡切片的IHC染色结果。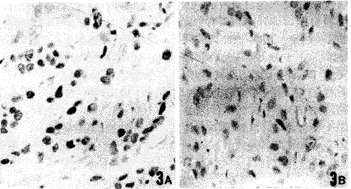
, 百拇医药
图3 人乳腺癌石蜡切片P53免疫组织化学分析 ×500
A和B分别用单抗M126、McAb PAB1801作为一抗
Fig.2 IHC of P53 on paraffin sections from human breast cancer.×500
The stainings were performed by SP and counterstained using hematoxylin,A and B were stained with McAb M126and McAb PAB1801,respectively.
讨 论
经对人类肿瘤组织及细胞株的分子遗传分析结果表明,在许多人类肿瘤中时常有P53突变发生[4]。Bergh等[5]经体内、体外实验及新鲜肿瘤标本分析结果表明,P53突变可导致对化疗和放疗的拮抗性。而Valgardsdottir等[6]证明乳腺癌细胞中P53免疫反应阳性与P53基因突变有统计学意义。P53免疫组织化学染色可以根据P53蛋白的异常积累进行肿瘤鉴定,也可根据肿瘤细胞染色特性(核质此)以及癌灶内阳性肿瘤细胞所占比率对P53阳性癌灶进行再分类[7~9]。因此简单明确的免疫组织化学法是目前国内外用于检测P53突变的常用方法,而国内均采用价格昂贵的进口单抗,使其应用受到一定的限制。我们首次得到1株能稳定分泌抗人P53单抗的杂交瘤细胞株,以此单抗(M126)和进口单抗PAB1801同时对52例乳腺癌石蜡切片进行IHC分析,22例阳性中两种单抗对核的染色强度、阳性细胞百分数前者高于后者,3例石蜡切片中自制单抗显示阳性而进口单抗却显示明显的阴性结果。这种差异性可能是由于PAB1801识别的抗原表位在福尔马林固定的组织中不稳定[10],而固定剂的类型及室温储存的组织切片对免疫染色均有不同程度的影响[11]。实验中还发现,用进口单抗PAB1801时石蜡切片经抗原修复后着色强度和面积均有不同程度的提高,而用自制单抗M126时石蜡切片不经抗原修复也得到很好的结果。说明此两种单抗识别不同的抗原表位,也表明M126单抗比PAB1801在使用中更为方便,用M126对乳腺癌冰冻切片、膀胱癌石蜡切片进行免疫组织化学检测与用PAB1801的检测结果基本一致,但颗粒着色强度及面积均略优于PAB1801,说明M126可以替代进口单抗PAB1801用于P53的IHC检测。
, 百拇医药
△ The School of Oncology, Beijing Medical University, Beijing Institute for Cancer Research, Beijing 100034, China
参考文献
[1]Vogelstein B, Kinzler KW. P53 function and dysfunction. Cell, 1992,70:(4)523
[2]Andersen TI, Holm R, Nesland JM, et al. Prognostic significance of P53 alterations in breast carcinoma. Br J cancer, 1993,68(1):540
[3]Barns,DM,Dublin EA, Fisher CJ, et al. Immunohistochemical detection of P53 protein in mammary carcinoma. An important new independent indicator of prognosis. Hum Pathol, 1993,24(4):469
, 百拇医药
[4]Sreenan MD, Richard A, Prayson MD. Gliosarcoma a study of 13 tumors, including P53 and CD34 immunohistochemistry. Arch Pathol Lab Med, 1997,121(1):129
[5]Bergh J, Norberg T, Sjogren S, et al. Complete sequencing of the P53 gene provides prognostic information in breast cancer patients, particularly in relation to adjuvant systemic therapy and radiotherapy. Nature Med, 1995, 1(6):1029
[6]Valgardsdottir R, Tryggvadottir L, Steinarsdottir M, et al. Genomic instability and poor prognosis associated with abnormal TP53 in breast carcinomas: Molecular and immunohistochemical analysis. APMIS, 1997,105(1):121
, http://www.100md.com
[7]Marks JR, Davidoff AM, Kernsa BJ, et al. Over expression and mutation of P53 in epithelial ovarian cancier. Cancer Res, 1991,51(6):2979
[8]Iggo R,Gatter K, Bartek J, et al. Increased expression of mutant forms of P53 oncogene in primary lung cancer. Lancet, 1990,35(5):675
[9]Midgley CA,Fisher CJ,Bartek J, et al. Analysis of P53 expressed in Escherichia coli. J Cell Sci, 1992,101(1):183
, http://www.100md.com
[10]Vojesek B,Fisher CJ,Barnes DM,et al. Comparison between P53 staining in tissue sections and P53 proteins levels measured by an ELISA technique. Br J Cancer, 1993,67(1):1254
[11]Purdie CA, Oarady J, Piris J, et al. P53 expression in colorectal tumours. Am J Pathol, 1991,138(3):807
收稿1997-12 修回1998-04, 百拇医药
单位:刘彩云 寿成超 孙素莲 张蕾(北京医科大学肿瘤临床学院,北京肿瘤防治研究所,北京100034)曾荔(北京医科大学第一医院泌尿外科研究所,北京)
关键词:P53融合蛋白;单克隆抗体;免疫组织化学
解剖学报990116
【摘要】 目的 为研制出能特异与P53结合的单克隆抗体,使对P53的检测得到更为广泛的应用。 方法 用PCR技术扩增编码人P53N-端180个氨基酸的DNA片段并将其克隆在谷胱苷肽转移酶(GST)表达质粒PGEX-2T中。用该重组质粒转化大肠杆菌JM109,并经异丙基β-D硫代半乳糖苷(IPTG)诱导产生P53-GST融合蛋白。用P53-GST免疫BALB/c小鼠。常规细胞融合,间接酶联免疫吸附试验(ELISA)双筛和免疫组织化学(IHC)筛选。 结果 获得一株能稳定分泌抗P53单抗的杂交瘤细胞株,其分泌的单抗(命名为M126),亚类为IgG2b。用单抗M126与常用P53进口单抗PAB1801(ZYMED公司)同时对52例乳腺癌的石蜡切片标本进行IHC分析,阳性检测率分别为48.1%(25/52)和42.3(22/52),与PAB1801相比M126表现出更强的反应特异性,在一定程度上优于PAB1801。 结论 M126可替代进口单抗PAB1801用于P53免疫组织化学研究。
, 百拇医药
EXPRESSION OF P53 FUSION PROTEIN IN PROKARYOTE AND
PREPARATION OF MONOCLONAL ANTIBODY TO P53
Liu CaiyunΔ, Shou Chengchao, Sun Sulian, Zhang Lei, Zeng Li*
(The School of Oncology, Beijing Medical University, Beijing Institute for Cancer Research, Beijing;*Institute of Urology, Beijing Medical University,Beijing)
, 百拇医药
【Abstract】 Objective The aim in this paper was to prepare anti-P53 monoclonal antibody, which can specifically bind to human P53, and made it widely useful in P53 detection by immunohistochemistry(IHC). Methods The P53 DNA fragment encoding N-terminal 180 amino acid was obtained by PCR and was cloned into PG EX-2T plasmid expressing glutathione S-transferase(GST); The P53-GST fusion proteins expressed by JM109 was used for immunizing BALB/c mice. Results We have raised one hybridoma strain secreting McAb to human P53 (named M126); the IHC analysis of 52 praffin-embedded sections from human breast cancer with M126 and PAB 1801 has shown that the positive immunoreactions were shown in 25 cases (48.1%) and 22 cases (42.3%) respectively; the staining of M126 was stronger and preferable to import P53 McAb PAB 1801. Conclusion M126 can be used instead of PAB 1801 for studying immunohistochemical analysis on P53 protein.
, 百拇医药
【Key words】 P53 fusion protein; Monoclonal antibody; Immunohistochemistry
野生型P53基因是一种抑癌基团,编码53kD的核蛋白,在正常细胞中参予细胞周期的负调节而控制细胞的增殖[1]。正常P53蛋白半衰期短不能用IHC法检测出,而突变的P53蛋白因半衰期延长而导致P53蛋白在细胞中的累积,很容易用IHC法检测出[2]。Barnes等[3]对1千多例组织学标本进行了回顾性研究,发现有40%以上的恶性肿瘤组织能见到P53阳性染色,进一步研究发现肿瘤组织中P53高度表达的患者其预后差。因此,用IHC法检测肿瘤组织内P53蛋白表达,早期制定合理治疗方案,将有助于改善患者的预后。制备特异性强、亲和力好的抗体为检测突变的P53蛋白提供了基本保证。我们就P53cDNA的扩增、重组、表达、单抗的制备及在组织化学检测中的结果报告如下。
, 百拇医药
材料和方法
1.P53-PGEx-2T重组质粒的构建
根据人P53cDNA序列,设计两个分别带有BamHI和EcoRI酶切位点能扩增编码N-端180个氨基酸cDNA的引物,P53上游引物:5′ AACGGATCCATGTGCAATACCACCATG3′,下游引物5′ACGAATTCACCAGATAATTCATCTGA3′,PCR扩增条件为:95℃变性5min,94℃变性45s,48℃退火1min30s,72℃延伸1min30s(3个循环),94℃变性45s,56℃退火1min30s, 72℃延伸1min 30s(30个循环),72℃延伸10 min; 4℃冰浴。获得相应的cDNA片段,将该片段分别用BamHI/EcoRI消化,根据阅读框架,将其克隆在经酶切(BamHI/EcoRI)的PGEX-2T表达质粒中(图1)。

, http://www.100md.com
图1 P53cDNA片段的PCR扩增及克隆
Fig.1 The amplification by PCR and the cloning of P53 cDNA fragment
2.感受态细胞制备及重组质粒的转化
将冻存于-70℃的JM109菌复苏划LB板37℃过夜,次日挑选单一菌落于LB培养液中37℃振荡培养,待菌液OD600为0.2~0.6h,5 000r/min离心10min,沉淀用1/2培养体积的4℃25m mol/LCaCl2悬浮,冰浴30min后离心10min,沉淀用1/10培养体积的预冷CaCl2混悬,冰浴40min,备用。将50ng重组质粒P53-PGEX-2T和0.1ml感受态JM109混合,置于冰上30min,转入42℃水浴2min,加入37℃预温的LB0.9ml,37℃缓慢轻摇45min,接种到含有氨苄青霉素的LB(LB/Amp+)培养皿中,37℃过夜。
, 百拇医药
3.融合蛋白的制备及特性鉴定
挑选几个上述LB/Amp+板中的单个菌落分别置于LB/Amp+培养液中,37℃250r/min振摇培养至OD600约1h,加入IPTG诱导(终浓度为0.5mol/L),不加入IPTG者为阴性对照,继续振摇1~2h。经SDS-PAGE后,将表达融合蛋白的菌落用微量碱变性法提取DNA,进行酶谱分析。提纯重组质粒P53-PGEX-2T,再进行转化、诱导,挑选表达融合蛋白量多者,进行大量扩增诱导、离心,用含1%Triton X-100的溶菌酶裂解细菌、超声破碎,取其少量及离心后的沉淀、上清行SDS-PAGE,确定融合蛋白的溶解性;大量裂解液行SDS-PAGE,用预冷的0.1mol/L KCl染色,切下融合蛋白带,电洗脱过夜,收集蛋白液,PEG浓缩,PBS透析,以BSA为标准,确定P53蛋白量。用间接ELISA法测定此融合蛋白与进口单抗DO1、PAB1801反应性。
, 百拇医药
4.抗P53蛋白单抗的制备
用P53-GST融合蛋白为免疫原,免疫6~8周龄BALB/c小鼠3次,每次50μg/只鼠。末次免疫1月后,腹腔注射融合蛋白50μg/鼠,3d后取脾制成细胞悬液与SP2/0细胞常规融合。分别用融合蛋白P21-GST及P53-GST包被酶标板,间接ELISA法双筛挑选与P53-GST强阳性而与P21-GST不反应的细胞上清再行IHC染色,将IHC染色阳性孔的细胞进行克隆,待细胞分泌抗体的能力稳定之后,制备小鼠腹水;并用间接ELISA法对抗体亚类进行测定。
5.乳腺癌石蜡切片免疫组织化学研究
采用SP法将石蜡切片常规脱蜡入水,甲醇-0.3%H2O2阻断内源性过氧化物酶,PBS洗2次,0.1%人血清白蛋白(HSA)封闭0.5h,每例石蜡切片分别加入自制单抗M126(杂交瘤细胞培养上清)及进口单抗PAB1801(1:50),37℃ 1h,或4℃过夜;PBS洗3次,加入Bio-马抗小鼠IgG(1∶500)(ZYMED公司产品),37℃,0.5h,PBS洗3次;加入HRP-SA(1∶1 000)(ZYMED公司产品),37℃,0.5h,PBS洗3次;加入二氨基联苯胺(DAB)0.5g/L和0.03%H2O染色5min。苏木精复染,盐酸-酒精分色,脱水、透明、封片、镜检。进行抗原修复需在甲醇-H2O2之后,将片子置于pH6.0,0.01mol/L枸橼酸缓冲液中煮沸10min,再用0.1%HSA封闭,以后各步同上。
, 百拇医药
结 果
1.重组质粒的构建及融合蛋白表达
图2结果表明重组质粒转化的JM109克隆经IPTG诱导后其细菌裂解液在50kD处多1条蛋白带,与P53-GST的预计分子量(约48kD)相符,蛋白表达约为15mg/L菌液。从表达该蛋白的细胞中提取的质粒DNA经用内切酶BamHI/EcoRI消化鉴定,含有550bp左右大小的插入片段(图略),表明PCR产物已克隆在PGEX-2T中并得到表达。图2结果也显示转化细菌在IPTG诱导后经溶菌酶裂解、超声破碎,融合蛋白主要存在于经离心后的上清中,沉淀中几乎没有。融合蛋白的纯度在95%以上。所制备的融合蛋白P53-GST能特异与进口P53单抗有较强的反应。

图2 10%SDS-PAGE分析P53-GST在细菌裂解液中的溶解性
, http://www.100md.com
胶用考马斯亮蓝染色;1.分子量标准,2,3.IPTG不诱导
与诱导时细菌裂解液,4,5.IPTG诱导时细菌裂解液上清
及沉淀,6.纯化的P53-GST融合蛋白
Fig.2 SDS-PAGE analysis of P53-GST in bacterial lysates.
Samples were run on a 10% gel, gel was stained with Coomassie blue;
lanel:molecular weight standard; lane2-3; bacterial lysates without or
, http://www.100md.com
with IPTG induction, respectively; lane 4-5; the supematant and the
sediment of induced bacterial lysates; lane 6:purified fusion protein P53-GST
2.分泌抗人P53单抗杂交瘤的制备
经1次细胞融合后融合率为100%(472/472),与P53反应ELISA阳性率为28%(150/472),IHC阳性率5%(1/20)。此细胞株经多次克隆后仍保持稳定分泌抗人P53单抗的特性(ELISA、IHC法均保持阳性),其单抗免疫球蛋白亚类为IgG2b。
3.自制单抗M126和进口单抗PAB1801的IHC比较
, 百拇医药
对52例乳腺癌石蜡切片分别用自制单抗M126和进口单抗PAB1801与P53反应,阳性率分别为42.3%(22/52)和48.1%(25/52)。阳性显色均为细胞核棕黄色颗粒状着色,癌细胞着色显示出异质性。其中有3例用进口单抗PAB1801细胞没有着色,而用自制单抗M126却显示细胞核阳性着色。用进口单抗PAB1801时石蜡切片经抗原修复后着色强度和面积均有不同程度的提高,而用自制单抗M126石蜡切片不经抗原修复也得到很好的结果。自制单抗M126和进口单抗PAB1801对乳腺癌冰冻切片,膀胱癌石蜡切片均显示了癌细胞核的阳性着色,两者的阴阳符合率基本吻合(乳腺癌冰冻切片阳性率分别为M126 45%(9/20),PAB1801 40%(8/20);膀胱癌石蜡切片阳率性分别为M126 37.5%(3/8),PAB1801 37.5%(3/8)。图3中A、B分别为自制单抗M126和进口单抗PAB1801对同一块乳腺癌石蜡切片的IHC染色结果。

, 百拇医药
图3 人乳腺癌石蜡切片P53免疫组织化学分析 ×500
A和B分别用单抗M126、McAb PAB1801作为一抗
Fig.2 IHC of P53 on paraffin sections from human breast cancer.×500
The stainings were performed by SP and counterstained using hematoxylin,A and B were stained with McAb M126and McAb PAB1801,respectively.
讨 论
经对人类肿瘤组织及细胞株的分子遗传分析结果表明,在许多人类肿瘤中时常有P53突变发生[4]。Bergh等[5]经体内、体外实验及新鲜肿瘤标本分析结果表明,P53突变可导致对化疗和放疗的拮抗性。而Valgardsdottir等[6]证明乳腺癌细胞中P53免疫反应阳性与P53基因突变有统计学意义。P53免疫组织化学染色可以根据P53蛋白的异常积累进行肿瘤鉴定,也可根据肿瘤细胞染色特性(核质此)以及癌灶内阳性肿瘤细胞所占比率对P53阳性癌灶进行再分类[7~9]。因此简单明确的免疫组织化学法是目前国内外用于检测P53突变的常用方法,而国内均采用价格昂贵的进口单抗,使其应用受到一定的限制。我们首次得到1株能稳定分泌抗人P53单抗的杂交瘤细胞株,以此单抗(M126)和进口单抗PAB1801同时对52例乳腺癌石蜡切片进行IHC分析,22例阳性中两种单抗对核的染色强度、阳性细胞百分数前者高于后者,3例石蜡切片中自制单抗显示阳性而进口单抗却显示明显的阴性结果。这种差异性可能是由于PAB1801识别的抗原表位在福尔马林固定的组织中不稳定[10],而固定剂的类型及室温储存的组织切片对免疫染色均有不同程度的影响[11]。实验中还发现,用进口单抗PAB1801时石蜡切片经抗原修复后着色强度和面积均有不同程度的提高,而用自制单抗M126时石蜡切片不经抗原修复也得到很好的结果。说明此两种单抗识别不同的抗原表位,也表明M126单抗比PAB1801在使用中更为方便,用M126对乳腺癌冰冻切片、膀胱癌石蜡切片进行免疫组织化学检测与用PAB1801的检测结果基本一致,但颗粒着色强度及面积均略优于PAB1801,说明M126可以替代进口单抗PAB1801用于P53的IHC检测。
, 百拇医药
△ The School of Oncology, Beijing Medical University, Beijing Institute for Cancer Research, Beijing 100034, China
参考文献
[1]Vogelstein B, Kinzler KW. P53 function and dysfunction. Cell, 1992,70:(4)523
[2]Andersen TI, Holm R, Nesland JM, et al. Prognostic significance of P53 alterations in breast carcinoma. Br J cancer, 1993,68(1):540
[3]Barns,DM,Dublin EA, Fisher CJ, et al. Immunohistochemical detection of P53 protein in mammary carcinoma. An important new independent indicator of prognosis. Hum Pathol, 1993,24(4):469
, 百拇医药
[4]Sreenan MD, Richard A, Prayson MD. Gliosarcoma a study of 13 tumors, including P53 and CD34 immunohistochemistry. Arch Pathol Lab Med, 1997,121(1):129
[5]Bergh J, Norberg T, Sjogren S, et al. Complete sequencing of the P53 gene provides prognostic information in breast cancer patients, particularly in relation to adjuvant systemic therapy and radiotherapy. Nature Med, 1995, 1(6):1029
[6]Valgardsdottir R, Tryggvadottir L, Steinarsdottir M, et al. Genomic instability and poor prognosis associated with abnormal TP53 in breast carcinomas: Molecular and immunohistochemical analysis. APMIS, 1997,105(1):121
, http://www.100md.com
[7]Marks JR, Davidoff AM, Kernsa BJ, et al. Over expression and mutation of P53 in epithelial ovarian cancier. Cancer Res, 1991,51(6):2979
[8]Iggo R,Gatter K, Bartek J, et al. Increased expression of mutant forms of P53 oncogene in primary lung cancer. Lancet, 1990,35(5):675
[9]Midgley CA,Fisher CJ,Bartek J, et al. Analysis of P53 expressed in Escherichia coli. J Cell Sci, 1992,101(1):183
, http://www.100md.com
[10]Vojesek B,Fisher CJ,Barnes DM,et al. Comparison between P53 staining in tissue sections and P53 proteins levels measured by an ELISA technique. Br J Cancer, 1993,67(1):1254
[11]Purdie CA, Oarady J, Piris J, et al. P53 expression in colorectal tumours. Am J Pathol, 1991,138(3):807
收稿1997-12 修回1998-04, 百拇医药