HIV-1整合酶蛋白(p31)的表达、纯化及其在血清学诊断中的应用*
作者:韩保光 孟莉 马贤凯 宋晓国 陈坤 张贺秋 凌世淦
单位:韩保光 孟莉 马贤凯 宋晓国 陈坤 张贺秋 凌世淦(军事医学科学院基础医学研究所,北京100850)
关键词:HIV-1;整合酶;p31;表达
细胞与分子免疫学杂志990105
摘要 在大肠杆菌中,利用pET-3c表达载体,高效表达了具有全长序列的HIV-1整合酶蛋白(p31)。表达产物主要以包涵体的形式存在,用1mo1/LNaCl溶解包涵体可部分地溶解p31蛋白,溶解上清中p31蛋白具有很高的纯度。本文进一步描述了一种在变性条件下重组蛋白的纯化方法,即将包涵体用8mol/L尿素溶解,先后经过S-Sepharose Fast Flow与Sephacryl-300柱层析,可将重组产物纯化到电泳纯。纯化蛋白以1μg/ml包被ELISA板,分析正常人及HIV-1阳性个体的血清,结果重组p31与检测的所有41份阳性血清均可发生特异反应,而与36份正常血清则不起反应,表明纯化的重组蛋白可用于检测血清中的抗HIV-1抗体。
, 百拇医药
中国图书资料分类号 Q78
Expression, purification and serological application of human immunodeficiency virus type 1 integrase protein(p31)
Han Baoguang, Meng Li, Ma Xiankai, Song Xiaoguo, Chen Kun, Zhang Heqiu, Ling Shigan (Institute of Basic Medical Sciences, Beijing 100850)
Keywords HIV-1 integrase p31 expression
Abstract The sequence encoding the full length of human immunodeficiency virus type 1 integrase has been cloned and highly expressed directly using pET system in E.coli. The recombinant product mainly existed in inclusion bodies (IB). Quantities of recombinant integrase protein could be released by dissolving the inclusion bodies with l mol/L NaCl, resulting in high degree of purification. Alternatively, IB protein could be solublized by 8 mol/L urea and purified under denaturing conditions. The product has been purified close to homogeneity sequentially by S-Sepharose Fast Flow and Sephacryl-300 columns. The purified product reacted with all 41 HIV-1 positive sera but none of 36 normal sera tested. This suggests that the recombinant integrase protein might be useful for detecting HIV-1 antibodies in blood samples.
, 百拇医药
同所有逆转录病毒一样,HIV病毒性感染需要将病毒DNA整合到宿主细胞的染色体上〔1〕。这一过程由逆转录病毒的整合酶(p31)催化完成〔2〕。逆转录病毒侵入宿主细胞后,首先在逆转录酶催化下,以病毒基因组RNA为模板合成双链DNA。逆转录完成后,病毒DNA以一个稳定的核蛋白复合物形式存在,该复合物包括整合过程需要的所有元件〔3〕。复合物进入细胞核后,病毒DNA与宿主染色体共价结合。形成前病毒。整合过程为病毒有效复制与感染状态的维持所必需。最近报道表明,不具有整合能力的HIV1突变体不能产生子代病毒〔4〕。整合过程完成以后,病毒DNA作为宿主细胞基因组的一部分传给子代细胞。同逆转录病毒的蛋白酶及逆转录酶一样,整合酶在宿主细胞中不存在类似物,是治疗AIDS的良好药物作用靶位之一。
在HIV感染个体的血清中,针对p31蛋白的抗体具有很高的发生率,其检出率仅次于抗HIV-1穿膜蛋白gp41的抗体〔5〕。HIV-1与HIV-2的p31蛋白在氨基酸水平上有60%~70%的同源性。HIV-1p31蛋白能同时与HIV-1及HIV-2的阳性血清起反应〔6,7〕。抗p31抗体的检测是确认分析抗HIV抗体的重要指标。
, 百拇医药
为离体研究p31蛋白的生物学活性及检测抗HIV-1抗体的需求,本文在大肠杆菌内高效表达了p31蛋白,摸索了p31蛋白的纯化方法,并将其纯化到电泳纯。另外,以此为抗原,应用ELISA方法对HIV-1阳性血清进行了检测。
1 材料和方法
1.1 菌株与质粒 大肠杆菌BL21(DE3)〔13〕,在染色体上带有T7噬菌体RNA聚合酶编码基因,用于pET〔13〕来源载体的表达。质粒pBH10R3含有HIV-BH10株全长基因〔8〕,均由美国Rasheed博士赠送。pET-3c和pUC18为本室保存。
1.2 酶和试剂 限制性内切酶、T4DNA连接酶、DNA片段回收柱和琼脂糖,均购自Promega公司。S-Sepharose Fast Flow与Sephacryl-300,购于Pharmacia Biotech公司。HIV-1阳性血清为本室保存。
, 百拇医药
1.3 p31基因的克隆与表达质粒的构建 以质粒pBH10R3为模板,使用1对PCR引物扩赠p31基因。5'端引物的序列为:GGAATTCATATGTTTTTAGATGGAATAGATA;3'端引物的序列为:CCGGTACCTTAATCCTCATCCTG。扩赠条件为:95℃50s,50℃50s,72℃50s;扩增30个循环后,72℃延伸7min。PCR产物经Promega公司WizardPCR纯化试剂盒纯化,用Klenow酶补平,再以KpnI酶切,低熔点琼脂糖回收DNA。pUC18质粒以EcoRI酶切,Klenow片段补平,再以KpnI酶切,回收载体片段,与酶切的PCR产物连接,构建pUC-p31重组质粒。pUC-p31质粒以NdeI与BamHI双酶切,回收约860bp的基因片段,与同样酶切的pET-3c质粒连接,构建表达质粒pET-p31。转化大肠杆菌BL21(DE3)后,获得p31蛋白表达菌。
1.4 重组蛋白的表达与可溶性蛋白的初步纯化 挑取pET-p31/BL21(DE3)单个克隆,接种于100ml含有100mg/L氨苄青霉素的LB培养基中,30℃过夜生长。次日以1∶10接种于1L同样的培养基中,30℃继续生长到A600=0.8~1.0。加入IPTG至终浓度为0.5mmol/L,继续诱导4h后收菌,于20℃冰箱中过夜冻存。
, 百拇医药
菌体重悬于50ml缓冲液A(组成:50mmol/LTris-HC1,pH7.5,1mmol/LEDTA,5mmol/L巯基乙醇),超声破碎细菌,提取包涵体。用缓冲液A洗涤后,再以含0.1mmol/LNaCl的缓冲液A洗涤1次。将包涵体悬于10ml含1mmol/LNaCl的缓冲液A中,用Dounce匀浆器匀浆50次,在冰上搅拌2h,经12000×g离心30min后,做SDS-PAGE观察结果。
1.5 变性条件下纯化重组蛋白 包涵体以20ml缓冲液B(缓冲液A中加入尿素至终浓度为8mol/L)溶解,以12000×g离心20min,取上清。S-Sepharose Fast Flow柱预先以缓冲液B平衡,将上清上柱,流速为0.5ml/min。依次用50mmol/L,100mmol/L,150mmol/L,200mmol/L和500mmol/L的NaCl(以缓冲液B配制)阶梯洗脱。根据SDS-PAGE的结果,收集重组蛋白所在的峰,再用凝胶过滤进一步纯化。Sephacryl-300柱体积为500ml,用含0.15mol/LNaCl的缓冲液B充分平衡后上样,流速为30ml/h。用自动收集器分管收集,每15min收集1管。以SDSPAGE鉴定p31蛋白所在的峰。
, 百拇医药
1.6 纯化p31重组蛋白与HIV-1血清的反应性 纯化抗原以包被液(50mmol/LNa2CO3,pH9.6)稀释到浓度为1mg/L,包被ELISA板,4℃过夜。以含1%BSA的PBST(含0.05% Tween-20的PBS)4℃封闭4h6h。标准血清以样品稀释液(100mmol/LNa3PO3,pH7.5,10%山羊血清,0.05%Tween-20)作1∶10稀释,每孔加入100μl,37℃反应30min。以PBST充分洗涤后,加入辣根过氧化物酶标记的小鼠抗人mAb(1/25000),37℃温育15min,充分洗涤,用OPD作为底物显色10min,测定492nm的光吸收值。
2 结果
2.1 HIV-1整合酶基因的克隆及表达质粒的构建 HIV-1整合酶蛋白由pol基因3'端序列编码,成熟蛋白由GagPol前体蛋白加工而来。HIV-1BH10克隆的整合酶蛋白包括289个氨基酸残基,相对分子质量(Mr)为32000,又称为p31。以含有HIV-1全长编码基因的质粒pBH10R3为模板,采用PCR方法扩增p31全长基因,并在5'端添加起始密码ATG。将PCR产物首先克隆到pUC18载体上,构建pUC-p31质粒。随后以NdeI与BamHI将p31基因从质粒pUC-p31上切下,克隆到表达载体pET-3c上,构建表达质粒pET-p31(图1),构建的正确性用酶切证实。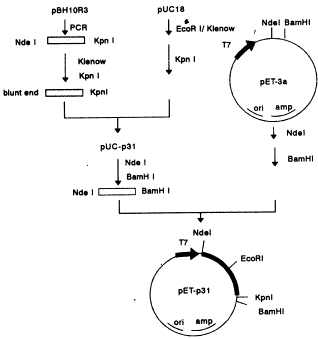
, 百拇医药
图1 HIV-1整合酶表达质粒的构建
Fig 1 Construction of expression plasmid pET-p31
2.2 p31蛋白的表达与可溶性蛋白的初步纯化 将表达质粒pET-p31转化大肠杆菌BL21(DE3),获得表达菌。预计可表达Mr为32000的重组蛋白。以pET-3c/BL21(DE3)作为对照,采用IPTG诱导pET-p31/BL21(DE3)。与对照菌相比较,在Mr为32000的预期位置上,有特异性表达(图2,列3),表达产物主要存在于包涵体中(图2,列5)。有趣的是,使用1mol/LNaCl能使包涵体中的p31蛋白部分地溶解,溶解上清中重组蛋白的纯度可达80%以上(图2,列6),对照菌中无表达蛋白。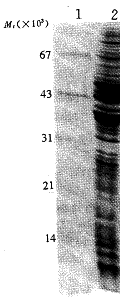

, 百拇医药
图2 重组p31蛋白的表达与初步纯化的SDS-PAGE(15%)分析
Fig 2 Expression and preliminary purification of p31 analyzed by SDS- PAGE(15% )
1:Protein marker; 2:Induced total lysates of pET-3c; 3:Induced total lysates of pET-p31; 4:Inclusion bodies of pET-3c; 5: Inclusion bodies of pET-p31; 6,7:The supernatant after dissolving inclusion bodies of pET- p31 and pET-3c with 1 mol/L NaCl, respectively
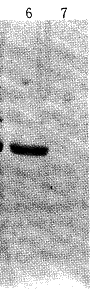
2.3 变性条件下纯化重组蛋白 将包涵体以8mol/L尿素(50mmol/LTrisHCl,pH7.5,1mmol/LEDTA,5mmol/L巯基乙醇,8mol/L尿素)溶解。取溶解上清加入S-Sepharose Fast Flow柱,采用不同浓度的NaCl阶梯洗脱。结果表明,重组蛋白出现在0.15mol/LNaCl的洗脱峰(图3,列4);再经Sephacryl-300(500ml)纯化后,重组蛋白出现在单一的对应于245~273ml洗脱峰中,进一步去除了杂蛋白,达到电泳纯(图3,列5~10)。



, 百拇医药
图3 在变性条件下纯化的重组p31蛋白的SDS-PAGE
Fig 3 SDS-PAGE analysis of the purified recombinant p31 protein under denaturing conditions
1:Protein marker; 2: Induced total lysates; 3: Inclusion bodies; 4: Purified samples after S-Sepharose Fast Flow; 5:Mixed purified samples after Sephacryl- 300 column; 6~ 10:Fraction tube 35, 36, 37, 38 and 39 in Sephacryl- 300 column
2.4 纯化重组蛋白与HIV-1血清的反应性 将纯化抗原包被ELISA板(每孔100ng),用其检测了36份正常人血清与41份HIV-1阳性血清,结果见图4。血清以1∶10稀释时,36份正常人血清的ELI-SAA均值为0.04,方差为0.02,并处于0.02与0.11之间;41份HIV-1阳性血清的ELISAA值在0.20以上,大部分在1.50左右,均值为1.40,表明41份HIV阳性血清中均含有针对p31蛋白的抗体。
, http://www.100md.com
图4 纯化的p31蛋白与正常人血清及抗HIV-1阳性血清的反应性
Fig 4 Reactivities of purified p31 protein with normal human Sera and anti-HIV-1 positive serum by ELISA
Note: Open bars and solid bars indicate normal human sera and anti-HIV-1 positive sera, respectively
3 讨论
目前流行的关于抗HIV-1治疗的观点是,联合使用针对HIV-1生命周期不同阶段的抑制药物。美国食品与药品管理局已经批准上市HIV-1蛋白酶与逆转录酶的抑制药物。由于整合酶为病毒DNA整合到宿主细胞染色体所必需,是抗病毒治疗的另一潜在作用靶位。国外正积极研制针对整合酶的特异性抑制药物。为满足p31蛋白生化结构分析及抑制剂筛选的需求,我们在大肠杆菌中克隆并高效表达了p31蛋白。将重组蛋白与天然蛋白相比较,只在氨基端增加了1个甲硫氨基酸。重组蛋白主要以包涵体的形式表达,利用1mol/LNaCl可溶解一部分包涵体蛋白,在溶解上清中,p31蛋白具有很高的纯度。据文献报道,溶解上清再经过丁基-Sepharose-4B及肝素-CL-6B纯化后,可以获得高纯度的具有生物活性的p31蛋白〔9〕。由于实验室缺乏这两种填料,我们建立了在变性条件下纯化的方案,经依次通过离子交换柱层析与分子筛,可得到电泳纯的重组产品。有关p31蛋白的复性及生化方面的研究有待进一步进行。
, 百拇医药
另一方面,大量纯化重组p31蛋白的获得有利于对HIV-1感染的诊断。HIV-1阳性血清中,抗p31抗体的检出率仅次于抗gp41抗体,是HIV-1确认分析的重要指标之一〔5〕。Chang等〔11〕首次报道,p31C端Mr为15000的片段与检测的所有20份HIV-1阳性血清均可反应。Steimer报道〔12〕,抗p31抗体在HIV-1阳性血清中的检出率为95%。以后的研究进一步证实,约90%左右的阳性血清存在抗p31抗体,滴度随病程进展略有下降〔5,6〕。HIV-1p31能同时检测出HIV-2中存在的抗体。我们利用在变性条件下纯化的p31蛋白检测了41份阳性血清,均与重组p31蛋白有特异性反应,而与所有正常人血清均不起反应。因而在变性条件下所获得的纯化p31蛋白能满足抗HIV-1抗体检测的要求。
*“九五”国家医学科技攻关资助项目,No.96-906-03-16
, 百拇医药
作者简介:韩保光,男,31岁,助理研究员,博士
北京市太平路27号,Tel.(010)66932308
参考文献
[1]Engelman A, Englund G, Orenstein JM, et al. Multiple effects of mutations in human immunodeficiency virus type 1 integrase on viral replication. J Virol, 1995; 69: 2729~2736
[2]Goff S P. Genetics of retroviral integration. Annu Rev Genet, 1992;26:527~544
[3]Heinzinger NK, Burkinsky MI, Haggerty SA, et al. The vpr protein of human immunodeficiency virus type 1 influences nuclear localization of viral nucleic acids in nondividing host cells. Proc Natl Acad Sci USA, 1994; 91:7311~7315
, 百拇医药
[4]Cannon PM, Wilson W, Byles E, et al. Human immunodeficiency virus type 1 integrase: effect on viral replication of mutations at highly conserved residues. J Virol, 1994; 68:4768~4775
[5]Truett MA, Chein DY, Calarco TL, et al. Recombinant immunoblot assay for detection of antibodies to HIV. In: HIV detection by genetic engineering methods. Leuciw PA and Steimer KS(eds). New York Dekker, 1989; 41~47
[6]Marcus-Sekura CJ, Woerner AM, Zweig M, et al. Expression of HIV-1 integrase in E. coli: immunological analysis of the recombinant protein. AIDS Res Human Retroviruses, 1990; 6: 1399~1408
, 百拇医药
[7]Nilsen BM, Haugan IR, Berg K, et al. Monoclonal antibodies against human immunodeficiency virus type 1 integrase: epitope mapping and differential effects on integrase activities in vitro. J Virol, 1996; 70:1580~1587
[8]Ratner L, Haseltine W, Patarca R, et al. Complete nucleotide sequence of the AIDS virus, HTLV-III. Nature, 1985; 313:277~284
[9]Sherman PA, Fyfe JA. Human immunodeficiency virus integration protein expressed in E. coli possesses selective DNA cleaving activity. Proc Natl Acad Sci USA, 1990; 87:5119~5123
, 百拇医药
[10]Grandgenett DP, Goodarzi G.Folding of multidomain human immunodeficiency virus type 1 integrase. Protein Sci, 1994; 3:888~897
[11]Chang NT, Huang J, Ghayeb J, et al. An HTLV-III peptide produced by recombinant DNA is immunoreactive with sera from patients with AIDS. Nature, 1985; 315:151~154
[12]Steimer KS, Higgins KW, Powers MA, et al. Recombinant polypeptide from endonuclease region of the acquired immunnodeficiency syndrome retrovirus polymerase(pol) gene detects serum antibodies in most infected individuals. J Virol, 1985; 58:9~17
[13]Rosenberg AH, Lade BN, Chu D, et al.Vectors for selective expression of cloned DNAs by T7 polymerase. Gene, 1987; 56:125~135
(收稿 1998-06-29 修回 1998-07-20), http://www.100md.com
单位:韩保光 孟莉 马贤凯 宋晓国 陈坤 张贺秋 凌世淦(军事医学科学院基础医学研究所,北京100850)
关键词:HIV-1;整合酶;p31;表达
细胞与分子免疫学杂志990105
摘要 在大肠杆菌中,利用pET-3c表达载体,高效表达了具有全长序列的HIV-1整合酶蛋白(p31)。表达产物主要以包涵体的形式存在,用1mo1/LNaCl溶解包涵体可部分地溶解p31蛋白,溶解上清中p31蛋白具有很高的纯度。本文进一步描述了一种在变性条件下重组蛋白的纯化方法,即将包涵体用8mol/L尿素溶解,先后经过S-Sepharose Fast Flow与Sephacryl-300柱层析,可将重组产物纯化到电泳纯。纯化蛋白以1μg/ml包被ELISA板,分析正常人及HIV-1阳性个体的血清,结果重组p31与检测的所有41份阳性血清均可发生特异反应,而与36份正常血清则不起反应,表明纯化的重组蛋白可用于检测血清中的抗HIV-1抗体。
, 百拇医药
中国图书资料分类号 Q78
Expression, purification and serological application of human immunodeficiency virus type 1 integrase protein(p31)
Han Baoguang, Meng Li, Ma Xiankai, Song Xiaoguo, Chen Kun, Zhang Heqiu, Ling Shigan (Institute of Basic Medical Sciences, Beijing 100850)
Keywords HIV-1 integrase p31 expression
Abstract The sequence encoding the full length of human immunodeficiency virus type 1 integrase has been cloned and highly expressed directly using pET system in E.coli. The recombinant product mainly existed in inclusion bodies (IB). Quantities of recombinant integrase protein could be released by dissolving the inclusion bodies with l mol/L NaCl, resulting in high degree of purification. Alternatively, IB protein could be solublized by 8 mol/L urea and purified under denaturing conditions. The product has been purified close to homogeneity sequentially by S-Sepharose Fast Flow and Sephacryl-300 columns. The purified product reacted with all 41 HIV-1 positive sera but none of 36 normal sera tested. This suggests that the recombinant integrase protein might be useful for detecting HIV-1 antibodies in blood samples.
, 百拇医药
同所有逆转录病毒一样,HIV病毒性感染需要将病毒DNA整合到宿主细胞的染色体上〔1〕。这一过程由逆转录病毒的整合酶(p31)催化完成〔2〕。逆转录病毒侵入宿主细胞后,首先在逆转录酶催化下,以病毒基因组RNA为模板合成双链DNA。逆转录完成后,病毒DNA以一个稳定的核蛋白复合物形式存在,该复合物包括整合过程需要的所有元件〔3〕。复合物进入细胞核后,病毒DNA与宿主染色体共价结合。形成前病毒。整合过程为病毒有效复制与感染状态的维持所必需。最近报道表明,不具有整合能力的HIV1突变体不能产生子代病毒〔4〕。整合过程完成以后,病毒DNA作为宿主细胞基因组的一部分传给子代细胞。同逆转录病毒的蛋白酶及逆转录酶一样,整合酶在宿主细胞中不存在类似物,是治疗AIDS的良好药物作用靶位之一。
在HIV感染个体的血清中,针对p31蛋白的抗体具有很高的发生率,其检出率仅次于抗HIV-1穿膜蛋白gp41的抗体〔5〕。HIV-1与HIV-2的p31蛋白在氨基酸水平上有60%~70%的同源性。HIV-1p31蛋白能同时与HIV-1及HIV-2的阳性血清起反应〔6,7〕。抗p31抗体的检测是确认分析抗HIV抗体的重要指标。
, 百拇医药
为离体研究p31蛋白的生物学活性及检测抗HIV-1抗体的需求,本文在大肠杆菌内高效表达了p31蛋白,摸索了p31蛋白的纯化方法,并将其纯化到电泳纯。另外,以此为抗原,应用ELISA方法对HIV-1阳性血清进行了检测。
1 材料和方法
1.1 菌株与质粒 大肠杆菌BL21(DE3)〔13〕,在染色体上带有T7噬菌体RNA聚合酶编码基因,用于pET〔13〕来源载体的表达。质粒pBH10R3含有HIV-BH10株全长基因〔8〕,均由美国Rasheed博士赠送。pET-3c和pUC18为本室保存。
1.2 酶和试剂 限制性内切酶、T4DNA连接酶、DNA片段回收柱和琼脂糖,均购自Promega公司。S-Sepharose Fast Flow与Sephacryl-300,购于Pharmacia Biotech公司。HIV-1阳性血清为本室保存。
, 百拇医药
1.3 p31基因的克隆与表达质粒的构建 以质粒pBH10R3为模板,使用1对PCR引物扩赠p31基因。5'端引物的序列为:GGAATTCATATGTTTTTAGATGGAATAGATA;3'端引物的序列为:CCGGTACCTTAATCCTCATCCTG。扩赠条件为:95℃50s,50℃50s,72℃50s;扩增30个循环后,72℃延伸7min。PCR产物经Promega公司WizardPCR纯化试剂盒纯化,用Klenow酶补平,再以KpnI酶切,低熔点琼脂糖回收DNA。pUC18质粒以EcoRI酶切,Klenow片段补平,再以KpnI酶切,回收载体片段,与酶切的PCR产物连接,构建pUC-p31重组质粒。pUC-p31质粒以NdeI与BamHI双酶切,回收约860bp的基因片段,与同样酶切的pET-3c质粒连接,构建表达质粒pET-p31。转化大肠杆菌BL21(DE3)后,获得p31蛋白表达菌。
1.4 重组蛋白的表达与可溶性蛋白的初步纯化 挑取pET-p31/BL21(DE3)单个克隆,接种于100ml含有100mg/L氨苄青霉素的LB培养基中,30℃过夜生长。次日以1∶10接种于1L同样的培养基中,30℃继续生长到A600=0.8~1.0。加入IPTG至终浓度为0.5mmol/L,继续诱导4h后收菌,于20℃冰箱中过夜冻存。
, 百拇医药
菌体重悬于50ml缓冲液A(组成:50mmol/LTris-HC1,pH7.5,1mmol/LEDTA,5mmol/L巯基乙醇),超声破碎细菌,提取包涵体。用缓冲液A洗涤后,再以含0.1mmol/LNaCl的缓冲液A洗涤1次。将包涵体悬于10ml含1mmol/LNaCl的缓冲液A中,用Dounce匀浆器匀浆50次,在冰上搅拌2h,经12000×g离心30min后,做SDS-PAGE观察结果。
1.5 变性条件下纯化重组蛋白 包涵体以20ml缓冲液B(缓冲液A中加入尿素至终浓度为8mol/L)溶解,以12000×g离心20min,取上清。S-Sepharose Fast Flow柱预先以缓冲液B平衡,将上清上柱,流速为0.5ml/min。依次用50mmol/L,100mmol/L,150mmol/L,200mmol/L和500mmol/L的NaCl(以缓冲液B配制)阶梯洗脱。根据SDS-PAGE的结果,收集重组蛋白所在的峰,再用凝胶过滤进一步纯化。Sephacryl-300柱体积为500ml,用含0.15mol/LNaCl的缓冲液B充分平衡后上样,流速为30ml/h。用自动收集器分管收集,每15min收集1管。以SDSPAGE鉴定p31蛋白所在的峰。
, 百拇医药
1.6 纯化p31重组蛋白与HIV-1血清的反应性 纯化抗原以包被液(50mmol/LNa2CO3,pH9.6)稀释到浓度为1mg/L,包被ELISA板,4℃过夜。以含1%BSA的PBST(含0.05% Tween-20的PBS)4℃封闭4h6h。标准血清以样品稀释液(100mmol/LNa3PO3,pH7.5,10%山羊血清,0.05%Tween-20)作1∶10稀释,每孔加入100μl,37℃反应30min。以PBST充分洗涤后,加入辣根过氧化物酶标记的小鼠抗人mAb(1/25000),37℃温育15min,充分洗涤,用OPD作为底物显色10min,测定492nm的光吸收值。
2 结果
2.1 HIV-1整合酶基因的克隆及表达质粒的构建 HIV-1整合酶蛋白由pol基因3'端序列编码,成熟蛋白由GagPol前体蛋白加工而来。HIV-1BH10克隆的整合酶蛋白包括289个氨基酸残基,相对分子质量(Mr)为32000,又称为p31。以含有HIV-1全长编码基因的质粒pBH10R3为模板,采用PCR方法扩增p31全长基因,并在5'端添加起始密码ATG。将PCR产物首先克隆到pUC18载体上,构建pUC-p31质粒。随后以NdeI与BamHI将p31基因从质粒pUC-p31上切下,克隆到表达载体pET-3c上,构建表达质粒pET-p31(图1),构建的正确性用酶切证实。

, 百拇医药
图1 HIV-1整合酶表达质粒的构建
Fig 1 Construction of expression plasmid pET-p31
2.2 p31蛋白的表达与可溶性蛋白的初步纯化 将表达质粒pET-p31转化大肠杆菌BL21(DE3),获得表达菌。预计可表达Mr为32000的重组蛋白。以pET-3c/BL21(DE3)作为对照,采用IPTG诱导pET-p31/BL21(DE3)。与对照菌相比较,在Mr为32000的预期位置上,有特异性表达(图2,列3),表达产物主要存在于包涵体中(图2,列5)。有趣的是,使用1mol/LNaCl能使包涵体中的p31蛋白部分地溶解,溶解上清中重组蛋白的纯度可达80%以上(图2,列6),对照菌中无表达蛋白。



, 百拇医药
图2 重组p31蛋白的表达与初步纯化的SDS-PAGE(15%)分析
Fig 2 Expression and preliminary purification of p31 analyzed by SDS- PAGE(15% )
1:Protein marker; 2:Induced total lysates of pET-3c; 3:Induced total lysates of pET-p31; 4:Inclusion bodies of pET-3c; 5: Inclusion bodies of pET-p31; 6,7:The supernatant after dissolving inclusion bodies of pET- p31 and pET-3c with 1 mol/L NaCl, respectively
2.3 变性条件下纯化重组蛋白 将包涵体以8mol/L尿素(50mmol/LTrisHCl,pH7.5,1mmol/LEDTA,5mmol/L巯基乙醇,8mol/L尿素)溶解。取溶解上清加入S-Sepharose Fast Flow柱,采用不同浓度的NaCl阶梯洗脱。结果表明,重组蛋白出现在0.15mol/LNaCl的洗脱峰(图3,列4);再经Sephacryl-300(500ml)纯化后,重组蛋白出现在单一的对应于245~273ml洗脱峰中,进一步去除了杂蛋白,达到电泳纯(图3,列5~10)。




, 百拇医药
图3 在变性条件下纯化的重组p31蛋白的SDS-PAGE
Fig 3 SDS-PAGE analysis of the purified recombinant p31 protein under denaturing conditions
1:Protein marker; 2: Induced total lysates; 3: Inclusion bodies; 4: Purified samples after S-Sepharose Fast Flow; 5:Mixed purified samples after Sephacryl- 300 column; 6~ 10:Fraction tube 35, 36, 37, 38 and 39 in Sephacryl- 300 column
2.4 纯化重组蛋白与HIV-1血清的反应性 将纯化抗原包被ELISA板(每孔100ng),用其检测了36份正常人血清与41份HIV-1阳性血清,结果见图4。血清以1∶10稀释时,36份正常人血清的ELI-SAA均值为0.04,方差为0.02,并处于0.02与0.11之间;41份HIV-1阳性血清的ELISAA值在0.20以上,大部分在1.50左右,均值为1.40,表明41份HIV阳性血清中均含有针对p31蛋白的抗体。

, http://www.100md.com
图4 纯化的p31蛋白与正常人血清及抗HIV-1阳性血清的反应性
Fig 4 Reactivities of purified p31 protein with normal human Sera and anti-HIV-1 positive serum by ELISA
Note: Open bars and solid bars indicate normal human sera and anti-HIV-1 positive sera, respectively
3 讨论
目前流行的关于抗HIV-1治疗的观点是,联合使用针对HIV-1生命周期不同阶段的抑制药物。美国食品与药品管理局已经批准上市HIV-1蛋白酶与逆转录酶的抑制药物。由于整合酶为病毒DNA整合到宿主细胞染色体所必需,是抗病毒治疗的另一潜在作用靶位。国外正积极研制针对整合酶的特异性抑制药物。为满足p31蛋白生化结构分析及抑制剂筛选的需求,我们在大肠杆菌中克隆并高效表达了p31蛋白。将重组蛋白与天然蛋白相比较,只在氨基端增加了1个甲硫氨基酸。重组蛋白主要以包涵体的形式表达,利用1mol/LNaCl可溶解一部分包涵体蛋白,在溶解上清中,p31蛋白具有很高的纯度。据文献报道,溶解上清再经过丁基-Sepharose-4B及肝素-CL-6B纯化后,可以获得高纯度的具有生物活性的p31蛋白〔9〕。由于实验室缺乏这两种填料,我们建立了在变性条件下纯化的方案,经依次通过离子交换柱层析与分子筛,可得到电泳纯的重组产品。有关p31蛋白的复性及生化方面的研究有待进一步进行。
, 百拇医药
另一方面,大量纯化重组p31蛋白的获得有利于对HIV-1感染的诊断。HIV-1阳性血清中,抗p31抗体的检出率仅次于抗gp41抗体,是HIV-1确认分析的重要指标之一〔5〕。Chang等〔11〕首次报道,p31C端Mr为15000的片段与检测的所有20份HIV-1阳性血清均可反应。Steimer报道〔12〕,抗p31抗体在HIV-1阳性血清中的检出率为95%。以后的研究进一步证实,约90%左右的阳性血清存在抗p31抗体,滴度随病程进展略有下降〔5,6〕。HIV-1p31能同时检测出HIV-2中存在的抗体。我们利用在变性条件下纯化的p31蛋白检测了41份阳性血清,均与重组p31蛋白有特异性反应,而与所有正常人血清均不起反应。因而在变性条件下所获得的纯化p31蛋白能满足抗HIV-1抗体检测的要求。
*“九五”国家医学科技攻关资助项目,No.96-906-03-16
, 百拇医药
作者简介:韩保光,男,31岁,助理研究员,博士
北京市太平路27号,Tel.(010)66932308
参考文献
[1]Engelman A, Englund G, Orenstein JM, et al. Multiple effects of mutations in human immunodeficiency virus type 1 integrase on viral replication. J Virol, 1995; 69: 2729~2736
[2]Goff S P. Genetics of retroviral integration. Annu Rev Genet, 1992;26:527~544
[3]Heinzinger NK, Burkinsky MI, Haggerty SA, et al. The vpr protein of human immunodeficiency virus type 1 influences nuclear localization of viral nucleic acids in nondividing host cells. Proc Natl Acad Sci USA, 1994; 91:7311~7315
, 百拇医药
[4]Cannon PM, Wilson W, Byles E, et al. Human immunodeficiency virus type 1 integrase: effect on viral replication of mutations at highly conserved residues. J Virol, 1994; 68:4768~4775
[5]Truett MA, Chein DY, Calarco TL, et al. Recombinant immunoblot assay for detection of antibodies to HIV. In: HIV detection by genetic engineering methods. Leuciw PA and Steimer KS(eds). New York Dekker, 1989; 41~47
[6]Marcus-Sekura CJ, Woerner AM, Zweig M, et al. Expression of HIV-1 integrase in E. coli: immunological analysis of the recombinant protein. AIDS Res Human Retroviruses, 1990; 6: 1399~1408
, 百拇医药
[7]Nilsen BM, Haugan IR, Berg K, et al. Monoclonal antibodies against human immunodeficiency virus type 1 integrase: epitope mapping and differential effects on integrase activities in vitro. J Virol, 1996; 70:1580~1587
[8]Ratner L, Haseltine W, Patarca R, et al. Complete nucleotide sequence of the AIDS virus, HTLV-III. Nature, 1985; 313:277~284
[9]Sherman PA, Fyfe JA. Human immunodeficiency virus integration protein expressed in E. coli possesses selective DNA cleaving activity. Proc Natl Acad Sci USA, 1990; 87:5119~5123
, 百拇医药
[10]Grandgenett DP, Goodarzi G.Folding of multidomain human immunodeficiency virus type 1 integrase. Protein Sci, 1994; 3:888~897
[11]Chang NT, Huang J, Ghayeb J, et al. An HTLV-III peptide produced by recombinant DNA is immunoreactive with sera from patients with AIDS. Nature, 1985; 315:151~154
[12]Steimer KS, Higgins KW, Powers MA, et al. Recombinant polypeptide from endonuclease region of the acquired immunnodeficiency syndrome retrovirus polymerase(pol) gene detects serum antibodies in most infected individuals. J Virol, 1985; 58:9~17
[13]Rosenberg AH, Lade BN, Chu D, et al.Vectors for selective expression of cloned DNAs by T7 polymerase. Gene, 1987; 56:125~135
(收稿 1998-06-29 修回 1998-07-20), http://www.100md.com