超细玻璃纤维膜白细胞过滤器的研究
作者:姚芳芳 孙启俊 邹元国 李爱华 胡正芳 马文嵘
单位:姚芳芳(南京红十字血液中心 210008);孙启俊(南京红十字血液中心 210008);邹元国(南京红十字血液中心 210008);李爱华(南京玻璃纤维研究设计院);胡正芳(南京玻璃纤维研究设计院);马文嵘(南京红十字血液中心 210008)
关键词:成分输血;滤除白细胞;玻璃纤维
中国输血杂志000313
中图分类号 R457.1 R331.1+41 TQ171.77+7. 3
未经处理的全血或血液成分制剂中含有大量的白细胞,输入病人体内会引起许多副作用,最 常见的如非溶血性发热反应,HLA同种免疫反应以及引起CMV、HTLV-I病毒的传染和GVHD [1]。 以往采用的多种去除白细胞的方法中,以过滤法效果最好,应用最广泛。现在欧、美、日 等国至少有5种以上的滤除白细胞输血器作为商品得到很好的应用,这些滤器的滤材主要 是聚脂纤维做成的无纺布和醋酸纤维做成的片状膜[2],不仅有着很大的比表面 积,而且在成纤维生产过程中添加了精心配制的高分子聚合材料,使纤维制成的无纺布在成 膜状态下临界表面张力明显增大,滤膜浸润性好,血液容易通过。国产的同类聚脂纤维却未 经过特殊处理,成膜状态下临界表面张力低,浸润性差,血液难以通过。为此,笔者利用无 机超细 玻璃纤 维膜具有很高的临界表面张力和很好的浸润性、血液很容易通过的特点,制备玻纤膜滤除 白细胞输血器,过滤库存全血及SAGM红细胞悬液,取得了满意的效果,现报告如下。
, 百拇医药
1 材料和方法
1.1 玻纤膜滤除白细胞输血器 床边形见图1-1,血库型见图1 -2,滤器过滤膜用无机超细玻 璃纤维制成多孔网状结构膜,由入血口向出血口方向依次排列为粗滤层和精滤层,外壳为普 通塑料件见图1-3。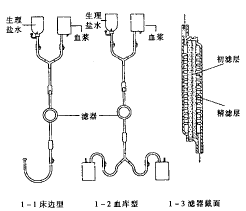
图1 玻纤膜滤除白细胞输血器示意图
1.2 过滤过程 从4℃冰箱取出全血或SAGM红细胞悬液,充分 混匀,按无菌操作在滤器上端分 别接生理盐水和血袋,先打开盐水通道,排除滤器及管道中的空气,然后过滤。血库型滤器 下端接收集袋,血袋与收集袋位差1米,过滤完毕用约50ml盐水冲洗 滤器,最后封好 袋口, 贴上标签送临床输用。床边型滤器下端接病人静脉,过滤和输血同时进行,输注完毕用约50 ml生理盐水冲洗管道。为了评价滤器的使用性能,笔者用血库型滤器做试验,滤前称重原血 袋,滤后称重收集袋,并从各袋中抽取血样1ml。
, http://www.100md.com
1.3 血样实验室检测 检测过滤前/后血样中血红蛋白、血浆游离 血红蛋白、红细胞渗透脆性 、活化部分凝血活酶时间(KPTT)、凝血酶原时间(PT)、凝血酶时间(TT)、纤维蛋白原 、总补体溶血活性(CH50)和C3含量,测定均采用标准技术[3]。白细胞计数:过 滤前血样采用标准技术,过滤后血样采用Naggeotte计数和流式细胞仪检测。
1.3.1 Naggeotte计数法[4] 计数池体积50μl, 样品用Turk's液按1∶10稀释(100+900μl) ,血样放置至少2min,混匀,充满计数池,静置至少1min,显微镜 下计数整个区域, 其精确 度为显微镜下所见每个白细胞相当于0.2/μl。
1.3.2 流式细胞仪计数[5] 取未处理全血及过滤后全血各2ml ,3000r/min离心100min,去除血浆保留全部血细胞,然后充分混匀,再各取血样100μl ,放入4%冰醋酸500μl稀释,使红细胞完全溶解,混匀, 再次取100ul(相当于取原血样16.6μl×2),用PBS洗涤白细胞,用PI(propidium iodid e)染色制作1ml混悬液,流式细胞仪(型号FCSA)分别计数。
, http://www.100md.com
1.4 滤器理化性能检测 把新鲜蒸馏水灌满滤除白细胞输血器,37℃ 放置24h,再用新鲜蒸馏 水冲洗,收集水浸液250ml,用等离子发射光谱仪(ARL3410型,仪器波长165~800nm, 分辨率0.013nm)检测。按国家标准[6]规定的方法检测pH、还原物质 、重金属、不挥发物、不溶性微粒。
1.5 滤器的生物性能检测 按国家标准[7]规定 的方法检测热原、无菌、急性全身毒性、皮内刺激、皮肤致敏、细胞毒性、溶血等试验。
1.6 玻纤膜截留细胞检查 过滤完血液打开滤器外壳,取出玻纤膜,扫 描电镜观察。
1.7 实验数据计算及数据统计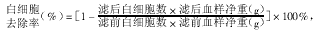

, 百拇医药
2 结果
2.1 ACD库存全血和SAGM红细胞悬液经过玻纤膜滤除白 细胞输血器过滤前后的结果 见表1。 流式细胞仪复检显示:未处理血细胞中白细胞总数107900个(相当于3250个/μl),扫描图见图2曲线(1); 过滤后血细胞中白细胞总数160个(相当于4.8个/μl),扫描图见图2曲线(2)。
表1 玻纤膜滤器滤除白细胞效率(n=50)
过滤前
过滤后
去除率(%)
体积
(ml)
WBC
, 百拇医药
(个/μl)
WBC总数
(×108)
体积
(ml)
WBC
(个/μl)
WBC总数
(×106)
ACD全血
500
3800±1200
, http://www.100md.com
19.0±6
500±20
4.2±3.2
2.2±2
99
SAGM-RC
380±20
5050±1850
19.2±8.2
420±25
5.0±4.2
2.1±2
, 百拇医药
99
图2 流式细胞仪扫描白细胞中DNA浓度扫描积 分曲线图
2.2 库存ACD全血和SAGM红细胞悬液过滤前后部分实验结果 见表2。玻纤膜滤器红细胞回收率超过90%,红细胞膜保持原有的完整性。
表2 玻纤膜滤器对红细胞的影响(n=30)
过滤前
过滤后
P
Hb总量
SAGM-RC(g/2U)
, 百拇医药
46±8
42±6
<0.05
ACD全血(g/500ml)
45±7
42±5
<0.05
红细胞渗透脆性
>开始溶血 NaCl(mol/L)
95±6
95±6
>0.05
, 百拇医药
完全溶血 NaCl(mol/L)
54±6
54±6
>0.05
血浆游离Hb(mg/L)
ACD全血血浆
7±5.2
9.6±5.6
>0.05
SAGM-RBC上清
1.5±0.4
1.2±0.3
, 百拇医药
>0.05
2.3 保存24h的ACD全血过滤前后血浆中凝血因子 、补体、纤维蛋白原等项实验结果 见表3。表3 玻纤膜滤器对凝血因子、补体、纤维蛋 白原
的影响 (n=30,P>0.05)
过滤前
过滤后
KPTT(s)
42±2
41±2
PT(s)
12.4±0.5
12.2±0.3
, 百拇医药
TT(s)
12.3±0.6
13.1±0.2
纤维蛋白原(g/L)
1.2±0.3
1.2±0.2
CH50(U/ml)
44.4±4
44.4±4
C3(g/L)
0.78±0.1
0.74±0.1
, 百拇医药
2.4 玻纤膜滤除白细胞输血器水浸液检测结果 见表4。 用等离子发射光谱仪检测水浸液,仪器显示27种离子的含量,在仪器灵敏度之上仅检测 出Si+4 1.58μg/ml,Ca+2 0.40μg/ml。表4 玻纤膜滤器水浸液的化学检测和不溶 性微粒检测 检验项目
技术要求[8]
检测结果
结论
易氧化物(ml)
与空白对比消耗高猛酸钾
溶液量之差 ≤2.0
0.5
合格
, http://www.100md.com
金属离子(μg/ml)
钡、铬、铜、铅、锡、镉 ≤1
未检出
合格
酸碱度
与空白对照液之差≤1.5
0.1
合格
不挥发物(mg)
50ml水浸液含量≤2
0.6
合格
, http://www.100md.com
微粒污染
15~25μm微粒≤600个
122~166
合格
(个/200ml洗脱液)
大于25μm的微粒≤200个
14~20
合格
纤维数
≤6个
0
合格
, http://www.100md.com 2.5 玻纤膜滤除白细胞输血器生物性能检测结果 见表 5。表5 玻纤膜滤器生物性能检测 检验项目
技术要求[8]
检测结果
结论
急性全身毒性
无
无
合格
溶血率
<5%
0.9%
合格
, 百拇医药
皮内刺激
无
无
合格
皮肤致敏率
<8%
0
合格
细胞毒性反应
(0-5级分类)
0~1级
1级
合格
, 百拇医药
细菌
无菌
无菌
合格
热原(热原反应)
无
无
合格
2.6 扫描电镜显示:玻纤膜对白细胞有很强的吸附作用(图3-A ), 同时玻纤 膜网状结构具有一定的孔径,可以截住白细胞(图3-B),而红细胞表面光滑,受到玻纤网 状结构阻挡时会发生变形运动穿过玻纤膜(图3-C、D)。
, 百拇医药 图3 红细胞变形、玻纤吸附截留白细胞扫描电镜图
3 讨论
笔者研制的玻纤膜滤除白细胞输血器,一次能够滤除400ml全血 ,或由400ml全血制备的2U SAGM红细胞悬液中99%以上的白细胞,残留的白细胞总数<5× 106,红细胞回收率超 过9 0%,且不影响红细胞的完整性,不影响血浆中凝血因子和补体。在1m静压下,血库型流 速能达到20ml/min,床边型流速能达到10ml/min。两型各100例使用表明,玻纤膜滤器 性能稳定,各种参数之间个体差异很小,达到国外同类产品现有水平[2]。
ACD全血和SAGM红细胞悬液,是目前临床输血数量最多的品种,ACD全血保存期21 d, SAGM红细胞悬液保存期42d[9],但实际应用中一般不超过10d。笔者用保存期1 ~7d (做凝血因子和补体检测的全血保存期只有24h) 的血 液进行试验,获得的数据具有代 表性。
, http://www.100md.com
玻纤膜滤器分为床边型和血库型,是为了满足临床方面不同的需要。床边型边输血,边 过滤 ,更适合于远离血液中心的医疗单位使用,同时病人看见血液处理过程,能够得到心理上安 慰。血库型由血液中心技术人员完成处理过程,处理后的血液作为成分制剂向临床供应。 将玻纤膜应用于血液过滤,安全性是首先必须考虑的,笔者用电子探针对玻纤进行分析 ,玻纤是Mg、Al、Si、Ca、Na等原子氧化物所组成,化学成 分与普通医用玻璃没有什么差别。玻纤膜生物性能及理化性能证明,玻纤膜的安全性十分稳 定,能够用来作为白细胞过滤器的滤材。
参考文献
1,Riggert J, Simson G, Dittmann J, et al. Prestorage leukocyte depletion with in-line filtration of whole blood in comparison with blood component leukocyte depletion. Vox Sang ,1995,69:201
, http://www.100md.com
2,Pietersz RNI, Steneker I, Reesink HW, et al.Comparison of five differe nt fi lters for the removal of leukocytes from red cell concentrates. Vox Sang ,1992, 62:76
3,中华人民共和国卫生部医政司编.全国临床检验操作规程.南京:东南大学出版社,1991, 44,54
4,Masse M, Naegelen C, Pellegrini N, et al.Validation of a simple method to c ount very low white cell concentrations in filtered red cells or platelets.Tran sfusion ,1992,32:565
, http://www.100md.com 5,Bodensteiner DC.A flow cytometric technique to accurately measure postf iltration white blood cell counts. Transfusion ,1989,29:651
6,GB/T14233.1-93医用输液、输血、注射器检验方法.第一部分.化学分析方法
7,GB/T14233.2-93医用输液、输血、注射器检验方法.第二部分. 生物实验方法
8,GB8369-93一次性使用输血器.GB8369-93
9,Hgman CF, Akerblom O, Hedlund K, et al. Red cell suspension in SAGM medium . Vox Sang ,1983,45:217
1999-09-29收稿
2000-05-17修回, 百拇医药
单位:姚芳芳(南京红十字血液中心 210008);孙启俊(南京红十字血液中心 210008);邹元国(南京红十字血液中心 210008);李爱华(南京玻璃纤维研究设计院);胡正芳(南京玻璃纤维研究设计院);马文嵘(南京红十字血液中心 210008)
关键词:成分输血;滤除白细胞;玻璃纤维
中国输血杂志000313
中图分类号 R457.1 R331.1+41 TQ171.77+7. 3
未经处理的全血或血液成分制剂中含有大量的白细胞,输入病人体内会引起许多副作用,最 常见的如非溶血性发热反应,HLA同种免疫反应以及引起CMV、HTLV-I病毒的传染和GVHD [1]。 以往采用的多种去除白细胞的方法中,以过滤法效果最好,应用最广泛。现在欧、美、日 等国至少有5种以上的滤除白细胞输血器作为商品得到很好的应用,这些滤器的滤材主要 是聚脂纤维做成的无纺布和醋酸纤维做成的片状膜[2],不仅有着很大的比表面 积,而且在成纤维生产过程中添加了精心配制的高分子聚合材料,使纤维制成的无纺布在成 膜状态下临界表面张力明显增大,滤膜浸润性好,血液容易通过。国产的同类聚脂纤维却未 经过特殊处理,成膜状态下临界表面张力低,浸润性差,血液难以通过。为此,笔者利用无 机超细 玻璃纤 维膜具有很高的临界表面张力和很好的浸润性、血液很容易通过的特点,制备玻纤膜滤除 白细胞输血器,过滤库存全血及SAGM红细胞悬液,取得了满意的效果,现报告如下。
, 百拇医药
1 材料和方法
1.1 玻纤膜滤除白细胞输血器 床边形见图1-1,血库型见图1 -2,滤器过滤膜用无机超细玻 璃纤维制成多孔网状结构膜,由入血口向出血口方向依次排列为粗滤层和精滤层,外壳为普 通塑料件见图1-3。

图1 玻纤膜滤除白细胞输血器示意图
1.2 过滤过程 从4℃冰箱取出全血或SAGM红细胞悬液,充分 混匀,按无菌操作在滤器上端分 别接生理盐水和血袋,先打开盐水通道,排除滤器及管道中的空气,然后过滤。血库型滤器 下端接收集袋,血袋与收集袋位差1米,过滤完毕用约50ml盐水冲洗 滤器,最后封好 袋口, 贴上标签送临床输用。床边型滤器下端接病人静脉,过滤和输血同时进行,输注完毕用约50 ml生理盐水冲洗管道。为了评价滤器的使用性能,笔者用血库型滤器做试验,滤前称重原血 袋,滤后称重收集袋,并从各袋中抽取血样1ml。
, http://www.100md.com
1.3 血样实验室检测 检测过滤前/后血样中血红蛋白、血浆游离 血红蛋白、红细胞渗透脆性 、活化部分凝血活酶时间(KPTT)、凝血酶原时间(PT)、凝血酶时间(TT)、纤维蛋白原 、总补体溶血活性(CH50)和C3含量,测定均采用标准技术[3]。白细胞计数:过 滤前血样采用标准技术,过滤后血样采用Naggeotte计数和流式细胞仪检测。
1.3.1 Naggeotte计数法[4] 计数池体积50μl, 样品用Turk's液按1∶10稀释(100+900μl) ,血样放置至少2min,混匀,充满计数池,静置至少1min,显微镜 下计数整个区域, 其精确 度为显微镜下所见每个白细胞相当于0.2/μl。
1.3.2 流式细胞仪计数[5] 取未处理全血及过滤后全血各2ml ,3000r/min离心100min,去除血浆保留全部血细胞,然后充分混匀,再各取血样100μl ,放入4%冰醋酸500μl稀释,使红细胞完全溶解,混匀, 再次取100ul(相当于取原血样16.6μl×2),用PBS洗涤白细胞,用PI(propidium iodid e)染色制作1ml混悬液,流式细胞仪(型号FCSA)分别计数。
, http://www.100md.com
1.4 滤器理化性能检测 把新鲜蒸馏水灌满滤除白细胞输血器,37℃ 放置24h,再用新鲜蒸馏 水冲洗,收集水浸液250ml,用等离子发射光谱仪(ARL3410型,仪器波长165~800nm, 分辨率0.013nm)检测。按国家标准[6]规定的方法检测pH、还原物质 、重金属、不挥发物、不溶性微粒。
1.5 滤器的生物性能检测 按国家标准[7]规定 的方法检测热原、无菌、急性全身毒性、皮内刺激、皮肤致敏、细胞毒性、溶血等试验。
1.6 玻纤膜截留细胞检查 过滤完血液打开滤器外壳,取出玻纤膜,扫 描电镜观察。
1.7 实验数据计算及数据统计
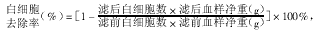

, 百拇医药
2 结果
2.1 ACD库存全血和SAGM红细胞悬液经过玻纤膜滤除白 细胞输血器过滤前后的结果 见表1。 流式细胞仪复检显示:未处理血细胞中白细胞总数107900个(相当于3250个/μl),扫描图见图2曲线(1); 过滤后血细胞中白细胞总数160个(相当于4.8个/μl),扫描图见图2曲线(2)。
表1 玻纤膜滤器滤除白细胞效率(n=50)
过滤前
过滤后
去除率(%)
体积
(ml)
WBC
, 百拇医药
(个/μl)
WBC总数
(×108)
体积
(ml)
WBC
(个/μl)
WBC总数
(×106)
ACD全血
500
3800±1200
, http://www.100md.com
19.0±6
500±20
4.2±3.2
2.2±2
99
SAGM-RC
380±20
5050±1850
19.2±8.2
420±25
5.0±4.2
2.1±2
, 百拇医药
99

图2 流式细胞仪扫描白细胞中DNA浓度扫描积 分曲线图
2.2 库存ACD全血和SAGM红细胞悬液过滤前后部分实验结果 见表2。玻纤膜滤器红细胞回收率超过90%,红细胞膜保持原有的完整性。
表2 玻纤膜滤器对红细胞的影响(n=30)
过滤前
过滤后
P
Hb总量
SAGM-RC(g/2U)
, 百拇医药
46±8
42±6
<0.05
ACD全血(g/500ml)
45±7
42±5
<0.05
红细胞渗透脆性
>开始溶血 NaCl(mol/L)
95±6
95±6
>0.05
, 百拇医药
完全溶血 NaCl(mol/L)
54±6
54±6
>0.05
血浆游离Hb(mg/L)
ACD全血血浆
7±5.2
9.6±5.6
>0.05
SAGM-RBC上清
1.5±0.4
1.2±0.3
, 百拇医药
>0.05
2.3 保存24h的ACD全血过滤前后血浆中凝血因子 、补体、纤维蛋白原等项实验结果 见表3。表3 玻纤膜滤器对凝血因子、补体、纤维蛋 白原
的影响 (n=30,P>0.05)
过滤前
过滤后
KPTT(s)
42±2
41±2
PT(s)
12.4±0.5
12.2±0.3
, 百拇医药
TT(s)
12.3±0.6
13.1±0.2
纤维蛋白原(g/L)
1.2±0.3
1.2±0.2
CH50(U/ml)
44.4±4
44.4±4
C3(g/L)
0.78±0.1
0.74±0.1
, 百拇医药
2.4 玻纤膜滤除白细胞输血器水浸液检测结果 见表4。 用等离子发射光谱仪检测水浸液,仪器显示27种离子的含量,在仪器灵敏度之上仅检测 出Si+4 1.58μg/ml,Ca+2 0.40μg/ml。表4 玻纤膜滤器水浸液的化学检测和不溶 性微粒检测 检验项目
技术要求[8]
检测结果
结论
易氧化物(ml)
与空白对比消耗高猛酸钾
溶液量之差 ≤2.0
0.5
合格
, http://www.100md.com
金属离子(μg/ml)
钡、铬、铜、铅、锡、镉 ≤1
未检出
合格
酸碱度
与空白对照液之差≤1.5
0.1
合格
不挥发物(mg)
50ml水浸液含量≤2
0.6
合格
, http://www.100md.com
微粒污染
15~25μm微粒≤600个
122~166
合格
(个/200ml洗脱液)
大于25μm的微粒≤200个
14~20
合格
纤维数
≤6个
0
合格
, http://www.100md.com 2.5 玻纤膜滤除白细胞输血器生物性能检测结果 见表 5。表5 玻纤膜滤器生物性能检测 检验项目
技术要求[8]
检测结果
结论
急性全身毒性
无
无
合格
溶血率
<5%
0.9%
合格
, 百拇医药
皮内刺激
无
无
合格
皮肤致敏率
<8%
0
合格
细胞毒性反应
(0-5级分类)
0~1级
1级
合格
, 百拇医药
细菌
无菌
无菌
合格
热原(热原反应)
无
无
合格
2.6 扫描电镜显示:玻纤膜对白细胞有很强的吸附作用(图3-A ), 同时玻纤 膜网状结构具有一定的孔径,可以截住白细胞(图3-B),而红细胞表面光滑,受到玻纤网 状结构阻挡时会发生变形运动穿过玻纤膜(图3-C、D)。

, 百拇医药 图3 红细胞变形、玻纤吸附截留白细胞扫描电镜图
3 讨论
笔者研制的玻纤膜滤除白细胞输血器,一次能够滤除400ml全血 ,或由400ml全血制备的2U SAGM红细胞悬液中99%以上的白细胞,残留的白细胞总数<5× 106,红细胞回收率超 过9 0%,且不影响红细胞的完整性,不影响血浆中凝血因子和补体。在1m静压下,血库型流 速能达到20ml/min,床边型流速能达到10ml/min。两型各100例使用表明,玻纤膜滤器 性能稳定,各种参数之间个体差异很小,达到国外同类产品现有水平[2]。
ACD全血和SAGM红细胞悬液,是目前临床输血数量最多的品种,ACD全血保存期21 d, SAGM红细胞悬液保存期42d[9],但实际应用中一般不超过10d。笔者用保存期1 ~7d (做凝血因子和补体检测的全血保存期只有24h) 的血 液进行试验,获得的数据具有代 表性。
, http://www.100md.com
玻纤膜滤器分为床边型和血库型,是为了满足临床方面不同的需要。床边型边输血,边 过滤 ,更适合于远离血液中心的医疗单位使用,同时病人看见血液处理过程,能够得到心理上安 慰。血库型由血液中心技术人员完成处理过程,处理后的血液作为成分制剂向临床供应。 将玻纤膜应用于血液过滤,安全性是首先必须考虑的,笔者用电子探针对玻纤进行分析 ,玻纤是Mg、Al、Si、Ca、Na等原子氧化物所组成,化学成 分与普通医用玻璃没有什么差别。玻纤膜生物性能及理化性能证明,玻纤膜的安全性十分稳 定,能够用来作为白细胞过滤器的滤材。
参考文献
1,Riggert J, Simson G, Dittmann J, et al. Prestorage leukocyte depletion with in-line filtration of whole blood in comparison with blood component leukocyte depletion. Vox Sang ,1995,69:201
, http://www.100md.com
2,Pietersz RNI, Steneker I, Reesink HW, et al.Comparison of five differe nt fi lters for the removal of leukocytes from red cell concentrates. Vox Sang ,1992, 62:76
3,中华人民共和国卫生部医政司编.全国临床检验操作规程.南京:东南大学出版社,1991, 44,54
4,Masse M, Naegelen C, Pellegrini N, et al.Validation of a simple method to c ount very low white cell concentrations in filtered red cells or platelets.Tran sfusion ,1992,32:565
, http://www.100md.com 5,Bodensteiner DC.A flow cytometric technique to accurately measure postf iltration white blood cell counts. Transfusion ,1989,29:651
6,GB/T14233.1-93医用输液、输血、注射器检验方法.第一部分.化学分析方法
7,GB/T14233.2-93医用输液、输血、注射器检验方法.第二部分. 生物实验方法
8,GB8369-93一次性使用输血器.GB8369-93
9,Hgman CF, Akerblom O, Hedlund K, et al. Red cell suspension in SAGM medium . Vox Sang ,1983,45:217
1999-09-29收稿
2000-05-17修回, 百拇医药