乳香诱导急性早幼粒细胞白血病细胞凋亡与细胞周期改变.
作者:齐振华 张国平 赵谢兰 柳昕 李卫红
单位:齐振华 (湖南医科大学湘雅医院血液研究室 长沙,410008);张国平 (湖南医科大学湘雅医院血液研究室 长沙,410008);赵谢兰 (湖南医科大学湘雅医院血液研究室 长沙,410008);柳昕 (湖南医科大学湘雅医院血液研究室 长沙,410008);李卫红 (湖南医科大学湘雅医院血液研究室 长沙,410008)
关键词:白血病;早幼粒细胞;急性;乳香;细胞凋亡;细胞周期
临床血液学杂志000312 摘要 目的:为探讨乳香抗白血病的作用机制,研究乳香诱导急性早幼粒细胞白血病细胞凋亡与细胞周期关系。方法:应用形态学观察,DNA凝胶电泳、DNA片段百分率,流式细胞仪分析检测白血病细胞凋亡及细胞周期。结果:乳香提取物与全反式维甲酸相似,具有诱导急性早幼粒细胞白血病细胞凋亡及作用细胞周期G1及S期(G1期细胞减少,S期细胞增多)。结论:乳香提出物是一有前途的诱导分化剂。
, 百拇医药
Inducing effect of Boswellia Carterii Birdw on apoptosis
of leukemic cells and its action on cell cycle
QI Zhen-hua
(Research Labortory of Hematology, Xiangya Haspital, Hunan
Medical University, Changsha 410008)
ZHANG Guo-ping
(Research Labortory of Hematology, Xiangya Haspital, Hunan
, http://www.100md.com
Medical University, Changsha 410008)
ZHAO Xie-lan
(Research Labortory of Hematology, Xiangya Haspital, Hunan
Medical University, Changsha 410008)
LIU Xin
(Research Labortory of Hematology, Xiangya Haspital, Hunan
Medical University, Changsha 410008)
LI Wei-hong
, http://www.100md.com
(Research Labortory of Hematology, Xiangya Haspital, Hunan
Medical University, Changsha 410008)
Abstract Objective:To explove the mechanism of BCB treating leukemia and investigate the apoptosis of leukemic cells induced by BCB.and its action on cell cycle.Methods:Apoptosis was detected by morphological observation,DNA electrophoresis.Percentage of DNA fragmentation test and flow cyto metric cell cycle analysis.Results:Resembling ATRA,BCB could induce apoptosis in APL cells and HL 60 cells and act on G1 phase and s phase of cell cycle,making G1 phage cells clecreased and 3 phage cells increased.Conclusion:BCB is an induced agent in treating APL with good outlook.
, 百拇医药
Key words Leukemia,promyelocytic,acute Resina boswelliae Cell apoptosis Cell cycle
细胞凋亡是目前研究药物作用机制的重要检测方法之一〔1〕,本研究以检测细胞凋亡为手段,探讨乳香抗白血病作用机制。
1 对象与方法
1.1 对象
急性早幼粒细胞白血病(APL)15例,为本院住院及门诊病例。男9例、女6例,年龄20~46(31.2±10.3)岁。经骨髓组织化学及融合基因确诊,APLM3a5例、M3b10例,骨髓早幼粒细胞平均0.716±0.152。
1.2 方法
, http://www.100md.com
1.2.1 HL60细胞:HL60细胞引自湖南医科大学血液生理研究室,用含150 ml/L胎牛血清、100 U.ml-1青霉素、100 μg.ml-1链霉素的RPMI 1640培养基在37 ℃ CO2饱和湿度条件下培养,取指数生长期细胞进行实验。
1.2.2 药物:乳香提取物为本院药剂科制备,采用水蒸蒸馏,除去部分挥发油,水提液过滤离心,以每ml相当的剂量计算提取物有效部分(BVL)的浓度。全反式维甲酸(All-trans retinoic acid,ATRA)上海第六制药厂产品。
1.2.3 细胞培养:以2×106.ml-1细胞浓度接种APL原代细胞及HL60细胞株细胞于新鲜RPMI 1640培养液中培养(37 ℃ 5% CO2全湿空气培养),实验时收集细胞。细胞活力要求大于85%,按细胞数2×107.ml-1,每瓶10 ml共分6组,即对照组和加药组(ATRA 1 μmol.ml-1,BVL 12.5、25.0 、50.0、100.0 μg.ml-1),培养24 h。
, 百拇医药
1.2.4 DNA凝胶电泳:经乳香提取物处理后细胞加入2 ml裂解缓冲液〔50 mmol.L-1Tris-HCL(pH7.5)100 μl,20 mmol.L-1 EDTA(pH7.5) 80 μL,加蒸馏水至2 ml,含1%NP40,37 ℃过夜,然后加入0.8 ml饱和NaCl溶液,离心2次(3000 r.min-1,6 min),合并上清液并加入终浓度20 μg.ml-1mRNA酶37 ℃孵育15 min,经二倍体积无水乙醇沉淀DNA,在15 g/L琼脂糖胶上电泳,以DNAEcoRI+Hind作相对分子量标志(1.375、957、831、564、125 bp)。
1.2.5 DNA片段百分率:APL细胞及HL60细胞按上述方法裂解完整DNA经25%三氯醋酸(TCA)沉淀后再次溶于160 μl 5%TCA中,90 ℃热解10 min,用二苯胺试剂显色,测定波长为570 nm的吸光度(A)值。按下式计算DNA片段百分率。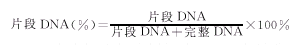
, 百拇医药
1.2.6 流式细胞仪分析细胞DNA含量分布及细胞周期:经一定浓度乳香提取物处理后骨髓细胞培养24 h,取培养后细胞0.5~1.0 ml,淋巴细胞分离液分离单个核细胞,取1×106~2×106细胞,PBS洗2次,PI一步染色在室温染色30 min,过滤流式细胞仪检测。
1.2.7 形态学观察:在电镜及光学显微镜下观察细胞形态。
1.3 统计学处理
测值用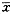 ±s表示,组间比较采用t检验。
±s表示,组间比较采用t检验。
2 结果
2.1 DNA凝胶电泳
在乳香作用下,凋亡细胞由于内源性核酸内切酶的激活,其DNA核小体之间的连接处被切断,降解呈倍数关系的DNA片段(图1)。
, 百拇医药
2.2 DNA片段百分率
乳香诱导APL细胞及HL60细胞凋亡。特异性DNA片段百分率见表1、2。
2.3 流式细胞仪分析细胞DNA含量及细胞周期
结果显示乳香作用细胞周期G1期及S期并出现凋亡细胞群(表3)。
2.4 电镜及光学显微镜下形态学变化
急性早幼粒细胞白血病细胞经乳香提取物处理后,出现典型凋亡形态特征,细胞体积缩小,胞浆浓缩、染色质凝集,核碎裂形成凋亡小体。
图1 乳香有效成分诱导原代APL细胞凋亡“梯状DNA”凝胶电泳图 1 Control; 2 Markers相对分子量标准(1375,957,831,564,125); 3 ATRA; 4 BVL
, http://www.100md.com
表1 不同浓度乳香诱导APL细胞及HL60
细胞DNA片段百分率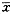 ±s BVL/(μg.ml-1)
±s BVL/(μg.ml-1)
APL细胞
HL60细胞
对照
19.0±6.5
27.2±0.5
12.5
20.1±6.2
27.9±0.4
, http://www.100md.com
25.0
20.9±6.5
28.2±0.6
50.0
30.4±7.31)
39.9±7.21)
100.0
45.6±10.32)
59.3±0.42)
与对照组比较 1)P<0.05 2)P<0.01 表2 不同药物诱导APL细胞及HL60细胞
, 百拇医药
DNA片段百分率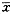 ±s 组别
±s 组别
APL细胞
HL60细胞
对照
19.0±6.5
27.2±0.5
ATRA/(1 μmol.ml-1)
43.8±18.3
48.4±0.4
BVL/(100 μg.ml-1)
, 百拇医药
45.6±10.31)
59.3±0.41)
与对照组比较 1) P<0.01表3 乳香诱导原代APL细胞凋亡及细胞周期改变 组别
G0~G1
G2~M
S
G2/G1
Apoptosis
对照
, 百拇医药 96.72±2.74
0.95±0.05
2.33±1.14
1.99±0.33
11.53
BVL/(100 μg.ml-1)
76.10±5.34
0
29.92±5.34
1.95±0.05
60.96
, 百拇医药
ATRA/(1 μmol.ml-1)
75.21±3.98
0
24.79±3.98
1.74±0.06
52.84
3 讨论
细胞凋亡是机体进化过程中生理性与坏死完全不同的另一种细胞死亡的机制〔2〕,其深入研究将有助于阐明肿瘤细胞发生发展和衰亡的全过程,为探讨抗肿瘤药物的作用机制开辟一条新途径。乳香在中医中药中作为活血化瘀药使用。经研究它又是DNA拓扑异构酶Ⅰ、Ⅱ抑制剂〔3〕。本研究证明一定剂量的乳香提取物能诱导急性早幼粒细胞重新分化〔4〕,但是经诱导分化剂使白血病细胞分化成熟,能否像正常成熟细胞凋亡,最终得到清除,是鉴定诱导分化剂治疗恶性肿瘤的一个重要问题。据文献报道〔5〕,维甲酸诱导HL60细胞凋亡,并且这种凋亡与终末分化有关。本实验结果证实,乳香提取物与全反式维甲酸相似,同样可诱导急性早幼粒细胞白血病细胞及HL60细胞分化〔6,7〕,同时也诱导凋亡。流式细胞仪检测表明,凋亡峰提前出现,峰值增高,诱导凋亡能力与维甲酸相似且作用细胞周期G1期及S期(G1期细胞减少,S期细胞增多),见表3。凝胶电泳出现“梯状DNA”,电镜及光学显微镜观察,出现典型凋亡特征,细胞体积缩小,核固缩,染色质浓集,核碎裂出芽破裂形成凋亡小体,实验表明乳香提取物是一有前途的诱导分化剂。
, http://www.100md.com
卫生部科学基金资助项目(No.94-2-076),湖南省科委重点项目〔No.01-951-28-1(5)〕
参考文献
1,戴育成.深入开展细胞凋亡的研究.中华血液学杂志,1996,17:505
2,Kerr J F B,Wintertord C M,Biol A D A,et al.Apoptosis its significance in cancer and cancer therapy.Cancer,1994,73:2013~2026
3,韩锐,主编.肿瘤化学预防及药物治疗.北京:北京医科大学,中国协和医科大学联合出版社,1991.12,47
4,Sachs L,Lotem J,Control of programmed cell death in normal and leukemic cells:now implications for therapy.Blood,1993,82:15~21
, http://www.100md.com
5,Marrin S J,Bradley J G,Cotter T G.HL60 cells induced to differentiate towards neutrophils subsequently die via apoptosis.Clin EXP Immunol,1990,79:448~453
6,齐振华,张国平,谭桂山,等.乳香提取物对急性非淋巴细胞白血病细胞诱导分化作用.湖南中医学院学报,1998,18:18~19
7,Gorczyca W,Gong J P,Barbara Ardelt,et al.The cell cycle Related differences in susceptibility of HL60 cells apoptosis induced by Various antitumor agents.Cancer Research,1993,53:3186~3192
收稿:1999-04-26
修回:1999-12-23, http://www.100md.com
单位:齐振华 (湖南医科大学湘雅医院血液研究室 长沙,410008);张国平 (湖南医科大学湘雅医院血液研究室 长沙,410008);赵谢兰 (湖南医科大学湘雅医院血液研究室 长沙,410008);柳昕 (湖南医科大学湘雅医院血液研究室 长沙,410008);李卫红 (湖南医科大学湘雅医院血液研究室 长沙,410008)
关键词:白血病;早幼粒细胞;急性;乳香;细胞凋亡;细胞周期
临床血液学杂志000312 摘要 目的:为探讨乳香抗白血病的作用机制,研究乳香诱导急性早幼粒细胞白血病细胞凋亡与细胞周期关系。方法:应用形态学观察,DNA凝胶电泳、DNA片段百分率,流式细胞仪分析检测白血病细胞凋亡及细胞周期。结果:乳香提取物与全反式维甲酸相似,具有诱导急性早幼粒细胞白血病细胞凋亡及作用细胞周期G1及S期(G1期细胞减少,S期细胞增多)。结论:乳香提出物是一有前途的诱导分化剂。
, 百拇医药
Inducing effect of Boswellia Carterii Birdw on apoptosis
of leukemic cells and its action on cell cycle
QI Zhen-hua
(Research Labortory of Hematology, Xiangya Haspital, Hunan
Medical University, Changsha 410008)
ZHANG Guo-ping
(Research Labortory of Hematology, Xiangya Haspital, Hunan
, http://www.100md.com
Medical University, Changsha 410008)
ZHAO Xie-lan
(Research Labortory of Hematology, Xiangya Haspital, Hunan
Medical University, Changsha 410008)
LIU Xin
(Research Labortory of Hematology, Xiangya Haspital, Hunan
Medical University, Changsha 410008)
LI Wei-hong
, http://www.100md.com
(Research Labortory of Hematology, Xiangya Haspital, Hunan
Medical University, Changsha 410008)
Abstract Objective:To explove the mechanism of BCB treating leukemia and investigate the apoptosis of leukemic cells induced by BCB.and its action on cell cycle.Methods:Apoptosis was detected by morphological observation,DNA electrophoresis.Percentage of DNA fragmentation test and flow cyto metric cell cycle analysis.Results:Resembling ATRA,BCB could induce apoptosis in APL cells and HL 60 cells and act on G1 phase and s phase of cell cycle,making G1 phage cells clecreased and 3 phage cells increased.Conclusion:BCB is an induced agent in treating APL with good outlook.
, 百拇医药
Key words Leukemia,promyelocytic,acute Resina boswelliae Cell apoptosis Cell cycle
细胞凋亡是目前研究药物作用机制的重要检测方法之一〔1〕,本研究以检测细胞凋亡为手段,探讨乳香抗白血病作用机制。
1 对象与方法
1.1 对象
急性早幼粒细胞白血病(APL)15例,为本院住院及门诊病例。男9例、女6例,年龄20~46(31.2±10.3)岁。经骨髓组织化学及融合基因确诊,APLM3a5例、M3b10例,骨髓早幼粒细胞平均0.716±0.152。
1.2 方法
, http://www.100md.com
1.2.1 HL60细胞:HL60细胞引自湖南医科大学血液生理研究室,用含150 ml/L胎牛血清、100 U.ml-1青霉素、100 μg.ml-1链霉素的RPMI 1640培养基在37 ℃ CO2饱和湿度条件下培养,取指数生长期细胞进行实验。
1.2.2 药物:乳香提取物为本院药剂科制备,采用水蒸蒸馏,除去部分挥发油,水提液过滤离心,以每ml相当的剂量计算提取物有效部分(BVL)的浓度。全反式维甲酸(All-trans retinoic acid,ATRA)上海第六制药厂产品。
1.2.3 细胞培养:以2×106.ml-1细胞浓度接种APL原代细胞及HL60细胞株细胞于新鲜RPMI 1640培养液中培养(37 ℃ 5% CO2全湿空气培养),实验时收集细胞。细胞活力要求大于85%,按细胞数2×107.ml-1,每瓶10 ml共分6组,即对照组和加药组(ATRA 1 μmol.ml-1,BVL 12.5、25.0 、50.0、100.0 μg.ml-1),培养24 h。
, 百拇医药
1.2.4 DNA凝胶电泳:经乳香提取物处理后细胞加入2 ml裂解缓冲液〔50 mmol.L-1Tris-HCL(pH7.5)100 μl,20 mmol.L-1 EDTA(pH7.5) 80 μL,加蒸馏水至2 ml,含1%NP40,37 ℃过夜,然后加入0.8 ml饱和NaCl溶液,离心2次(3000 r.min-1,6 min),合并上清液并加入终浓度20 μg.ml-1mRNA酶37 ℃孵育15 min,经二倍体积无水乙醇沉淀DNA,在15 g/L琼脂糖胶上电泳,以DNAEcoRI+Hind作相对分子量标志(1.375、957、831、564、125 bp)。
1.2.5 DNA片段百分率:APL细胞及HL60细胞按上述方法裂解完整DNA经25%三氯醋酸(TCA)沉淀后再次溶于160 μl 5%TCA中,90 ℃热解10 min,用二苯胺试剂显色,测定波长为570 nm的吸光度(A)值。按下式计算DNA片段百分率。
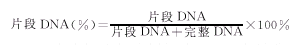
, 百拇医药
1.2.6 流式细胞仪分析细胞DNA含量分布及细胞周期:经一定浓度乳香提取物处理后骨髓细胞培养24 h,取培养后细胞0.5~1.0 ml,淋巴细胞分离液分离单个核细胞,取1×106~2×106细胞,PBS洗2次,PI一步染色在室温染色30 min,过滤流式细胞仪检测。
1.2.7 形态学观察:在电镜及光学显微镜下观察细胞形态。
1.3 统计学处理
测值用
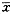 ±s表示,组间比较采用t检验。
±s表示,组间比较采用t检验。2 结果
2.1 DNA凝胶电泳
在乳香作用下,凋亡细胞由于内源性核酸内切酶的激活,其DNA核小体之间的连接处被切断,降解呈倍数关系的DNA片段(图1)。
, 百拇医药
2.2 DNA片段百分率
乳香诱导APL细胞及HL60细胞凋亡。特异性DNA片段百分率见表1、2。
2.3 流式细胞仪分析细胞DNA含量及细胞周期
结果显示乳香作用细胞周期G1期及S期并出现凋亡细胞群(表3)。
2.4 电镜及光学显微镜下形态学变化
急性早幼粒细胞白血病细胞经乳香提取物处理后,出现典型凋亡形态特征,细胞体积缩小,胞浆浓缩、染色质凝集,核碎裂形成凋亡小体。

图1 乳香有效成分诱导原代APL细胞凋亡“梯状DNA”凝胶电泳图 1 Control; 2 Markers相对分子量标准(1375,957,831,564,125); 3 ATRA; 4 BVL
, http://www.100md.com
表1 不同浓度乳香诱导APL细胞及HL60
细胞DNA片段百分率
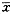 ±s BVL/(μg.ml-1)
±s BVL/(μg.ml-1)APL细胞
HL60细胞
对照
19.0±6.5
27.2±0.5
12.5
20.1±6.2
27.9±0.4
, http://www.100md.com
25.0
20.9±6.5
28.2±0.6
50.0
30.4±7.31)
39.9±7.21)
100.0
45.6±10.32)
59.3±0.42)
与对照组比较 1)P<0.05 2)P<0.01 表2 不同药物诱导APL细胞及HL60细胞
, 百拇医药
DNA片段百分率
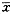 ±s 组别
±s 组别APL细胞
HL60细胞
对照
19.0±6.5
27.2±0.5
ATRA/(1 μmol.ml-1)
43.8±18.3
48.4±0.4
BVL/(100 μg.ml-1)
, 百拇医药
45.6±10.31)
59.3±0.41)
与对照组比较 1) P<0.01表3 乳香诱导原代APL细胞凋亡及细胞周期改变 组别
G0~G1
G2~M
S
G2/G1
Apoptosis
对照
, 百拇医药 96.72±2.74
0.95±0.05
2.33±1.14
1.99±0.33
11.53
BVL/(100 μg.ml-1)
76.10±5.34
0
29.92±5.34
1.95±0.05
60.96
, 百拇医药
ATRA/(1 μmol.ml-1)
75.21±3.98
0
24.79±3.98
1.74±0.06
52.84
3 讨论
细胞凋亡是机体进化过程中生理性与坏死完全不同的另一种细胞死亡的机制〔2〕,其深入研究将有助于阐明肿瘤细胞发生发展和衰亡的全过程,为探讨抗肿瘤药物的作用机制开辟一条新途径。乳香在中医中药中作为活血化瘀药使用。经研究它又是DNA拓扑异构酶Ⅰ、Ⅱ抑制剂〔3〕。本研究证明一定剂量的乳香提取物能诱导急性早幼粒细胞重新分化〔4〕,但是经诱导分化剂使白血病细胞分化成熟,能否像正常成熟细胞凋亡,最终得到清除,是鉴定诱导分化剂治疗恶性肿瘤的一个重要问题。据文献报道〔5〕,维甲酸诱导HL60细胞凋亡,并且这种凋亡与终末分化有关。本实验结果证实,乳香提取物与全反式维甲酸相似,同样可诱导急性早幼粒细胞白血病细胞及HL60细胞分化〔6,7〕,同时也诱导凋亡。流式细胞仪检测表明,凋亡峰提前出现,峰值增高,诱导凋亡能力与维甲酸相似且作用细胞周期G1期及S期(G1期细胞减少,S期细胞增多),见表3。凝胶电泳出现“梯状DNA”,电镜及光学显微镜观察,出现典型凋亡特征,细胞体积缩小,核固缩,染色质浓集,核碎裂出芽破裂形成凋亡小体,实验表明乳香提取物是一有前途的诱导分化剂。
, http://www.100md.com
卫生部科学基金资助项目(No.94-2-076),湖南省科委重点项目〔No.01-951-28-1(5)〕
参考文献
1,戴育成.深入开展细胞凋亡的研究.中华血液学杂志,1996,17:505
2,Kerr J F B,Wintertord C M,Biol A D A,et al.Apoptosis its significance in cancer and cancer therapy.Cancer,1994,73:2013~2026
3,韩锐,主编.肿瘤化学预防及药物治疗.北京:北京医科大学,中国协和医科大学联合出版社,1991.12,47
4,Sachs L,Lotem J,Control of programmed cell death in normal and leukemic cells:now implications for therapy.Blood,1993,82:15~21
, http://www.100md.com
5,Marrin S J,Bradley J G,Cotter T G.HL60 cells induced to differentiate towards neutrophils subsequently die via apoptosis.Clin EXP Immunol,1990,79:448~453
6,齐振华,张国平,谭桂山,等.乳香提取物对急性非淋巴细胞白血病细胞诱导分化作用.湖南中医学院学报,1998,18:18~19
7,Gorczyca W,Gong J P,Barbara Ardelt,et al.The cell cycle Related differences in susceptibility of HL60 cells apoptosis induced by Various antitumor agents.Cancer Research,1993,53:3186~3192
收稿:1999-04-26
修回:1999-12-23, http://www.100md.com