侧脑室注射IL-1β、IL-1ra对癫痫大鼠脑皮层、海马Fos蛋白表达的影响
作者:王玉 阮旭中 何小华
单位:(同济医科大学附属同济医院神经科,武汉 430030)
关键词:大鼠;癫痫;白细胞介素-1β;白细胞介素-1受体拮抗剂;Fos蛋白
中国神经免疫学和神经病学杂志000103 摘要:目的 了解外源性和内源性白细胞介素-1(IL-1)对戊四氮(PTZ)致痫大鼠脑皮层、海马神经元兴奋性的影响。方法 应用流式细胞免疫荧光技术对大鼠大脑皮层、海马Fos表达进行定量分析。结果 IL-1β和IL-1ra侧脑室注射后再致痫大鼠分别较单纯PTZ致痫大鼠皮层海马Fos表达显著增高和下降(P<0.01,P<0.05)。结论 内源性和外源性IL-1β均有增高癫痫大鼠脑皮层及海马神经元兴奋性的作用。
中图分类号:R332;R742.1;R979.5 文献标识码:A
, 百拇医药
文章编号:1006-2963(2000)01-011-04
Effect of Interleukin-1β and Interleukin-1 Receptor
Antagonist on the Expression of Fos Protein in Cortex
and Hippocampus in Pentylenetetrazol Treated Rats
WANG Yu, RUAN Xu-zhong, HE Xiao-hua
(Department of Neurology, Tongji Hospital, Tongji Medical University, Wuhan 430030, China)
, 百拇医药
ABSTRACT:Objective To observe the effect of exogenous and endogenous interleukin-1 (IL-1) on the neuronal excitability of cortex and hippocampus in PTZ induced epileptic seizure rats. Methods Cortical and hippocampal Fos protein was quantitatively measured by means of Flowcytometry. Results The cortical and hippocampal expression of Fos was higher in PTZ induced seizure rats priorily injected lateral ventricaly with IL-1β than in PTZ induced seizure rats without IL-1β,which reversed for the rats priorily injected with IL-1ra (P<0.01,P<0.05).Conclusion Both exogenous IL-1β and endogenous IL-1 can increase the neuronal excitability of the cortex and the hippocampus in epileptic rats.
, http://www.100md.com
Key words:rat; epilepsy; interleukin-1β; interteukin-1 receptor antagonist; Fos
神经-免疫-内分泌系统之间存在复杂的网络调控机制,白细胞介素(IL-1)作为一种重要的细胞因子,在中枢神经系统中通过脑内广泛存在的IL-1受体参与该网络的调控,在多种生理和病理机制中发挥着重要作用[1]。Fos作为神经元激活的标志已被广泛采用,其表达程度与痫性发作的强度密切相关[2]。本文报道通过应用流式细胞免疫荧光技术对戊四氮(PTZ)致痫及分别应用IL-1β和IL-1受体拮抗剂(IL-1ra)后再致痫大鼠大脑皮层、海马Fos表达进行定量分析,旨在了解IL-1β在癫痫发作中的作用。
1 材料和方法
1.1 动物分组及处理 健康成年Wistar大鼠32只(同济医科大学实验动物中心提供),雌雄兼用,体重180~220 g,取脑前1周单笼、避强光、避噪音条件下饲养。动物随机分成4组,每组8只。①空白对照组:侧脑室注射5μL生理盐水;②PTZ组:侧脑室注射5μL生理盐水后30 min腹腔注射(ip) PTZ 60 mg/kg(PTZ,Sigma公司,溶于生理盐水中配成10 g/L浓度)致痫;③IL-1β+PTZ组:IL-1β 500U(IL-1β,Sigma公司,ip溶于5μL生理盐水中)侧脑室注射后30 min, PTZ 60 mg/kg ip,致痫;④IL-1ra+PTZ组:IL-1ra 5μg(IL-1ra, 北京原平公司,溶于5μL生理盐水中)侧脑室注射后30 min PTZ 60 mg/kg ip,致痫。所有动物致痫后2 h快速断头取脑,分离注射侧额叶皮层和海马,立即置于4℃ 70%(体积分数)乙醇中待测,10天(d) 内完成。
, 百拇医药
1.2 Fos蛋白免疫荧光染色样品制备 将皮质和海马标本用网搓法制备单细胞悬液,采用间接免疫荧光法,将106/mL细胞用PBS洗涤3次,每次2 min,1000 r/min离心弃上清。加入1∶100稀释的兔抗Fos多抗(Santa Cruz公司)。37℃孵育30 min,加入1∶50羊抗兔IgG(武汉博士德生物工程公司)100μL。上述每步骤间均给PBS充分洗涤后离心弃上清。上机前加入10 mL PBS,经400目筛网过滤后,上机检测。
1.3 流式细胞检测方法 采用FACS420型流式细胞仪(美国BD公司)。520 nm的带通滤片用于荧光检测。应用BD流式细胞学软件进行资料处理。
1.4 测量指标和分析方法 以荧光指数(FI)表示Fos表达的相对含量,FI=[样品细胞Fos表达的平均荧光强度-对照样品的平均荧光强度]÷正常对照样品细胞Fos表达的平均荧光强度。Fos阳性细胞计数为每1万个细胞中的Fos阳性细胞数。
, 百拇医药
1.5 统计学处理 采用方差分析和q检验。
2 结果
PTZ致痫组大鼠皮层、海马Fos 表达的 FI 及阳性细胞数较空白对照组显著增加 (P均<0.01)。 IL-1β 侧脑室注射后再致痫组则 Fos 表达更高, 较单纯 PTZ 致痫组显著增加 (P<0.01, P<0.05)。 而 IL-1ra 处理后致痫组 Fos 表达较单纯 PTZ 致痫明显下降 (P<0.01,P<0.05)(附表)。附表 4组大鼠大脑皮层、海马Fos表达的比较
Table Comparison of cortical and hippocampal Fos expression in rats of 4 groups(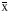 ±s) Group
±s) Group
n
, http://www.100md.com
Cortex
Hippocampus
FI
Positive cell
FI
Positive cell
Control
8
1.00±0.04
1052±218
1.00±0.03
2013±432
, http://www.100md.com
PTZ
8
1.25±0.03**
2271±254**
1.24±0.06**
3154±457**
IL-1β+PTZ
8
1.33±0.06△△
2557±278△
, http://www.100md.com 1.34±0.07△△
3820±428△△
IL-1ra+PTZ
8
1.05±0.07△△
2021±203△
1.07±0.06△△
2205±446△
**P<0.01 compared with control group; △P<0.05,△△P<0.01 compared with PTZ group
, 百拇医药
3 讨论
原癌基因c-fos及其表达产物Fos蛋白在神经元活动时表达活跃,被广泛用作神经元兴奋的标志物[3]。多种药物或电刺激诱发的癫痫模型中,惊厥发作皆可诱导脑内Fos的表达。因此可以利用癫痫模型,以Fos为指标研究某些致痫剂或抗痫剂的作用机制或药理学特性。
本实验发现,PTZ致痫大鼠皮层、海马细胞核内Fos大量表达:IL-1β侧脑室注射后再致痫Fos表达则进一步增高,而IL-1ra则对PTZ致痫后大鼠皮层、海马Fos表达有明显抑制作用。说明内源性和外源性IL-1β均有增高皮层、海马神经元的兴奋性作用,此与我们的脑电观察结果一致。致痫剂海人酸(KA)、PTZ致痫大鼠及听源性惊厥易感大鼠脑内IL-1均快速表达增高[4,5],并且在癫痫患者脑脊液中也观察到IL-1的增高[6]。提示IL-1可能在癫痫脑保持长期兴奋性增高状态中起着一定作用。Fos和Jun作为细胞内第三信使,形成异源二聚体作用于靶基因调控序列中的AP-1位点,调节后继以特异靶基因的表达[7],从而改变癫痫脑神经元的表型,如上调谷氨酸(Glu)受体N-甲基-D-天门冬氨酸受体(NMDAR)的表达,以及促进海马兴奋性突触回路的形成,有利于癫痫脑兴奋性易感性长期增高的形成和维持[8]。IL-1ra可抑制癫痫大鼠脑内Fos的表达,但是否有助于减缓癫痫脑兴奋性易感性长期增高的形成有待进一步探讨。
, 百拇医药
IL-1β在中枢神经系统中,还具有镇静催眠作用[9]。本实验中也观察到IL-1β侧脑室注射具有明显的镇静作用,表现为大鼠安静、伏卧以及麻醉苏醒时间的延长,但却促进大鼠惊厥发作和痫波发放。这可能与IL-1β对脑电的高度同步化效应有关[9]。癫痫脑痫性放电的电生理基础正是大量神经元的同步化放电。
IL-1β在脑内的各种作用是通过IL-1受体发挥的,本实验中IL-1ra抑制IL-1β对癫痫脑内Fos表达的促进作用也进一步证明此点,但IL-1β与受体结合后改变Fos表达的进一步细胞内机制仍不清楚,有待进一步探讨。
基金项目:国家自然科学基金资助项目(39330210)
作者简介:王玉(1970年生),男,安徽省合肥市人,博士,主治医师,主要从事癫痫发病机制研究。
参考文献:
, 百拇医药
[1] Rothwell NJ, Hopkins SJ. Cytokines and the nervous system II: actions and mechanisms of action[J]. TINS, 1995,18(3):130-136.
[2] Motte JE, da silva Fernandel MJ, Marescaux C, et al. Effects of pentylenetetrazol-induced status epilepticus on c-Fos and HSP72 immunoreactivity in the immature rat brain[J]. Mol Brain Res, 1997, 50:79-84.
[3] Bullit E. Expression of c-Fos-like protein as a marker for neuronal activity following noxious stimulation in the rat[J]. J Comp Neurol, 1997, 296:517.
, 百拇医药
[4] Masabumi M, Yasushi K, Takashi. Convulsants induced interleukin-1β messenger RNA in rat brain[J]. Biochem Biophys Res Commun, 1990,171:832-837.
[5] Xi-Ru W, Guo-Rong Z. Study about the relationship between IL-1 and the pathogenesis of epilepsies[J]. Epilepsia, 1997, 38(supple 3):191.
[6] Hopkins SJ, Rothwell NJ. Cytokines in the nervous system I:expression and recognition[J]. TINS, 1995, 18:83-88.
, 百拇医药
[7] Morgan JI, Curran T. Immediate-early gene: ten years on[J]. TINS, 1995, 18:66.
[8] Watanabe Y, Johnson RS, Butler LS, et al. Null mutation of c-Fos impairs structural and functional plasticities in the kindling model of epilepsy[J]. J Neurosci, 1996,16:3827-3836.
[9] Kapas L, Shibata M, Kinmura M, et al. Inhibition of nitric oxide synthesis supresses sleep in rabbits[J]. Am J Physiol, 1994 260:R151-R157.
收稿日期:1999-02-03
修稿日期:1999-06-02, http://www.100md.com
单位:(同济医科大学附属同济医院神经科,武汉 430030)
关键词:大鼠;癫痫;白细胞介素-1β;白细胞介素-1受体拮抗剂;Fos蛋白
中国神经免疫学和神经病学杂志000103 摘要:目的 了解外源性和内源性白细胞介素-1(IL-1)对戊四氮(PTZ)致痫大鼠脑皮层、海马神经元兴奋性的影响。方法 应用流式细胞免疫荧光技术对大鼠大脑皮层、海马Fos表达进行定量分析。结果 IL-1β和IL-1ra侧脑室注射后再致痫大鼠分别较单纯PTZ致痫大鼠皮层海马Fos表达显著增高和下降(P<0.01,P<0.05)。结论 内源性和外源性IL-1β均有增高癫痫大鼠脑皮层及海马神经元兴奋性的作用。
中图分类号:R332;R742.1;R979.5 文献标识码:A
, 百拇医药
文章编号:1006-2963(2000)01-011-04
Effect of Interleukin-1β and Interleukin-1 Receptor
Antagonist on the Expression of Fos Protein in Cortex
and Hippocampus in Pentylenetetrazol Treated Rats
WANG Yu, RUAN Xu-zhong, HE Xiao-hua
(Department of Neurology, Tongji Hospital, Tongji Medical University, Wuhan 430030, China)
, 百拇医药
ABSTRACT:Objective To observe the effect of exogenous and endogenous interleukin-1 (IL-1) on the neuronal excitability of cortex and hippocampus in PTZ induced epileptic seizure rats. Methods Cortical and hippocampal Fos protein was quantitatively measured by means of Flowcytometry. Results The cortical and hippocampal expression of Fos was higher in PTZ induced seizure rats priorily injected lateral ventricaly with IL-1β than in PTZ induced seizure rats without IL-1β,which reversed for the rats priorily injected with IL-1ra (P<0.01,P<0.05).Conclusion Both exogenous IL-1β and endogenous IL-1 can increase the neuronal excitability of the cortex and the hippocampus in epileptic rats.
, http://www.100md.com
Key words:rat; epilepsy; interleukin-1β; interteukin-1 receptor antagonist; Fos
神经-免疫-内分泌系统之间存在复杂的网络调控机制,白细胞介素(IL-1)作为一种重要的细胞因子,在中枢神经系统中通过脑内广泛存在的IL-1受体参与该网络的调控,在多种生理和病理机制中发挥着重要作用[1]。Fos作为神经元激活的标志已被广泛采用,其表达程度与痫性发作的强度密切相关[2]。本文报道通过应用流式细胞免疫荧光技术对戊四氮(PTZ)致痫及分别应用IL-1β和IL-1受体拮抗剂(IL-1ra)后再致痫大鼠大脑皮层、海马Fos表达进行定量分析,旨在了解IL-1β在癫痫发作中的作用。
1 材料和方法
1.1 动物分组及处理 健康成年Wistar大鼠32只(同济医科大学实验动物中心提供),雌雄兼用,体重180~220 g,取脑前1周单笼、避强光、避噪音条件下饲养。动物随机分成4组,每组8只。①空白对照组:侧脑室注射5μL生理盐水;②PTZ组:侧脑室注射5μL生理盐水后30 min腹腔注射(ip) PTZ 60 mg/kg(PTZ,Sigma公司,溶于生理盐水中配成10 g/L浓度)致痫;③IL-1β+PTZ组:IL-1β 500U(IL-1β,Sigma公司,ip溶于5μL生理盐水中)侧脑室注射后30 min, PTZ 60 mg/kg ip,致痫;④IL-1ra+PTZ组:IL-1ra 5μg(IL-1ra, 北京原平公司,溶于5μL生理盐水中)侧脑室注射后30 min PTZ 60 mg/kg ip,致痫。所有动物致痫后2 h快速断头取脑,分离注射侧额叶皮层和海马,立即置于4℃ 70%(体积分数)乙醇中待测,10天(d) 内完成。
, 百拇医药
1.2 Fos蛋白免疫荧光染色样品制备 将皮质和海马标本用网搓法制备单细胞悬液,采用间接免疫荧光法,将106/mL细胞用PBS洗涤3次,每次2 min,1000 r/min离心弃上清。加入1∶100稀释的兔抗Fos多抗(Santa Cruz公司)。37℃孵育30 min,加入1∶50羊抗兔IgG(武汉博士德生物工程公司)100μL。上述每步骤间均给PBS充分洗涤后离心弃上清。上机前加入10 mL PBS,经400目筛网过滤后,上机检测。
1.3 流式细胞检测方法 采用FACS420型流式细胞仪(美国BD公司)。520 nm的带通滤片用于荧光检测。应用BD流式细胞学软件进行资料处理。
1.4 测量指标和分析方法 以荧光指数(FI)表示Fos表达的相对含量,FI=[样品细胞Fos表达的平均荧光强度-对照样品的平均荧光强度]÷正常对照样品细胞Fos表达的平均荧光强度。Fos阳性细胞计数为每1万个细胞中的Fos阳性细胞数。
, 百拇医药
1.5 统计学处理 采用方差分析和q检验。
2 结果
PTZ致痫组大鼠皮层、海马Fos 表达的 FI 及阳性细胞数较空白对照组显著增加 (P均<0.01)。 IL-1β 侧脑室注射后再致痫组则 Fos 表达更高, 较单纯 PTZ 致痫组显著增加 (P<0.01, P<0.05)。 而 IL-1ra 处理后致痫组 Fos 表达较单纯 PTZ 致痫明显下降 (P<0.01,P<0.05)(附表)。附表 4组大鼠大脑皮层、海马Fos表达的比较
Table Comparison of cortical and hippocampal Fos expression in rats of 4 groups(
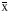 ±s) Group
±s) Groupn
, http://www.100md.com
Cortex
Hippocampus
FI
Positive cell
FI
Positive cell
Control
8
1.00±0.04
1052±218
1.00±0.03
2013±432
, http://www.100md.com
PTZ
8
1.25±0.03**
2271±254**
1.24±0.06**
3154±457**
IL-1β+PTZ
8
1.33±0.06△△
2557±278△
, http://www.100md.com 1.34±0.07△△
3820±428△△
IL-1ra+PTZ
8
1.05±0.07△△
2021±203△
1.07±0.06△△
2205±446△
**P<0.01 compared with control group; △P<0.05,△△P<0.01 compared with PTZ group
, 百拇医药
3 讨论
原癌基因c-fos及其表达产物Fos蛋白在神经元活动时表达活跃,被广泛用作神经元兴奋的标志物[3]。多种药物或电刺激诱发的癫痫模型中,惊厥发作皆可诱导脑内Fos的表达。因此可以利用癫痫模型,以Fos为指标研究某些致痫剂或抗痫剂的作用机制或药理学特性。
本实验发现,PTZ致痫大鼠皮层、海马细胞核内Fos大量表达:IL-1β侧脑室注射后再致痫Fos表达则进一步增高,而IL-1ra则对PTZ致痫后大鼠皮层、海马Fos表达有明显抑制作用。说明内源性和外源性IL-1β均有增高皮层、海马神经元的兴奋性作用,此与我们的脑电观察结果一致。致痫剂海人酸(KA)、PTZ致痫大鼠及听源性惊厥易感大鼠脑内IL-1均快速表达增高[4,5],并且在癫痫患者脑脊液中也观察到IL-1的增高[6]。提示IL-1可能在癫痫脑保持长期兴奋性增高状态中起着一定作用。Fos和Jun作为细胞内第三信使,形成异源二聚体作用于靶基因调控序列中的AP-1位点,调节后继以特异靶基因的表达[7],从而改变癫痫脑神经元的表型,如上调谷氨酸(Glu)受体N-甲基-D-天门冬氨酸受体(NMDAR)的表达,以及促进海马兴奋性突触回路的形成,有利于癫痫脑兴奋性易感性长期增高的形成和维持[8]。IL-1ra可抑制癫痫大鼠脑内Fos的表达,但是否有助于减缓癫痫脑兴奋性易感性长期增高的形成有待进一步探讨。
, 百拇医药
IL-1β在中枢神经系统中,还具有镇静催眠作用[9]。本实验中也观察到IL-1β侧脑室注射具有明显的镇静作用,表现为大鼠安静、伏卧以及麻醉苏醒时间的延长,但却促进大鼠惊厥发作和痫波发放。这可能与IL-1β对脑电的高度同步化效应有关[9]。癫痫脑痫性放电的电生理基础正是大量神经元的同步化放电。
IL-1β在脑内的各种作用是通过IL-1受体发挥的,本实验中IL-1ra抑制IL-1β对癫痫脑内Fos表达的促进作用也进一步证明此点,但IL-1β与受体结合后改变Fos表达的进一步细胞内机制仍不清楚,有待进一步探讨。
基金项目:国家自然科学基金资助项目(39330210)
作者简介:王玉(1970年生),男,安徽省合肥市人,博士,主治医师,主要从事癫痫发病机制研究。
参考文献:
, 百拇医药
[1] Rothwell NJ, Hopkins SJ. Cytokines and the nervous system II: actions and mechanisms of action[J]. TINS, 1995,18(3):130-136.
[2] Motte JE, da silva Fernandel MJ, Marescaux C, et al. Effects of pentylenetetrazol-induced status epilepticus on c-Fos and HSP72 immunoreactivity in the immature rat brain[J]. Mol Brain Res, 1997, 50:79-84.
[3] Bullit E. Expression of c-Fos-like protein as a marker for neuronal activity following noxious stimulation in the rat[J]. J Comp Neurol, 1997, 296:517.
, 百拇医药
[4] Masabumi M, Yasushi K, Takashi. Convulsants induced interleukin-1β messenger RNA in rat brain[J]. Biochem Biophys Res Commun, 1990,171:832-837.
[5] Xi-Ru W, Guo-Rong Z. Study about the relationship between IL-1 and the pathogenesis of epilepsies[J]. Epilepsia, 1997, 38(supple 3):191.
[6] Hopkins SJ, Rothwell NJ. Cytokines in the nervous system I:expression and recognition[J]. TINS, 1995, 18:83-88.
, 百拇医药
[7] Morgan JI, Curran T. Immediate-early gene: ten years on[J]. TINS, 1995, 18:66.
[8] Watanabe Y, Johnson RS, Butler LS, et al. Null mutation of c-Fos impairs structural and functional plasticities in the kindling model of epilepsy[J]. J Neurosci, 1996,16:3827-3836.
[9] Kapas L, Shibata M, Kinmura M, et al. Inhibition of nitric oxide synthesis supresses sleep in rabbits[J]. Am J Physiol, 1994 260:R151-R157.
收稿日期:1999-02-03
修稿日期:1999-06-02, http://www.100md.com