大鼠小肠肌间神经丛中NOS神经元的发育研究
作者:肖 岚 蔡文琴
单位:第三军医大学组织学胚胎学教研室,重庆 400038
关键词:一氧化氮合酶(NOS);NADPH-黄递酶;肌间神经丛;发育;大鼠
解剖学报980320 摘 要 为研究大鼠小肠肌间神经丛NOS神经元的发育,用NADPH-黄递酶组织化学法及图像分析对胚胎至老年各时期小肠肌间神经丛的NOS神经元发生进行观察。结果显示:NOS神经元于E13d出现,但极稀少,之后逐渐增多,其密度(细胞数/面积)至出生后1周达到高峰,以后逐渐下降,至成年到最低值,直至老年无明显改变;NOS神经元胞体大小逐渐增加,至成年时最大,约为出生时的2倍,直至老年无明显改变;NOS神经元分布,胚胎初为无规律散在排列,大约在出生后1周聚集成明显的神经节。本研究揭示了小肠肌间神经丛NOS神经元的发育变化规律。
一氧化氮(NO)是近年来发现的一种特殊的信使分子,在神经系统中充当神经递质或调质,其内源合成由专一的一氧化氮合酶(NOS)催化L-ARG生成,NOS广泛分布于多种组织,神经组织中的NOS已被证明就是NADPH-黄递酶(NDP),因此,NDP被作为神经元NOS的组织化学标志物而应用于NOS的定位研究[1]。研究表明,小肠肌间神经丛中有较多的NOS神经元分布[2]。其作用主要是释放NO后,通过使胃肠平滑肌细胞中cGMP升高而使平滑肌舒张。由于胃肠道NOS神经元的缺如或发育不良所致的NO缺乏常与胃肠肌肉运动失驰缓疾病如进行性胃扩张、婴儿幽门狭窄、先天性巨结肠等有关[3]。因此,研究肠道NOS神经元的发育,不仅能为发育神经生物学提供基础资料,而且对临床的某些疾病的发病机制及病理生理学提供依据。这方面研究国外报道极少,国内尚未见同类报道。为此,本研究的目的主要是对胚胎至老年大鼠小肠(空肠)肌间神经丛中 NOS神经元的发育及其与年龄相关的变化进行观察,并通过图像分析处理,以探求小肠壁内NOS神经元的发育规律。
, http://www.100md.com
材料和方法
1.动物分组
Wistar大鼠52只(雌雄不拘),以胚胎期及出生后两阶段进行分组,胚胎期按胎龄(阴栓龄)分4组:E13、E16、E18、E19 d,每组5例;出生后分新生期:0~2d、1周、2周各5例;幼年期(1月)5例;成年期(4~8月)8例;老年期(24~26月)4例。
2.取材及标本制作
将胚鼠取出放入4%多聚甲醛,0.1mol/L PB液(pH7.3)中稍许固定后用钟表镊轻轻剥离出小肠前段放入上述固定液中,于4℃固定2h后移入0.05mol/L的TBS(pH7.4)中,于4℃再放置3~5h,切取部分作恒冷箱冰冻切片(横切面,厚20μm),贴片,其余留作整封染色。新生组大鼠取空肠约2cm,用一适当口径的玻棒伸入腔中使肠壁扩张,作成整封肠管后入4%多聚甲醛中固定2h,再移入TBS,于4℃放置3~5h至染色。其余大鼠则取空肠约3~5cm经4%多聚甲醛固定2h后分离纵肌层行肠肌层铺片,将所得撕片置入TBS中2~4h至染色。
, 百拇医药
3.DNP组织化学染色
参照伦敦大学Burnstock实验室的方法配制作用液:0.2g/L NBT,2.7g/L L-苹果酸,1.0g/L β-NADPH(以上试剂均购于Sigma公司),0.1% Triton X-100,0.1mol/L Tris HCl(pH7.6)。将所制标本用含0.1%Triton X-100的TBS充分漂洗后入作用液中于37℃孵育15~30min后用TBS终止反应,胚胎及新生大鼠整封染色肠管可放入4%多聚甲醛中4℃下长期保存。新生大鼠染色后的整封肠管还可行纵肌层铺片,连同其余染色后的铺片及切片标本经乙醇逐级脱水、二甲苯透明、DPX封固后观察。
4.图像分析及统计学处理
利用大恒公司的颗粒形状分析系统软件在监视器下对各组标本进行图像采集、预处理、颗粒分割、修补、二值化,最后设置阈值对图像中的NOS阳性神经元扫描测量,参考Cracco[4]的方法,以图像中颗粒的面积来表示NOS神经元胞体的大小,以单位面积中颗粒数来表示NOS神经元的密度,求出各个NOS阳性细胞的大小、密度及核/浆比。每张铺片标本随机任采集3~5个视野进行分析。
, 百拇医药
结果进行单因素方差分析,检验组间差异。
结 果
1.胚胎期NOS神经元的发育
NOS阳性神经元偶见于E13d鼠胚肠壁上,常单个散在,核/浆比大于1,突起短小,甚至不清楚(图1);E16d,肠壁上可见NOS阳性神经元三五成群散在无规律的排布,细胞形态较为清楚,突起增多;到E18、E19d,小肠壁上NOS神经元密度增高,呈现与肠管纵轴垂直的、形如垂帘般的排列趋势,神经元稍有增大,但核/浆比仍较大。可见神经元突起相互交连,未见明显的神经节及节间束(图2)。
2.出生后NOS神经元的发育
新生0~2d大鼠小肠肌间神经丛中的NOS神经元增大、胞浆增多、突起增长、增粗、相互交织;神经元数目也较胚胎期增多,呈垂帘般的排布更趋规律,局部可见神经节的形成,但不够明显(图3);出生后1周,可见NOS神经元密集排列,神经节及节间束均较明显,交织成网格状(图4);出生后2周,神经节增大且更加明显,节间束增粗,但NOS神经元密集度有所下降(图5);生后1月,可见NOS神经元增大明显,核/浆比进一步减小,而神经元密集度进一步下降;至成年,神经节及NOS神经元进一步增大、节间束粗大、阳性纤维密集,但NOS神经元密度更稀(图6,8);老年组大鼠,肌间神经丛网格形态、NOS神经元大小、形态及密度均与成年组相似(图7)。
, 百拇医药
3.图像分析及统计结果
从附表中可看出,NOS神经元胞体大小从出生到成年几乎增加2倍,尤以生后1月时增加最显著。NOS神经元的密度先上升至1周时达顶峰后又下降至成年到最低,约下降了6倍,此后一直稳定至老年(图9)。
讨 论
本实验用肠道整封染色技术,首次显示了NOS神经元在胚胎及新生大鼠小肠肌间神经丛分布的全貌,使观察更直观、全面。除此,本实验得出了关于小肠壁内NOS神经元发育过程中有趣的变化规律:NOS神经元自出现后逐渐增大、增多、核/浆比减少,排列由无序到规律。NOS神经元胞体大小至成年达最高值并稳定直到老年;NOS神经元密度峰值在出生后1周左右,然后逐渐下降,到成年降到最低并稳定直到成年。
以往研究表明,在鸟类及啮齿类动物胚胎期,肠道神经系统中含不同的神经递质的神经元依一定顺序出现,如胆碱能神经元及5-HT类神经元在E12d小鼠消化道中出现,而肽能神经递质如
, 百拇医药
SP、VIP则稍晚,约E14d出现,CGRP则更晚,约E18d才出现,这一顺序与神经嵴细胞向肠道迁移途中或到位后的局部微环境有关[5,6]。在E13d的大鼠胚胎肠壁中,我们检出了NOS阳性神经元,这与Branchek[5]等检出的小鼠肠道NDP阳性神经元的出现时间(胃E12d,前段肠管E13d)基本一致,说明NOS神经元的出现并不比胆碱能神经元及5-HT等小分子神经递质发生晚,其发生不受乙酰胆碱或5-HT等神经递质的影响。从出生至成年肠道肌间神经元的发育变化,Gabella[7]通过对大鼠的观察得出如下规律:神经元增大,神经元密度下降。我们对大鼠小肠肌间NOS神经元观察的结果基本符合这一规律。而且我们还观察到NOS神经元的密度高峰在出生后1周左右,大约为成年时的6倍。这一现象在肠道肌间神经元发育中是否具有普遍性或仅仅是NOS神经元发育所特有,目前尚未见类似报道。我们推测这可能是刚出生这一周内,由于食物的刺激,局部微环境的根本变化促使NOS神经元急剧增多、聚集以适应胃肠道消化功能刚建立的需要。至于NOS神经元数目如何增加,目前尚不清楚,有作者推测可能有细胞分裂增殖或一些阴性细胞在发育中产生了NOS的表达[8]。随着肠管的发育增长,肠壁内NOS神经元也会不断增多、成熟、功能健全,而其增长速度则会越来越慢于肠壁肌肉的快速增长,这势必导致NOS神经元密度的相对下降。关于肠道肌间神经元大小变化与肠管大小呈正相关,而神经元密度变化则与肠管大小呈负相关这一点,Gabella[9]已报道过。另外,NOS神经元密度的下降也不能排除过量增殖的神经元在发育中未能获取足够的由靶细胞产生的对维系其存活必需的信号物质,如神经营养因子而造成的神经元程序性死亡的可能。附表 NOS神经元形态测量结果
, 百拇医药
Table Quantitation of NOS-positive neurons 组别
group
胞体大小(μm2)
somatic size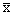 ±s
±s
密度(细胞数/mm2)
density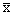 ±s
±s
核/浆比
N/P
, http://www.100md.com E13
39±6
1∶1.1
E16
59±9
1∶1.4
E18
62±7
1∶1.4
0~2d
115±22
180±24
1∶1.4
, http://www.100md.com
1周(w)
121±20
278±43
1∶1.6
2周(w)
164±20
160±12
1∶1.6
1月(m)
230±28
83±20
1∶1.7
3~6月(m)
, 百拇医药
302±28#
38±5#
1∶2.4
24~26月(m)
288±37##
34±4##
1∶2.4
除*与**,*与***,**与***,#与##间无显著差异外,其余各组间均相差显著(P<0.01)
Significant difference(P<0.01)was detected among all the groups,except * and **,*and ***,** and ***,# and ##.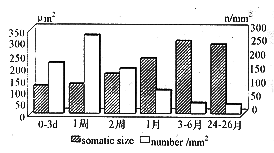
, http://www.100md.com
图9 出生后NOS神经元的密度及细胞大小的变化。 NOS神经元密度在生后1周达到高峰,而成年时降至最低;其胞体大小则逐渐增高,至成年时为最大,老年时无明显变化。
Fig.9 The changes both in size and density of the NOS-positive neurons during postnatal stage.
The density of the NOS-positive neurons increased with the highest level in the first week, then
decreased gradully with the lowest level in adulthood; The somatic size increased and to the highest level
, 百拇医药
in adulthood. No significant differenc was shown in old age group.
随着动物的衰老,机体各种组织常表现出慢性退行性改变,神经组织也不例外。有学者认为神经元所含递质的性质可能是决定神经元数目和神经元形态衰老变化的重要因素。关于NOS神经元在衰老时的变化,不同器官情况有所不同,如老年大鼠胰腺中NOS神经元数明显下降[8],老年大鼠肾上腺中的NOS神经元数目及老年豚鼠胆囊壁中的NOS神经元比例却增高[10,11]。而本实验则发现老年大鼠小肠肌间NOS神经元数目、大小、形态与成年无明显差异,这同其他学者对老年大鼠基底前脑的NOS神经元的观察结果相似[12]。提示肠道肌间神经丛中的NOS神经元可能同基底前脑的NOS神经元一样,也具抗衰老作用。这是否与其富含超氧化物歧化酶(SOD)有关尚待研究。
总之,在发育过程中,小肠肌间神经丛中NOS神经元有一定变化规律,我们对其可能的功能意义进行了讨论,但其确切的功能意义还有待进一步研究。收稿 1997-07 修回 1997-11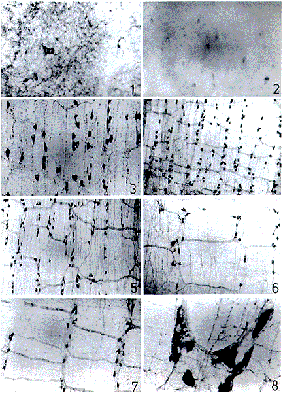
, 百拇医药
图1~8 各发育阶段的着床前胚罗丹明123染色后,显示出的线粒体分布的荧光显微图.从1~8分别为2细胞、4细胞、早期8细胞、挤紧8细胞、桑椹胚、早期囊胚、中期囊胚和扩张囊胚的荧光图片 ×400,图4中的黑箭头示细胞接触面处细胞质中线粒体密集。
图9 挤紧的8细胞胚经秋水仙素(10mg/L)处理1h以后的罗丹明123染色荧光显微图片。线粒体在胞质中弥散分布,细胞质边缘线粒体集中的现象消退 ×400
图10~12 2细胞胚(10)、8细胞胚(11)和囊胚(12)细胞中线粒体超微结构电镜图。M示线粒体 图10×40 000 图11 ×36 000 图12 ×20 000
Fig.1 Fluorescence micrographs showing the arrangement of mitochondria in cytoplasm of preimplantational embryos stained by rhodamine 123,at various development stages,Micrographs of Fig.1~8 represent 2-,4-,early 8-,compacted 8-cell embryo and morula,early blastula,mid-blastula and expanded blastula,respectively,In 1D,the black arrowheads showing the local aggregation in the marginal area of cytoplasm along the surfaces of opposite blastomeres. ×400
, 百拇医药
Fig.9 Fluorescence micrograph showing the dispersion of mitochondria in cytoplasm of compacted 8-cell embryo after treatment with colchicine(10mg/L) for 1h and stain with rhodamine 123 for 10min.
Fig.10~12 Electron micrographs of mitochondria (M)in the cells of 2-cell embryo(Fig.10×40 000),8-cell embryo (Fig.11×36 000)and blastula(Fig.12,×20 000).
图版说明
图1 E13d胚鼠小肠切片,NOS阳性神经元稀散分布于肠壁外层,神经元胞浆少,突起短小 ×400
, 百拇医药
图2 E18d胚鼠小肠整封标本,NOS神经元沿垂直于肠管纵轴方向呈现出形如垂帘般的排列趋势 ×200
图3 生后2d大鼠小肠纵肌层铺片,NOS神经元呈垂帘般排列,神经节不够明显 ×200
图4 生后1周大鼠小肠纵肌层铺片,NOS神经元数目明显增多,神经节与节间束交织呈密集网格状 ×100
图5 生后2周大鼠小肠纵肌层铺片,NOS神经元密集程度有所下降 ×100
图6 成年大鼠小肠纵肌层铺片,NOS神经元密集度下降到最低,神经节与节间束网格增大 ×100
图7 老年大鼠小肠纵肌层铺片,NOS神经元形态特征及密度与成年基本相似 ×100
图8 成年大鼠小肠纵肌层铺片,NOS神经元大,形态各异 ×200
, 百拇医药
Explanation of figures
Fig.1 Section of the small intestine in E13,NOS-neurons distributed rather scarcely with rare cyto plasm and short process.×400
Fig.2 Whole-mount preparation in E18, NOS-neurons tend to distribute in rows.×200
Fig.3 Whole-mount preparation at postnatal 2 days, NOS-neurons distributed in rows more regularly.×100
Fig.4 Whole-mount preparation at postnatal 1 week, the density of NOS-neurons showed the highest.×100
, http://www.100md.com
Fig.5 Whole-mount preparation at postnatal 2 weeks, the density of NOS-neurons slightly decreased.×100
Fig.6 Whole-mount preparation in adulthood, the density of NOS-neurons showed the lowest, the network of the myenteric plexus became larger.×100
Fig.7 Whole-mount preparation in old aged, the morphologic feature and size of the NOS-neurons showed no distinct difference with adulthood.×100
Fig.8 Whole-mount preparation in adulthood, NOS-neurons showed large and varied in shape.×200
, 百拇医药
参考文献
[1]Gdanovic Z, Baumgarten HC, Bruniang G. Histochemistry of NADPH-diaphorase, a marker for neuronal nitric oxide synthase, in the mammalian CNS together with NADPH-diaphorase. Neurosci Lett, 1992, 48(1):225
[2]Aimi Y, Kimura H, Kinoshita T, et al. Histochemical localization of nitric oxide synthase in rat enteric nervous system. Neuroscience, 1993. 53(2):553
[3]Timmermans JP, Barbiers M, Scheuermann DW, et al. Nitric oxide synthase immunoreactivity in the enteric nervous system of the developing human digestive tract. Cell Tiss Res, 1993,275(1):235
, 百拇医药
[4]Cracco C, Filogamo G. Quantitative study of the NADPH-diaphorase positive myenteric neurons of the rat ileum. Neurosci Lett, 1994,61(2):351
[5]Branchek TA, Michaeld G. Time course of neuropeptide Y, calcitonin gene-relted peptide, and NADPH-diaphorase activity in neurons of the developing murine bowel and the appearance of 5-hydroxytryptamine in mucosal enterochromaffin cells. J Comp Neurol, 1989, 285(1):262
[6]Douarin NM Le. Phenotypic expression in the developing murine enteric nervous system. J Neurosci, 1986, 2(4):381
, http://www.100md.com
[7]Gabella G. Neuron size and number in the myenteric of the newborn and adult rat. J Anat, 1971, 109:81
[8]Tay SSW, Burnstock G. Localization of age-related changes in NADPH-diaphorase activity in pancreatic neurons. Neuroscience, 1994,615(2):597
[9]Gabella G , Trigg p.Size of neurons and glial cells in the enteric ganglia of mice, guinea-pig,rabbit and sheep.J Neurocytol,1984,13(1):49
[10]Afework M, Tomlinson A, Burnstock G. Distribution and colocalization of nitric oxide synthase and NADPH-diaphorase in adrenal gland and developing, adult and ageing Sprague-Dawley rats. Cell Tiss Res, 1994, 276(1):133
, http://www.100md.com
[11]Siou GPS, Belai A, Burnstock G. A developmental study of the localization of NADPH-diaphorase in the ganglionated plexus of the guinea-pig gallbladder. Cell Tiss Res, 1994, 276(1):61
[12]顾耀铭,袁群芳,姚志彬等.基底前脑-氧化氮合酶阳性神经元对衰老变化的耐受性。解剖学杂志,1994,17(增刊):115
A STUDY ON THE DEVELOPMENT OF THE NOS-POSITIVE
NEURONS IN THE MYENTERIC PLEXUS OF
RAT SMALL INTESTINE
, 百拇医药
RAT SMALL INTESTINE
Xiao Lan, Cai WenqinΔ
(Department of Histology and Embryology, Third Military Medical University, Chongqing)
Using NADPH-diaphorase histochemistry staining and image analysis, we studied the development of the nitric oxide synthase(NOS) positive neurons in myenteric plexus of small intestine with 52 Wistar rats aged from embryonic 13 days (E13) to 24~26 months. The results showed: The Nos-positive neurons were detected in the wall of the small intestine at E13, The density (numbers/area) of NOS-positive neurons increased gradually and reached it's peak at 1 week after birth, then it decreased and to the lowest level in adulthood, The somatic size of NOS-positive neurons increased gradually and to the largest in adulthood, No distinct difference was found between old and adult rats in both density and size of the NOS-positive neurons. The distribution of NOS-positive neurons was rare at early time and then it became regular, the typical ganglion was observed at 1 week after birth. To our knowledge, it is the first time that the developmental rule of NOS positive neurons in the myenteric plexus of rat small intestine was demonstrated.
KEY WORDS Nitric oxide synthase(NOS);NADPH-diaphorase(NDP);myenteric plexus; development; rat
△Department of Histology and Embryology, Third Military Medical University, Chongqing 400038, China, 百拇医药
单位:第三军医大学组织学胚胎学教研室,重庆 400038
关键词:一氧化氮合酶(NOS);NADPH-黄递酶;肌间神经丛;发育;大鼠
解剖学报980320 摘 要 为研究大鼠小肠肌间神经丛NOS神经元的发育,用NADPH-黄递酶组织化学法及图像分析对胚胎至老年各时期小肠肌间神经丛的NOS神经元发生进行观察。结果显示:NOS神经元于E13d出现,但极稀少,之后逐渐增多,其密度(细胞数/面积)至出生后1周达到高峰,以后逐渐下降,至成年到最低值,直至老年无明显改变;NOS神经元胞体大小逐渐增加,至成年时最大,约为出生时的2倍,直至老年无明显改变;NOS神经元分布,胚胎初为无规律散在排列,大约在出生后1周聚集成明显的神经节。本研究揭示了小肠肌间神经丛NOS神经元的发育变化规律。
一氧化氮(NO)是近年来发现的一种特殊的信使分子,在神经系统中充当神经递质或调质,其内源合成由专一的一氧化氮合酶(NOS)催化L-ARG生成,NOS广泛分布于多种组织,神经组织中的NOS已被证明就是NADPH-黄递酶(NDP),因此,NDP被作为神经元NOS的组织化学标志物而应用于NOS的定位研究[1]。研究表明,小肠肌间神经丛中有较多的NOS神经元分布[2]。其作用主要是释放NO后,通过使胃肠平滑肌细胞中cGMP升高而使平滑肌舒张。由于胃肠道NOS神经元的缺如或发育不良所致的NO缺乏常与胃肠肌肉运动失驰缓疾病如进行性胃扩张、婴儿幽门狭窄、先天性巨结肠等有关[3]。因此,研究肠道NOS神经元的发育,不仅能为发育神经生物学提供基础资料,而且对临床的某些疾病的发病机制及病理生理学提供依据。这方面研究国外报道极少,国内尚未见同类报道。为此,本研究的目的主要是对胚胎至老年大鼠小肠(空肠)肌间神经丛中 NOS神经元的发育及其与年龄相关的变化进行观察,并通过图像分析处理,以探求小肠壁内NOS神经元的发育规律。
, http://www.100md.com
材料和方法
1.动物分组
Wistar大鼠52只(雌雄不拘),以胚胎期及出生后两阶段进行分组,胚胎期按胎龄(阴栓龄)分4组:E13、E16、E18、E19 d,每组5例;出生后分新生期:0~2d、1周、2周各5例;幼年期(1月)5例;成年期(4~8月)8例;老年期(24~26月)4例。
2.取材及标本制作
将胚鼠取出放入4%多聚甲醛,0.1mol/L PB液(pH7.3)中稍许固定后用钟表镊轻轻剥离出小肠前段放入上述固定液中,于4℃固定2h后移入0.05mol/L的TBS(pH7.4)中,于4℃再放置3~5h,切取部分作恒冷箱冰冻切片(横切面,厚20μm),贴片,其余留作整封染色。新生组大鼠取空肠约2cm,用一适当口径的玻棒伸入腔中使肠壁扩张,作成整封肠管后入4%多聚甲醛中固定2h,再移入TBS,于4℃放置3~5h至染色。其余大鼠则取空肠约3~5cm经4%多聚甲醛固定2h后分离纵肌层行肠肌层铺片,将所得撕片置入TBS中2~4h至染色。
, 百拇医药
3.DNP组织化学染色
参照伦敦大学Burnstock实验室的方法配制作用液:0.2g/L NBT,2.7g/L L-苹果酸,1.0g/L β-NADPH(以上试剂均购于Sigma公司),0.1% Triton X-100,0.1mol/L Tris HCl(pH7.6)。将所制标本用含0.1%Triton X-100的TBS充分漂洗后入作用液中于37℃孵育15~30min后用TBS终止反应,胚胎及新生大鼠整封染色肠管可放入4%多聚甲醛中4℃下长期保存。新生大鼠染色后的整封肠管还可行纵肌层铺片,连同其余染色后的铺片及切片标本经乙醇逐级脱水、二甲苯透明、DPX封固后观察。
4.图像分析及统计学处理
利用大恒公司的颗粒形状分析系统软件在监视器下对各组标本进行图像采集、预处理、颗粒分割、修补、二值化,最后设置阈值对图像中的NOS阳性神经元扫描测量,参考Cracco[4]的方法,以图像中颗粒的面积来表示NOS神经元胞体的大小,以单位面积中颗粒数来表示NOS神经元的密度,求出各个NOS阳性细胞的大小、密度及核/浆比。每张铺片标本随机任采集3~5个视野进行分析。
, 百拇医药
结果进行单因素方差分析,检验组间差异。
结 果
1.胚胎期NOS神经元的发育
NOS阳性神经元偶见于E13d鼠胚肠壁上,常单个散在,核/浆比大于1,突起短小,甚至不清楚(图1);E16d,肠壁上可见NOS阳性神经元三五成群散在无规律的排布,细胞形态较为清楚,突起增多;到E18、E19d,小肠壁上NOS神经元密度增高,呈现与肠管纵轴垂直的、形如垂帘般的排列趋势,神经元稍有增大,但核/浆比仍较大。可见神经元突起相互交连,未见明显的神经节及节间束(图2)。
2.出生后NOS神经元的发育
新生0~2d大鼠小肠肌间神经丛中的NOS神经元增大、胞浆增多、突起增长、增粗、相互交织;神经元数目也较胚胎期增多,呈垂帘般的排布更趋规律,局部可见神经节的形成,但不够明显(图3);出生后1周,可见NOS神经元密集排列,神经节及节间束均较明显,交织成网格状(图4);出生后2周,神经节增大且更加明显,节间束增粗,但NOS神经元密集度有所下降(图5);生后1月,可见NOS神经元增大明显,核/浆比进一步减小,而神经元密集度进一步下降;至成年,神经节及NOS神经元进一步增大、节间束粗大、阳性纤维密集,但NOS神经元密度更稀(图6,8);老年组大鼠,肌间神经丛网格形态、NOS神经元大小、形态及密度均与成年组相似(图7)。
, 百拇医药
3.图像分析及统计结果
从附表中可看出,NOS神经元胞体大小从出生到成年几乎增加2倍,尤以生后1月时增加最显著。NOS神经元的密度先上升至1周时达顶峰后又下降至成年到最低,约下降了6倍,此后一直稳定至老年(图9)。
讨 论
本实验用肠道整封染色技术,首次显示了NOS神经元在胚胎及新生大鼠小肠肌间神经丛分布的全貌,使观察更直观、全面。除此,本实验得出了关于小肠壁内NOS神经元发育过程中有趣的变化规律:NOS神经元自出现后逐渐增大、增多、核/浆比减少,排列由无序到规律。NOS神经元胞体大小至成年达最高值并稳定直到老年;NOS神经元密度峰值在出生后1周左右,然后逐渐下降,到成年降到最低并稳定直到成年。
以往研究表明,在鸟类及啮齿类动物胚胎期,肠道神经系统中含不同的神经递质的神经元依一定顺序出现,如胆碱能神经元及5-HT类神经元在E12d小鼠消化道中出现,而肽能神经递质如
, 百拇医药
SP、VIP则稍晚,约E14d出现,CGRP则更晚,约E18d才出现,这一顺序与神经嵴细胞向肠道迁移途中或到位后的局部微环境有关[5,6]。在E13d的大鼠胚胎肠壁中,我们检出了NOS阳性神经元,这与Branchek[5]等检出的小鼠肠道NDP阳性神经元的出现时间(胃E12d,前段肠管E13d)基本一致,说明NOS神经元的出现并不比胆碱能神经元及5-HT等小分子神经递质发生晚,其发生不受乙酰胆碱或5-HT等神经递质的影响。从出生至成年肠道肌间神经元的发育变化,Gabella[7]通过对大鼠的观察得出如下规律:神经元增大,神经元密度下降。我们对大鼠小肠肌间NOS神经元观察的结果基本符合这一规律。而且我们还观察到NOS神经元的密度高峰在出生后1周左右,大约为成年时的6倍。这一现象在肠道肌间神经元发育中是否具有普遍性或仅仅是NOS神经元发育所特有,目前尚未见类似报道。我们推测这可能是刚出生这一周内,由于食物的刺激,局部微环境的根本变化促使NOS神经元急剧增多、聚集以适应胃肠道消化功能刚建立的需要。至于NOS神经元数目如何增加,目前尚不清楚,有作者推测可能有细胞分裂增殖或一些阴性细胞在发育中产生了NOS的表达[8]。随着肠管的发育增长,肠壁内NOS神经元也会不断增多、成熟、功能健全,而其增长速度则会越来越慢于肠壁肌肉的快速增长,这势必导致NOS神经元密度的相对下降。关于肠道肌间神经元大小变化与肠管大小呈正相关,而神经元密度变化则与肠管大小呈负相关这一点,Gabella[9]已报道过。另外,NOS神经元密度的下降也不能排除过量增殖的神经元在发育中未能获取足够的由靶细胞产生的对维系其存活必需的信号物质,如神经营养因子而造成的神经元程序性死亡的可能。附表 NOS神经元形态测量结果
, 百拇医药
Table Quantitation of NOS-positive neurons 组别
group
胞体大小(μm2)
somatic size
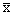 ±s
±s密度(细胞数/mm2)
density
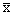 ±s
±s核/浆比
N/P
, http://www.100md.com E13
39±6
1∶1.1
E16
59±9
1∶1.4
E18
62±7
1∶1.4
0~2d
115±22
180±24
1∶1.4
, http://www.100md.com
1周(w)
121±20
278±43
1∶1.6
2周(w)
164±20
160±12
1∶1.6
1月(m)
230±28
83±20
1∶1.7
3~6月(m)
, 百拇医药
302±28#
38±5#
1∶2.4
24~26月(m)
288±37##
34±4##
1∶2.4
除*与**,*与***,**与***,#与##间无显著差异外,其余各组间均相差显著(P<0.01)
Significant difference(P<0.01)was detected among all the groups,except * and **,*and ***,** and ***,# and ##.

, http://www.100md.com
图9 出生后NOS神经元的密度及细胞大小的变化。 NOS神经元密度在生后1周达到高峰,而成年时降至最低;其胞体大小则逐渐增高,至成年时为最大,老年时无明显变化。
Fig.9 The changes both in size and density of the NOS-positive neurons during postnatal stage.
The density of the NOS-positive neurons increased with the highest level in the first week, then
decreased gradully with the lowest level in adulthood; The somatic size increased and to the highest level
, 百拇医药
in adulthood. No significant differenc was shown in old age group.
随着动物的衰老,机体各种组织常表现出慢性退行性改变,神经组织也不例外。有学者认为神经元所含递质的性质可能是决定神经元数目和神经元形态衰老变化的重要因素。关于NOS神经元在衰老时的变化,不同器官情况有所不同,如老年大鼠胰腺中NOS神经元数明显下降[8],老年大鼠肾上腺中的NOS神经元数目及老年豚鼠胆囊壁中的NOS神经元比例却增高[10,11]。而本实验则发现老年大鼠小肠肌间NOS神经元数目、大小、形态与成年无明显差异,这同其他学者对老年大鼠基底前脑的NOS神经元的观察结果相似[12]。提示肠道肌间神经丛中的NOS神经元可能同基底前脑的NOS神经元一样,也具抗衰老作用。这是否与其富含超氧化物歧化酶(SOD)有关尚待研究。
总之,在发育过程中,小肠肌间神经丛中NOS神经元有一定变化规律,我们对其可能的功能意义进行了讨论,但其确切的功能意义还有待进一步研究。收稿 1997-07 修回 1997-11

, 百拇医药
图1~8 各发育阶段的着床前胚罗丹明123染色后,显示出的线粒体分布的荧光显微图.从1~8分别为2细胞、4细胞、早期8细胞、挤紧8细胞、桑椹胚、早期囊胚、中期囊胚和扩张囊胚的荧光图片 ×400,图4中的黑箭头示细胞接触面处细胞质中线粒体密集。
图9 挤紧的8细胞胚经秋水仙素(10mg/L)处理1h以后的罗丹明123染色荧光显微图片。线粒体在胞质中弥散分布,细胞质边缘线粒体集中的现象消退 ×400
图10~12 2细胞胚(10)、8细胞胚(11)和囊胚(12)细胞中线粒体超微结构电镜图。M示线粒体 图10×40 000 图11 ×36 000 图12 ×20 000
Fig.1 Fluorescence micrographs showing the arrangement of mitochondria in cytoplasm of preimplantational embryos stained by rhodamine 123,at various development stages,Micrographs of Fig.1~8 represent 2-,4-,early 8-,compacted 8-cell embryo and morula,early blastula,mid-blastula and expanded blastula,respectively,In 1D,the black arrowheads showing the local aggregation in the marginal area of cytoplasm along the surfaces of opposite blastomeres. ×400
, 百拇医药
Fig.9 Fluorescence micrograph showing the dispersion of mitochondria in cytoplasm of compacted 8-cell embryo after treatment with colchicine(10mg/L) for 1h and stain with rhodamine 123 for 10min.
Fig.10~12 Electron micrographs of mitochondria (M)in the cells of 2-cell embryo(Fig.10×40 000),8-cell embryo (Fig.11×36 000)and blastula(Fig.12,×20 000).
图版说明
图1 E13d胚鼠小肠切片,NOS阳性神经元稀散分布于肠壁外层,神经元胞浆少,突起短小 ×400
, 百拇医药
图2 E18d胚鼠小肠整封标本,NOS神经元沿垂直于肠管纵轴方向呈现出形如垂帘般的排列趋势 ×200
图3 生后2d大鼠小肠纵肌层铺片,NOS神经元呈垂帘般排列,神经节不够明显 ×200
图4 生后1周大鼠小肠纵肌层铺片,NOS神经元数目明显增多,神经节与节间束交织呈密集网格状 ×100
图5 生后2周大鼠小肠纵肌层铺片,NOS神经元密集程度有所下降 ×100
图6 成年大鼠小肠纵肌层铺片,NOS神经元密集度下降到最低,神经节与节间束网格增大 ×100
图7 老年大鼠小肠纵肌层铺片,NOS神经元形态特征及密度与成年基本相似 ×100
图8 成年大鼠小肠纵肌层铺片,NOS神经元大,形态各异 ×200
, 百拇医药
Explanation of figures
Fig.1 Section of the small intestine in E13,NOS-neurons distributed rather scarcely with rare cyto plasm and short process.×400
Fig.2 Whole-mount preparation in E18, NOS-neurons tend to distribute in rows.×200
Fig.3 Whole-mount preparation at postnatal 2 days, NOS-neurons distributed in rows more regularly.×100
Fig.4 Whole-mount preparation at postnatal 1 week, the density of NOS-neurons showed the highest.×100
, http://www.100md.com
Fig.5 Whole-mount preparation at postnatal 2 weeks, the density of NOS-neurons slightly decreased.×100
Fig.6 Whole-mount preparation in adulthood, the density of NOS-neurons showed the lowest, the network of the myenteric plexus became larger.×100
Fig.7 Whole-mount preparation in old aged, the morphologic feature and size of the NOS-neurons showed no distinct difference with adulthood.×100
Fig.8 Whole-mount preparation in adulthood, NOS-neurons showed large and varied in shape.×200
, 百拇医药
参考文献
[1]Gdanovic Z, Baumgarten HC, Bruniang G. Histochemistry of NADPH-diaphorase, a marker for neuronal nitric oxide synthase, in the mammalian CNS together with NADPH-diaphorase. Neurosci Lett, 1992, 48(1):225
[2]Aimi Y, Kimura H, Kinoshita T, et al. Histochemical localization of nitric oxide synthase in rat enteric nervous system. Neuroscience, 1993. 53(2):553
[3]Timmermans JP, Barbiers M, Scheuermann DW, et al. Nitric oxide synthase immunoreactivity in the enteric nervous system of the developing human digestive tract. Cell Tiss Res, 1993,275(1):235
, 百拇医药
[4]Cracco C, Filogamo G. Quantitative study of the NADPH-diaphorase positive myenteric neurons of the rat ileum. Neurosci Lett, 1994,61(2):351
[5]Branchek TA, Michaeld G. Time course of neuropeptide Y, calcitonin gene-relted peptide, and NADPH-diaphorase activity in neurons of the developing murine bowel and the appearance of 5-hydroxytryptamine in mucosal enterochromaffin cells. J Comp Neurol, 1989, 285(1):262
[6]Douarin NM Le. Phenotypic expression in the developing murine enteric nervous system. J Neurosci, 1986, 2(4):381
, http://www.100md.com
[7]Gabella G. Neuron size and number in the myenteric of the newborn and adult rat. J Anat, 1971, 109:81
[8]Tay SSW, Burnstock G. Localization of age-related changes in NADPH-diaphorase activity in pancreatic neurons. Neuroscience, 1994,615(2):597
[9]Gabella G , Trigg p.Size of neurons and glial cells in the enteric ganglia of mice, guinea-pig,rabbit and sheep.J Neurocytol,1984,13(1):49
[10]Afework M, Tomlinson A, Burnstock G. Distribution and colocalization of nitric oxide synthase and NADPH-diaphorase in adrenal gland and developing, adult and ageing Sprague-Dawley rats. Cell Tiss Res, 1994, 276(1):133
, http://www.100md.com
[11]Siou GPS, Belai A, Burnstock G. A developmental study of the localization of NADPH-diaphorase in the ganglionated plexus of the guinea-pig gallbladder. Cell Tiss Res, 1994, 276(1):61
[12]顾耀铭,袁群芳,姚志彬等.基底前脑-氧化氮合酶阳性神经元对衰老变化的耐受性。解剖学杂志,1994,17(增刊):115
A STUDY ON THE DEVELOPMENT OF THE NOS-POSITIVE
NEURONS IN THE MYENTERIC PLEXUS OF
RAT SMALL INTESTINE
, 百拇医药
RAT SMALL INTESTINE
Xiao Lan, Cai WenqinΔ
(Department of Histology and Embryology, Third Military Medical University, Chongqing)
Using NADPH-diaphorase histochemistry staining and image analysis, we studied the development of the nitric oxide synthase(NOS) positive neurons in myenteric plexus of small intestine with 52 Wistar rats aged from embryonic 13 days (E13) to 24~26 months. The results showed: The Nos-positive neurons were detected in the wall of the small intestine at E13, The density (numbers/area) of NOS-positive neurons increased gradually and reached it's peak at 1 week after birth, then it decreased and to the lowest level in adulthood, The somatic size of NOS-positive neurons increased gradually and to the largest in adulthood, No distinct difference was found between old and adult rats in both density and size of the NOS-positive neurons. The distribution of NOS-positive neurons was rare at early time and then it became regular, the typical ganglion was observed at 1 week after birth. To our knowledge, it is the first time that the developmental rule of NOS positive neurons in the myenteric plexus of rat small intestine was demonstrated.
KEY WORDS Nitric oxide synthase(NOS);NADPH-diaphorase(NDP);myenteric plexus; development; rat
△Department of Histology and Embryology, Third Military Medical University, Chongqing 400038, China, 百拇医药