“彗星” 法分析人肿瘤细胞DNA放射损伤和修复
作者:吕长兴 杨伟志 殷蔚伯 董秀癑 李艳春
单位:杨伟志 殷蔚伯 董秀癑 李艳春(北京,中国医学科学院中国协和医科大学肿瘤医院放射治疗科 100021);吕长兴(上海市胸科医院放射治疗科 200030)
关键词:“彗星”分析法;肿瘤细胞系;DNA损伤;DNA修复;DNA单链断裂
中华放射肿瘤学杂志000212 【摘要】 目的 探讨“彗星”分析法(CA)在检测体外培养人肿瘤细胞DNA放射损伤与修复和放射敏感性的关系。方法 采用碱性CA检测鼻咽高分化鳞癌上皮细胞系(CNE-1)、食管鳞癌上皮细胞系(Ec-109)、肺腺癌细胞系(GLC)和胃低分化腺癌细胞系(BGC-823)经6MV X射线照射后单细胞内DNA单链断裂(SSB)程度及其与放射剂量的关系,以及CNE-1和GLC细胞系在分别接受了16Gy X射线照射后的自身修复情况,同时与相应的细胞存活曲线比较。结果 碱性CA可以检测出4个细胞系DNA的SSB,并与放射剂量呈良好的线性关系。16Gy剂量下各细胞系的SSB程度依次为CNE-1>Ec-109>GLC>BGC-823。CNE-1,Ec-109,GLC和BGC-823细胞系的Do值分别为1.25,1.27,1.88和1.56。16Gy诱导CNE-1和GLC细胞系的DNA损伤后,其半修复时间分别为7.4,17.8min。结论 采用碱性CA能确切反映4种人肿瘤细胞系DNA的定量损伤程度及其与放射剂量的关系,并能确切反映辐射损伤后自身修复能力(CNE-1和GLC)在受测时间中的定量变化情况。自身修复能力的大小在鳞癌和腺癌细胞系间与放射敏感性的大小(Do值)有较好的对应关系。
, 百拇医药
Study of radiation-induced DNA damage and repair with comet assay in four human tumor cell lines
LU Changxing YANG Weizhi YIN Weibo et al
(Department of Radiation Oncology ,Cancer Hospital, Chinese Academy of Medical Sciences , Peking Union Medical College, Beijing 100021 ,China)
【Abstract】 Objective To establish the relationship between radiosensitivity and radiation-induced DNA damage and repair in four human tumor cell lines by means of comet assay. Methods With the alkaline comet assay,the amounts of DNA single strand breaks (SSB) were quantified. The correlation between a certain DNA damage and the relevant radiation dose was investigated in four human tumor cell lines: the well differentiated nasopharyngeal squamous carcinoma cell line (CNE-1), the esophageal squamous carcinoma cell line (Ec-109), the lung adenocarcinoma cell line (GLC), and the poorly differentiated gastric adenocarcinoma cell line (BGC-823) ,which had been exposed to 6 MV X-ray. In our study, the spontaneous DNA repair of SSB after exposure was also determined for cell lines of CNE-1 and GLC, and the result was compared to that from the clonogenic cell surviving assay. Results The amount of DNA SSB induced by irradiation of a single dose of 16 Gy was definitely detected with the alkaline comet assay in all cell lines. It was found that there was a close association of DNA damage and the delivered dose; that is the larger the dose, the severer the DNA SSB. For the same single dose of 16 Gy according to a descending order, the different DNA damages ranked as: CNE-1>Ec-109>GLC>BGC-823. The Do values of CNE-1, Ec-109, GLC and BGC-823 were 1.25, 1.27, 1.88 and 1.56, respectively. The half repair time was 17.8min for CNE-1 and 7.4min for GLC.. Conclusions It is concluded that this assay definitely detects, and presents exactly the amount of DNA damage induced by radiation in four human tumor cell lines (CNE-1, Ec-109, GLC and BGC-823), and quantitatively demonstrates the spontaneous repair of DNA damage as well.The radiosensitivity,with different Do values for squamous carcinoma or adenocarcinoma cell lines,is correlative to the ability of DNA-damage repair.
, 百拇医药
【Key words】 Comet assay ; Tumor cell lines ; DNA damage ;DNA repair ; DNA single strand breaks
放射线在生物体内的电离作用是通过直接或间接作用引起细胞DNA断裂来发挥其杀伤癌细胞效应。因此研究和探索能快速检测DNA链断裂及修复的方法,以用于个体肿瘤患者放射敏感性的预测。本研究采用碱性“彗星”分析法(comet assay,CA),观察4种不同人体肿瘤细胞系的放射损伤及其自身修复能力,并与细胞存活曲线进行比较,探讨CA在预测放射敏感性方面应用的价值。
1 材料与方法
1.1 细胞系:CNE-1为鼻咽高分化鳞癌上皮细胞系,Ec-109为食管鳞癌上皮细胞系,GLC为肺腺癌细胞系,BGC-823为胃低分化腺癌细胞系。上述细胞系均由中国医学科学院肿瘤研究所放射生物室提供。
, http://www.100md.com
1.2 细胞培养:上述细胞系均为单层贴壁生长,培养液为含20%胎牛血清的RPMI 1640完全培养液,细胞置5%CO2, 37℃培养箱内培养。
1.3 照射条件:取指数生长期细胞置于Varian Clinic 600直线加速器6MV X射线下照射,照射野为10cm×10cm,源皮距为100cm,剂量率为250cGy/min,瓶面上覆盖1.5cm厚等效蜡板。用于“彗星”分析的细胞应将培养瓶置于冰面上。
1.4 照射剂量:细胞存活曲线为0,1,2,3,4,6,8,10Gy,CA为0,4,8,12,16Gy。用于分析DNA照射损伤的样品,于照射后立即消化制备单细胞悬液用于检测DNA。
1.5 碱性“彗星”电泳: 参照文献[1-3]介绍的检测单细胞DNA单链断裂的(single strand breaks,SSB)碱性“彗星”电泳技术,所用试剂均购自Sigma化学公司。具体操作如下:(1)制备单细胞胶: 测试细胞用预冷的PBS洗2次,稀释成含2×104个/mL细胞数的悬液,按0.5mL细胞悬液,加入1.5mL预先制备的质量浓度为10g/L的低熔点琼脂糖胶(Sigma, A-4018, Low gelling temperature agarose),在试管中混合,并迅速铺展到预冷的载玻片上。室温下静置1~2min以使胶完全凝固。(2)细胞裂解和碱变性处理:将完全凝固的胶板浸在100mL新配制的碱性水解液中(1.0Mol/L NaCl,0.03Mol/L NaOH和体积份数为0.02N-lauroyl-Sarcosine)作用1h。然后用0.3Mol/L NaOH+2.0mMol/L EDTA溶液漂洗3次,每次20min。(3)凝胶电泳:将处理后的凝胶板水平排放入已加入电泳液的电泳槽中,电泳液为新配制的0.03Mol/L NaOH+2.0mMol/L EDTA溶液,接通电源,电泳条件为0.6V/cm,电流量为40~44mA,避光下电泳25min。(4)荧光染色:电泳后取出凝胶板,经15min去离子水浸洗,用质量浓度为2.5mg/L碘化丙啶(propidium iodid, PI)染液避光下染色20min。染色后的凝胶板经去离子水轻洗去除多余染料后,放入避光的密闭湿盒内,在48h内进行图像分析。(5)“彗星”图像分析:PI染色后的凝胶板,用吸湿纸吸干载玻片的多余水分,置于Nicon倒置荧光显微镜下,通过与之连接的图像分析系统进行图像测量和数据分析(图像分析系统由北京大恒图像视觉有限公司研制)。一个典型的受损细胞即“彗星”图像包括了头和尾部。DNA损伤的程度是采用计算机软件自动检测分析,并以尾矩(tail moment,TM)作为检测DNA单链断裂的终指标。该指标被定义为:“彗星”头部和尾部各自分布的中心点间的距离与总体DNA在尾部的分数的乘积[1,3,4]。每个“彗星”细胞都被分别用相应计算机程序进行独立分析记录。每个受测样品至少观察100个“彗星”细胞,每一实验条件至少重复一次。
, 百拇医药
1.6 细胞存活曲线: 照射后细胞经5%CO2,37℃培养,12~14d后,无水乙醇固定,结晶紫染色,计数≥50个细胞的克隆集落,计算贴瓶率(PE)及存活率。
1. 7 统计方法:DNA损伤结果用t检验,细胞存活曲线用“多靶单击模型”拟和。
2 结果
2.1 辐射对人体肿瘤细胞系DNA的损伤:4种人肿瘤细胞系在相同实验条件下,X射线照射结果见表1。结果表明各细胞系的细胞在未接受X射线照射情况下,其DNA在实验操作过程中的人为损伤均极轻微,结果差异不大(P>0.05)。4Gy照射后DNA损伤比与同系未照射细胞有显著增加(P<0.01)。并随照射剂量的递增,其DNA损伤加重,尤其CNE-1细胞和Ec-109细胞二者呈良好的线性关系 (图1)。图2示CNE-1和GLC细胞的“彗星”尾随剂量增加的图像变化。在16Gy剂量点时CNE-1细胞的DNA损伤程度明显大于其它各细胞系(P<0.01),各细胞系DNA损伤程度依次为:CNE-1>Ec-109>GLC>BGC-823。鳞癌细胞DNA损伤程度大于腺癌,腺癌细胞系间尾矩大小差异无显著性意义 (P>0.05)。图3示4种人肿瘤细胞系由多靶单击模型S=1-[1-e(-D/Do)]N拟合的细胞存活曲线。CNE-1,Ec-109,GLC和BGC-823各细胞系的D。值分别为1.25,1.27,1.88和1.56Gy。将照射后细胞系的存活份数与相应剂量点下的“彗星”尾矩结果绘制成图4,图中可见两个评价指标间存在着良好的负相关性。
, 百拇医药
表1 X射线对人体肿瘤细胞系DNA损伤的检测结果(TM,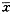 ±s) 细胞系
±s) 细胞系
0Gy①
4Gy②
8Gy
12Gy
16Gy③
CNE-1
0.046±0.006
1.198±0.042
3.538±0.131
, http://www.100md.com
7.443±0.256
17.863±0.609
Ec-109
0.032±0.007
0.247±0.043
3.546±0.194
6.616±0.284
8.278±0.354
GLC
0.074±0.009
0.250±0.041
, 百拇医药
0.806±0.029
2.286±0.055
3.519±0.122
BGC-823
0.035±0.004
0.516±0.064
0.851±0.020
1.376±0.486
1.820±0.062
注:①细胞系间比较P>0.05,②与0Gy比较P<0.01,③CNE-1与各细胞系间比较P<0.01
, 百拇医药
2.2 辐射诱导人肿瘤细胞DNA单链断裂的修复:CNE-1和GLC细胞系,各自接受16Gy的X线照射后不同时间取样,以检测其DNA损伤后的修复,结果见图5所示。16Gy照射后,CNE-1细胞DNA的损伤程度明显大于GLC细胞系(P<0.01)。但GLC细胞的损伤后自身修复能力明显快于CNE-1细胞,损伤后仅5min即可检测到GLC细胞的修复。根据图5可分别计算CNE-1和GLC细胞系“彗星”尾矩降低至初始水平一半时的半修复时间,它们分别为7.4min和17.8min。从总体的修复程度上看,CNE-1细胞与GLC细胞相比,修复能力较差。
图1 X射线诱导4种细胞系的DNA损伤与剂量的关系
3 讨论
“彗星”分析法作为一种具有吸引力的肿瘤放射敏感性的临床检测方法,是由于它仅需少量肿瘤细胞(数千个细胞,通过针吸活检便可获得),当天便可得出测试结果。其结果可以反映肿瘤对某种治疗的敏感性、生长活跃和乏氧肿瘤细胞的比例以及肿瘤对治疗反应的异质性[5]。同时还可以将测试结果与标准的细胞存活曲线和其它电泳分析法进行比较。为证实“彗星”分析法能够作为一种快速检测肿瘤放射敏感性的方法,必须表明这种检测方法应与克隆形成率测定的放射敏感性有相关性。Nunez等[6]的实验结果显示放射诱导人肿瘤细胞DNA损伤的初水平和克隆形成率的放射敏感性有非常明显的一致性。本实验结果也证实4种人肿瘤细胞系对X射线照射后所诱导的DNA损伤,其检测敏感性较高,给予4Gy单次照射后,即可检测出SSB明显增高,与相应未照射细胞相比差异具有极显著性意义(P<0.01)。不同照射剂量可诱导不同程度的DNA损伤,其损伤程度与照射剂量间有良好的线性关系。这一结果与已报道采用“彗星”分析法在多种人癌或鼠细胞系所获得的结果一致[7,8]。从表1和图1中可看出CNE-1细胞对放射最为敏感,尾矩最大,存活份数最低。“彗星”分析法和细胞存活曲线的Do值都显示出相似的放射敏感性高低,依次为CNE-1>Ec-109>GLC>BGC-823。图4进一步表明由“彗星”分析法所测定的尾矩大小可以被用于预测不同人肿瘤细胞系的放射敏感性,放射对不同肿瘤细胞系DNA损伤的效应大小与克隆形成率间有良好的负相关性。对于体外单层培养的细胞系,尤其是处于指数生长期的细胞,尽管其来源不同,但对放射所引起的DNA反应程度大致相同,均与剂量间呈良好的线性关系[8]。这一点可解释本研究所观察到2种腺癌细胞系DNA损伤程度的差异无显著性意义(P>0.05)。从临床角度出发,实体肿瘤对放射治疗的反应性除了受瘤细胞内在放射敏感性的影响外,还与瘤体中不同的异质性细胞群体以及其所处的细胞周期、增殖动力学、所处的氧供条件等有关。因此应用“彗星”分析法对人实体肿瘤,尤其对特定的临床肿瘤患者来检测其瘤细胞对特定的放射治疗与化疗的反应将更具实际意义,这些已有详尽的论述与报道[2,5,9,10]。肿瘤细胞对放射或其它DNA诱变剂的反应性,除与其DNA的损伤程度有关外,还取决于其DNA损伤后的自身修复能力。本研究观察到CNE-1和GLC细胞系细胞在接受16GyX射线照射后,其半修复时间分别为17.4,7.4min。CNE-1细胞明显较GLC细胞的自身修复速度慢,表明CNE-1细胞受照后因自身修复能力较弱而对射线较敏感;而GLC细胞辐射后的自身修复较快,故对射线较为抗拒。该结果与其细胞存活曲线上Do值相一致。
, http://www.100md.com
图2 不同辐射剂量的“彗星”尾矩变化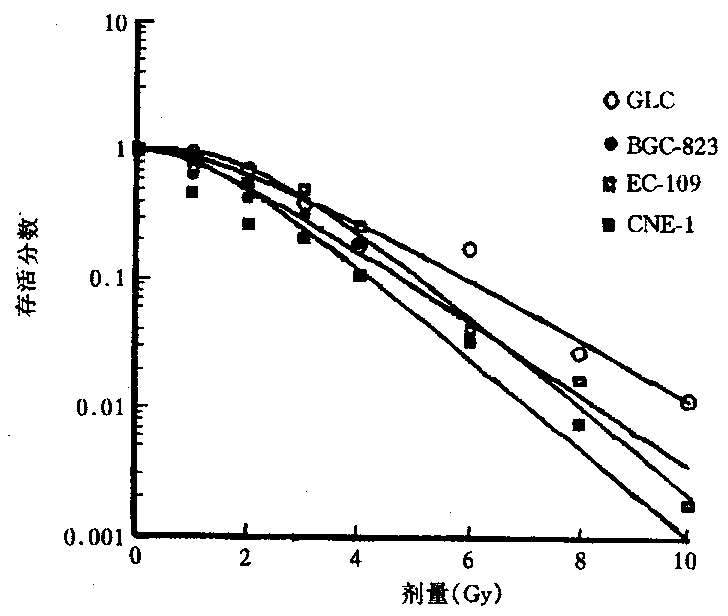
图3 4种细胞系照射后的存活曲线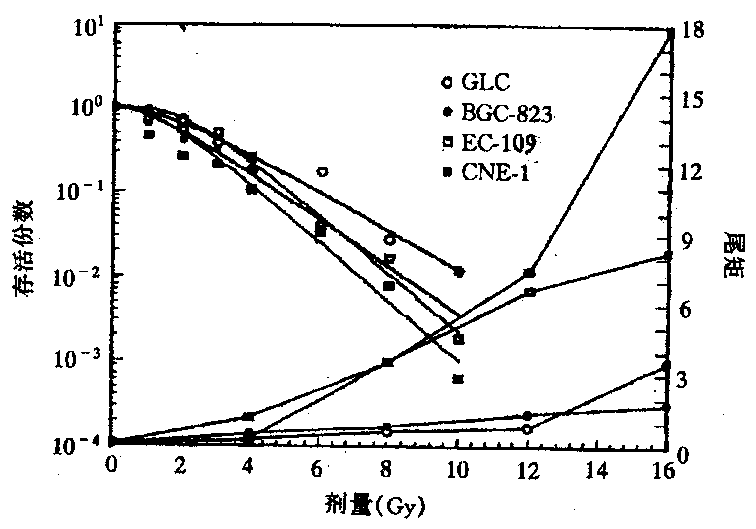
图4 不同细胞系照射后DNA损伤与细胞存活份数的关系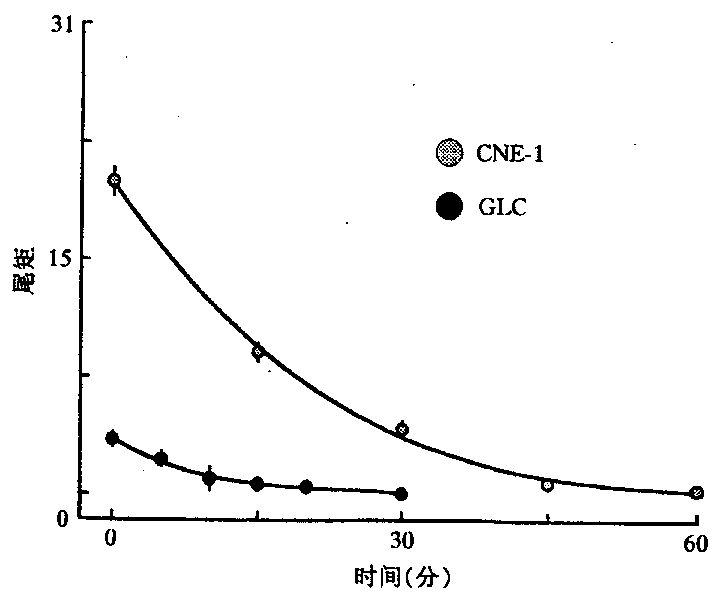
图5 16GyX射线诱导GLC和CNE-1细胞DNA
损伤后不同时间的修复变化
综上所述,本研究采用碱性“彗星”分析法,对4种肿瘤细胞DNA放射损伤及修复进行了检测,并与细胞存活曲线进行了比较。结果表明该检测方法能定量反映不同肿瘤细胞系对不同照射剂量所诱导的DNA损伤的不同反应,其损伤程度与放射剂量呈良好的线性关系,且与相应肿瘤细胞系的克隆形成率有较好的负相关性。它可以反映出不同肿瘤细胞系间的放射敏感性,且以鳞癌和腺间的差异最明显。该方法还可以检测出放射后DNA损伤的自身修复能力在不同受测时间中的定量变化情况,为预测放射敏感性提供了一项具有重要参考价值的指标。
, 百拇医药
参 考 文 献
1,Olive PL, Banath JP, Durand RE. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the comet assay. Radiat Res,1990,122:86-94.
2,Huang P, Olive PL, Durand RE. Use of the comet assay for assessment of drug resistance and its modulation in vivo. Br J Cancer,1998,77:412-416.
3, Olive PL, Wlodek D, Durand RE, et al. Factors influencing DNA migration from individual cells subjected to gel electrophoresis. Exp Cell Res.1992,198:259-267.
, http://www.100md.com
4,Olive PL, Banath JP. Induction and rejoining of radiation-induced DNA single-strand breaks: "tail moment" as a function of position in the cell cycle. Mutation Res,1993(1),294:275-283.
5,Olive PL, LeRiche, Jackson SJ. Growth fraction of human tumors: assays and complication. Semi Radiat Oncol, 1993,7:90-98.
6,Nunez MI, McMillan TJ, Valenzuela MT, et al. Relationship between DNA damage, rejoining and cell killing by radiation in mammalian cells. Radiother oncol,996,39:155-165.
, 百拇医药
7,Olive PL, Banath JP, Mac Phail HS. Lack of correlation between radiosensitivity and DNA doulde-strand break, inductions or rejoining in six human tumor cell lines. ancer Res,1994,54:3939-3946.
8,Hu Q, Kavangh MC, Newcombe D, et al. Detection of hypoxic fraction in murine tumors by comet assay: comparison with other techniques. Radiat Res,1995,144: 266-273.
9,Fairbairn DW,Olive PL, O'Neill KL. The comet assay:a comprehensive review. Mutation Res,1995,339:37-59.
10,Olive PL, Durand RF, Le-Riche J,et al. Gel electrophoresis of individual cell to quantity hypoxic fraction in human breast cancer. Cancer Res,1993,53:733-736.
(收稿日期:1999-11-08), http://www.100md.com
单位:杨伟志 殷蔚伯 董秀癑 李艳春(北京,中国医学科学院中国协和医科大学肿瘤医院放射治疗科 100021);吕长兴(上海市胸科医院放射治疗科 200030)
关键词:“彗星”分析法;肿瘤细胞系;DNA损伤;DNA修复;DNA单链断裂
中华放射肿瘤学杂志000212 【摘要】 目的 探讨“彗星”分析法(CA)在检测体外培养人肿瘤细胞DNA放射损伤与修复和放射敏感性的关系。方法 采用碱性CA检测鼻咽高分化鳞癌上皮细胞系(CNE-1)、食管鳞癌上皮细胞系(Ec-109)、肺腺癌细胞系(GLC)和胃低分化腺癌细胞系(BGC-823)经6MV X射线照射后单细胞内DNA单链断裂(SSB)程度及其与放射剂量的关系,以及CNE-1和GLC细胞系在分别接受了16Gy X射线照射后的自身修复情况,同时与相应的细胞存活曲线比较。结果 碱性CA可以检测出4个细胞系DNA的SSB,并与放射剂量呈良好的线性关系。16Gy剂量下各细胞系的SSB程度依次为CNE-1>Ec-109>GLC>BGC-823。CNE-1,Ec-109,GLC和BGC-823细胞系的Do值分别为1.25,1.27,1.88和1.56。16Gy诱导CNE-1和GLC细胞系的DNA损伤后,其半修复时间分别为7.4,17.8min。结论 采用碱性CA能确切反映4种人肿瘤细胞系DNA的定量损伤程度及其与放射剂量的关系,并能确切反映辐射损伤后自身修复能力(CNE-1和GLC)在受测时间中的定量变化情况。自身修复能力的大小在鳞癌和腺癌细胞系间与放射敏感性的大小(Do值)有较好的对应关系。
, 百拇医药
Study of radiation-induced DNA damage and repair with comet assay in four human tumor cell lines
LU Changxing YANG Weizhi YIN Weibo et al
(Department of Radiation Oncology ,Cancer Hospital, Chinese Academy of Medical Sciences , Peking Union Medical College, Beijing 100021 ,China)
【Abstract】 Objective To establish the relationship between radiosensitivity and radiation-induced DNA damage and repair in four human tumor cell lines by means of comet assay. Methods With the alkaline comet assay,the amounts of DNA single strand breaks (SSB) were quantified. The correlation between a certain DNA damage and the relevant radiation dose was investigated in four human tumor cell lines: the well differentiated nasopharyngeal squamous carcinoma cell line (CNE-1), the esophageal squamous carcinoma cell line (Ec-109), the lung adenocarcinoma cell line (GLC), and the poorly differentiated gastric adenocarcinoma cell line (BGC-823) ,which had been exposed to 6 MV X-ray. In our study, the spontaneous DNA repair of SSB after exposure was also determined for cell lines of CNE-1 and GLC, and the result was compared to that from the clonogenic cell surviving assay. Results The amount of DNA SSB induced by irradiation of a single dose of 16 Gy was definitely detected with the alkaline comet assay in all cell lines. It was found that there was a close association of DNA damage and the delivered dose; that is the larger the dose, the severer the DNA SSB. For the same single dose of 16 Gy according to a descending order, the different DNA damages ranked as: CNE-1>Ec-109>GLC>BGC-823. The Do values of CNE-1, Ec-109, GLC and BGC-823 were 1.25, 1.27, 1.88 and 1.56, respectively. The half repair time was 17.8min for CNE-1 and 7.4min for GLC.. Conclusions It is concluded that this assay definitely detects, and presents exactly the amount of DNA damage induced by radiation in four human tumor cell lines (CNE-1, Ec-109, GLC and BGC-823), and quantitatively demonstrates the spontaneous repair of DNA damage as well.The radiosensitivity,with different Do values for squamous carcinoma or adenocarcinoma cell lines,is correlative to the ability of DNA-damage repair.
, 百拇医药
【Key words】 Comet assay ; Tumor cell lines ; DNA damage ;DNA repair ; DNA single strand breaks
放射线在生物体内的电离作用是通过直接或间接作用引起细胞DNA断裂来发挥其杀伤癌细胞效应。因此研究和探索能快速检测DNA链断裂及修复的方法,以用于个体肿瘤患者放射敏感性的预测。本研究采用碱性“彗星”分析法(comet assay,CA),观察4种不同人体肿瘤细胞系的放射损伤及其自身修复能力,并与细胞存活曲线进行比较,探讨CA在预测放射敏感性方面应用的价值。
1 材料与方法
1.1 细胞系:CNE-1为鼻咽高分化鳞癌上皮细胞系,Ec-109为食管鳞癌上皮细胞系,GLC为肺腺癌细胞系,BGC-823为胃低分化腺癌细胞系。上述细胞系均由中国医学科学院肿瘤研究所放射生物室提供。
, http://www.100md.com
1.2 细胞培养:上述细胞系均为单层贴壁生长,培养液为含20%胎牛血清的RPMI 1640完全培养液,细胞置5%CO2, 37℃培养箱内培养。
1.3 照射条件:取指数生长期细胞置于Varian Clinic 600直线加速器6MV X射线下照射,照射野为10cm×10cm,源皮距为100cm,剂量率为250cGy/min,瓶面上覆盖1.5cm厚等效蜡板。用于“彗星”分析的细胞应将培养瓶置于冰面上。
1.4 照射剂量:细胞存活曲线为0,1,2,3,4,6,8,10Gy,CA为0,4,8,12,16Gy。用于分析DNA照射损伤的样品,于照射后立即消化制备单细胞悬液用于检测DNA。
1.5 碱性“彗星”电泳: 参照文献[1-3]介绍的检测单细胞DNA单链断裂的(single strand breaks,SSB)碱性“彗星”电泳技术,所用试剂均购自Sigma化学公司。具体操作如下:(1)制备单细胞胶: 测试细胞用预冷的PBS洗2次,稀释成含2×104个/mL细胞数的悬液,按0.5mL细胞悬液,加入1.5mL预先制备的质量浓度为10g/L的低熔点琼脂糖胶(Sigma, A-4018, Low gelling temperature agarose),在试管中混合,并迅速铺展到预冷的载玻片上。室温下静置1~2min以使胶完全凝固。(2)细胞裂解和碱变性处理:将完全凝固的胶板浸在100mL新配制的碱性水解液中(1.0Mol/L NaCl,0.03Mol/L NaOH和体积份数为0.02N-lauroyl-Sarcosine)作用1h。然后用0.3Mol/L NaOH+2.0mMol/L EDTA溶液漂洗3次,每次20min。(3)凝胶电泳:将处理后的凝胶板水平排放入已加入电泳液的电泳槽中,电泳液为新配制的0.03Mol/L NaOH+2.0mMol/L EDTA溶液,接通电源,电泳条件为0.6V/cm,电流量为40~44mA,避光下电泳25min。(4)荧光染色:电泳后取出凝胶板,经15min去离子水浸洗,用质量浓度为2.5mg/L碘化丙啶(propidium iodid, PI)染液避光下染色20min。染色后的凝胶板经去离子水轻洗去除多余染料后,放入避光的密闭湿盒内,在48h内进行图像分析。(5)“彗星”图像分析:PI染色后的凝胶板,用吸湿纸吸干载玻片的多余水分,置于Nicon倒置荧光显微镜下,通过与之连接的图像分析系统进行图像测量和数据分析(图像分析系统由北京大恒图像视觉有限公司研制)。一个典型的受损细胞即“彗星”图像包括了头和尾部。DNA损伤的程度是采用计算机软件自动检测分析,并以尾矩(tail moment,TM)作为检测DNA单链断裂的终指标。该指标被定义为:“彗星”头部和尾部各自分布的中心点间的距离与总体DNA在尾部的分数的乘积[1,3,4]。每个“彗星”细胞都被分别用相应计算机程序进行独立分析记录。每个受测样品至少观察100个“彗星”细胞,每一实验条件至少重复一次。
, 百拇医药
1.6 细胞存活曲线: 照射后细胞经5%CO2,37℃培养,12~14d后,无水乙醇固定,结晶紫染色,计数≥50个细胞的克隆集落,计算贴瓶率(PE)及存活率。
1. 7 统计方法:DNA损伤结果用t检验,细胞存活曲线用“多靶单击模型”拟和。
2 结果
2.1 辐射对人体肿瘤细胞系DNA的损伤:4种人肿瘤细胞系在相同实验条件下,X射线照射结果见表1。结果表明各细胞系的细胞在未接受X射线照射情况下,其DNA在实验操作过程中的人为损伤均极轻微,结果差异不大(P>0.05)。4Gy照射后DNA损伤比与同系未照射细胞有显著增加(P<0.01)。并随照射剂量的递增,其DNA损伤加重,尤其CNE-1细胞和Ec-109细胞二者呈良好的线性关系 (图1)。图2示CNE-1和GLC细胞的“彗星”尾随剂量增加的图像变化。在16Gy剂量点时CNE-1细胞的DNA损伤程度明显大于其它各细胞系(P<0.01),各细胞系DNA损伤程度依次为:CNE-1>Ec-109>GLC>BGC-823。鳞癌细胞DNA损伤程度大于腺癌,腺癌细胞系间尾矩大小差异无显著性意义 (P>0.05)。图3示4种人肿瘤细胞系由多靶单击模型S=1-[1-e(-D/Do)]N拟合的细胞存活曲线。CNE-1,Ec-109,GLC和BGC-823各细胞系的D。值分别为1.25,1.27,1.88和1.56Gy。将照射后细胞系的存活份数与相应剂量点下的“彗星”尾矩结果绘制成图4,图中可见两个评价指标间存在着良好的负相关性。
, 百拇医药
表1 X射线对人体肿瘤细胞系DNA损伤的检测结果(TM,
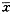 ±s) 细胞系
±s) 细胞系0Gy①
4Gy②
8Gy
12Gy
16Gy③
CNE-1
0.046±0.006
1.198±0.042
3.538±0.131
, http://www.100md.com
7.443±0.256
17.863±0.609
Ec-109
0.032±0.007
0.247±0.043
3.546±0.194
6.616±0.284
8.278±0.354
GLC
0.074±0.009
0.250±0.041
, 百拇医药
0.806±0.029
2.286±0.055
3.519±0.122
BGC-823
0.035±0.004
0.516±0.064
0.851±0.020
1.376±0.486
1.820±0.062
注:①细胞系间比较P>0.05,②与0Gy比较P<0.01,③CNE-1与各细胞系间比较P<0.01
, 百拇医药
2.2 辐射诱导人肿瘤细胞DNA单链断裂的修复:CNE-1和GLC细胞系,各自接受16Gy的X线照射后不同时间取样,以检测其DNA损伤后的修复,结果见图5所示。16Gy照射后,CNE-1细胞DNA的损伤程度明显大于GLC细胞系(P<0.01)。但GLC细胞的损伤后自身修复能力明显快于CNE-1细胞,损伤后仅5min即可检测到GLC细胞的修复。根据图5可分别计算CNE-1和GLC细胞系“彗星”尾矩降低至初始水平一半时的半修复时间,它们分别为7.4min和17.8min。从总体的修复程度上看,CNE-1细胞与GLC细胞相比,修复能力较差。

图1 X射线诱导4种细胞系的DNA损伤与剂量的关系
3 讨论
“彗星”分析法作为一种具有吸引力的肿瘤放射敏感性的临床检测方法,是由于它仅需少量肿瘤细胞(数千个细胞,通过针吸活检便可获得),当天便可得出测试结果。其结果可以反映肿瘤对某种治疗的敏感性、生长活跃和乏氧肿瘤细胞的比例以及肿瘤对治疗反应的异质性[5]。同时还可以将测试结果与标准的细胞存活曲线和其它电泳分析法进行比较。为证实“彗星”分析法能够作为一种快速检测肿瘤放射敏感性的方法,必须表明这种检测方法应与克隆形成率测定的放射敏感性有相关性。Nunez等[6]的实验结果显示放射诱导人肿瘤细胞DNA损伤的初水平和克隆形成率的放射敏感性有非常明显的一致性。本实验结果也证实4种人肿瘤细胞系对X射线照射后所诱导的DNA损伤,其检测敏感性较高,给予4Gy单次照射后,即可检测出SSB明显增高,与相应未照射细胞相比差异具有极显著性意义(P<0.01)。不同照射剂量可诱导不同程度的DNA损伤,其损伤程度与照射剂量间有良好的线性关系。这一结果与已报道采用“彗星”分析法在多种人癌或鼠细胞系所获得的结果一致[7,8]。从表1和图1中可看出CNE-1细胞对放射最为敏感,尾矩最大,存活份数最低。“彗星”分析法和细胞存活曲线的Do值都显示出相似的放射敏感性高低,依次为CNE-1>Ec-109>GLC>BGC-823。图4进一步表明由“彗星”分析法所测定的尾矩大小可以被用于预测不同人肿瘤细胞系的放射敏感性,放射对不同肿瘤细胞系DNA损伤的效应大小与克隆形成率间有良好的负相关性。对于体外单层培养的细胞系,尤其是处于指数生长期的细胞,尽管其来源不同,但对放射所引起的DNA反应程度大致相同,均与剂量间呈良好的线性关系[8]。这一点可解释本研究所观察到2种腺癌细胞系DNA损伤程度的差异无显著性意义(P>0.05)。从临床角度出发,实体肿瘤对放射治疗的反应性除了受瘤细胞内在放射敏感性的影响外,还与瘤体中不同的异质性细胞群体以及其所处的细胞周期、增殖动力学、所处的氧供条件等有关。因此应用“彗星”分析法对人实体肿瘤,尤其对特定的临床肿瘤患者来检测其瘤细胞对特定的放射治疗与化疗的反应将更具实际意义,这些已有详尽的论述与报道[2,5,9,10]。肿瘤细胞对放射或其它DNA诱变剂的反应性,除与其DNA的损伤程度有关外,还取决于其DNA损伤后的自身修复能力。本研究观察到CNE-1和GLC细胞系细胞在接受16GyX射线照射后,其半修复时间分别为17.4,7.4min。CNE-1细胞明显较GLC细胞的自身修复速度慢,表明CNE-1细胞受照后因自身修复能力较弱而对射线较敏感;而GLC细胞辐射后的自身修复较快,故对射线较为抗拒。该结果与其细胞存活曲线上Do值相一致。

, http://www.100md.com
图2 不同辐射剂量的“彗星”尾矩变化

图3 4种细胞系照射后的存活曲线

图4 不同细胞系照射后DNA损伤与细胞存活份数的关系

图5 16GyX射线诱导GLC和CNE-1细胞DNA
损伤后不同时间的修复变化
综上所述,本研究采用碱性“彗星”分析法,对4种肿瘤细胞DNA放射损伤及修复进行了检测,并与细胞存活曲线进行了比较。结果表明该检测方法能定量反映不同肿瘤细胞系对不同照射剂量所诱导的DNA损伤的不同反应,其损伤程度与放射剂量呈良好的线性关系,且与相应肿瘤细胞系的克隆形成率有较好的负相关性。它可以反映出不同肿瘤细胞系间的放射敏感性,且以鳞癌和腺间的差异最明显。该方法还可以检测出放射后DNA损伤的自身修复能力在不同受测时间中的定量变化情况,为预测放射敏感性提供了一项具有重要参考价值的指标。
, 百拇医药
参 考 文 献
1,Olive PL, Banath JP, Durand RE. Heterogeneity in radiation-induced DNA damage and repair in tumor and normal cells measured using the comet assay. Radiat Res,1990,122:86-94.
2,Huang P, Olive PL, Durand RE. Use of the comet assay for assessment of drug resistance and its modulation in vivo. Br J Cancer,1998,77:412-416.
3, Olive PL, Wlodek D, Durand RE, et al. Factors influencing DNA migration from individual cells subjected to gel electrophoresis. Exp Cell Res.1992,198:259-267.
, http://www.100md.com
4,Olive PL, Banath JP. Induction and rejoining of radiation-induced DNA single-strand breaks: "tail moment" as a function of position in the cell cycle. Mutation Res,1993(1),294:275-283.
5,Olive PL, LeRiche, Jackson SJ. Growth fraction of human tumors: assays and complication. Semi Radiat Oncol, 1993,7:90-98.
6,Nunez MI, McMillan TJ, Valenzuela MT, et al. Relationship between DNA damage, rejoining and cell killing by radiation in mammalian cells. Radiother oncol,996,39:155-165.
, 百拇医药
7,Olive PL, Banath JP, Mac Phail HS. Lack of correlation between radiosensitivity and DNA doulde-strand break, inductions or rejoining in six human tumor cell lines. ancer Res,1994,54:3939-3946.
8,Hu Q, Kavangh MC, Newcombe D, et al. Detection of hypoxic fraction in murine tumors by comet assay: comparison with other techniques. Radiat Res,1995,144: 266-273.
9,Fairbairn DW,Olive PL, O'Neill KL. The comet assay:a comprehensive review. Mutation Res,1995,339:37-59.
10,Olive PL, Durand RF, Le-Riche J,et al. Gel electrophoresis of individual cell to quantity hypoxic fraction in human breast cancer. Cancer Res,1993,53:733-736.
(收稿日期:1999-11-08), http://www.100md.com