HPV16L1重组蛋白在甲醇营养型酵母菌中的诱导表达及鉴定
作者:李秀荣 谷鸿喜 曲章义 张凤民 郭彩玲
单位:李秀荣(哈尔滨医科大学 微生物学教研室,黑龙江 哈尔滨 150086); 谷鸿喜(哈尔滨医科大学 微生物学教研室,黑龙江 哈尔滨 150086); 曲章义(哈尔滨医科大学 微生物学教研室,黑龙江 哈尔滨 150086); 张凤民(哈尔滨医科大学 微生物学教研室,黑龙江 哈尔滨 150086); 郭彩玲(哈尔滨医科大学 微生物学教研室,黑龙江 哈尔滨 150086)
关键词:HPV16L1;重组蛋白;诱导表达
哈尔滨医科大学学报000102 摘 要:目的 HPV16L1重组蛋白的表达为研制HPV16L1预防性蛋白疫苗及诊断试剂盒打下基础。方法 pPIC3.5-HPV16L1/GS115阳性菌株,经0.5%甲醇诱导,运用SDS-PAGE电泳检测L1蛋白;用鼠抗HPV16L1单克隆抗体,经Western Blotting检测蛋白的特异性;在透射电镜下观察类病毒颗粒(VLPs)。结果 SDS-PAGE检测结果表明,在55KD处有诱导蛋白带的出现;经Western Blotting验证,该蛋白能与HPV16L1单克隆抗体特异结合,证明该蛋白确为HPV16L1蛋白;电镜下见到了直径约为50nm、形态结构与天然病毒颗粒极其相似的VLPs。结论 pAIC3.5-HPV16L1重组质粒在甲醇营养型酵母菌中可经甲醇诱导产生HPV16L1晚期蛋白,该蛋白在酵母菌中可自我组装成VLPs。
, 百拇医药
分类号:R730.231+3 文献标识码:A
文章编号:1000-1905(2000)01-0003-03
Induction expression and identification of HPV16 late protein L1 in pichia pastoris
LI Xiu-rong GU Hong-xi QU Zhang-yi et al
(Department of Microbiology,Harbin Medical University,Harbin 150086,China)
Abstract:Objective To express the HPV16L1 protein for developing the diagnosis kit and preventive vaccine which is against HPV infection.Methods The positive strains GS115,which contained the recombinant plasmid pPI 3.5-HPV16L1,were induced with 0.5% methanol and expressed the L1 protein encoded by HPV16L1 gene in methanol-trophic yeast P.pastoris expression system.Expressed L1 protein was analyzed by SDS-PAGE.The Western blotting was employed to identify the L1 protein with HPV16L1 specific monoclonal antibody.The VLPs particles were observed under EM.Results The HPV16L1 protein could be induced with methanol in pichia pastoris.The molecular weight of the expressed protein,analyzed by SDS-PAGE,was 55KD.The Western blotting result showed that the expressed protein could be detected by HPV specific monoclonal antibody.Its molecular weight was 55KD which was same as the result of SDS-PAGE.The VLPs particles,which diameter was about 50 nm,could be observed under EM and the VLPs were similar to the natural virus particle both in structure and morphology.Conclusion The recombinant plasmid pPIC3.5-HPV16L1 could be induced to express the HPV16 late protein L1 by methanol in methanol-trophic yeast expression system.The L1 protein expressed could assemble automatously to form the VLPs.
, 百拇医药
Key words: HPV16L1;recombinant protein;induction expression▲
人乳头瘤病毒(Human papillomavirus,HPV)属乳头多瘤空泡病毒科乳头瘤病毒属,它具有严格的种属特异性,不能在动物体内感染,也不能做体外细胞培养。因此,对于HPV的研究,主要应用基因克隆及分子杂交方法。现已确定HPV有75个型别[1],根据它对细胞的转化能力可分为高危组和低危组,低危组主要引起人类多种良性皮肤和粘膜乳头状瘤或疣,高危组则与癌症尤其是宫颈癌密切相关。在我国,与宫颈癌发生关系最密切的是HPV16[2]。HPV为双股环状DNA,由3个基因区组成。按功能可分为早期区(E区)、晚期区(L区)和上游调节区(URR)[3]。E区与病毒复制、转录、转化细胞及致癌性有关;L区包括L1和L2,分别编码病毒的主要衣壳蛋白和次要衣壳蛋白,L1编码病毒的主要衣壳蛋白能刺激机体产生保护性抗体[4],保护机体不受同型别HPV的感染。因此,目前认为HPVL1基因是制备HPV基因工程疫苗的理想DNA片段。本研究将pPIC3.5-HPV16L1重组质粒在甲醇营养型酵母菌中进行了诱导表达,并对表达产物进行了特异性鉴定,现将实验方法和结果报告如下。
, 百拇医药
1 材料与方法
1.1 菌株
pPIC3.5-HPV16L1/GS115重组菌株,由微生物教研室谷鸿喜[5]构建并保存;GS115酵母菌株,由美国Invitrogen提供。
1.2 主要试剂及其配制
鼠抗HPV16L1单克隆抗体为美国Pharmingen公司产品;碱性磷酸酶标记的羊抗鼠二抗为Sigma产品;MGY培养基(增殖重组菌株用)、MM培养基(L1蛋白诱导表达用)均按pichia pastoris expression kit提供方法进行配制。SDS-PAGE电泳及Western blotting所用试剂均按《分子克隆实验指南》进行配制。
1.3 HPV16L1重组蛋白诱导表达
, http://www.100md.com
将筛选出的pPIC3.5-HPV16L1阳性转化株经MGY液体培养基增菌至OD600=2~6时,离心并用MM液体培养基重悬细胞团,30℃继续振摇培养,每天滴加甲醇使其终浓度为0.5%,以维持诱导表达,在不同时间(0、1、2、3、4、5、6天)分别取菌液0.5ml,离心后冻存细胞团并贮存于-60℃。
1.4 SDS-PAGE电泳
冻存的细胞团反复冻融后,采用玻璃珠机械破碎法,取裂解液上清行SDS-PAGE电泳,同时以GS115、pPCI3.5-HPV16L1/GS115未诱导为对照。电泳结束后取下凝胶进行考马斯亮蓝染色及脱色,并照相。
1.5 Western blotting
样品的制备及SDS-PAGE电脉,同上。蛋白质转移条件是恒流200mA、4℃、2h。一抗采用HPV16L1单克隆抗体,二抗采用碱性磷酸酶标记羊抗鼠抗体;在碱性磷酸酶生色底物中显色并照相。
, 百拇医药
1.6 电镜观察
将Western blotting阳性菌株诱导3天后,取0.2ml菌液离心,细胞团用2.5%戌二醛固定,送电镜室包埋,切片,寻找VLPs并照相。
2 结果
2.1 pPIC3.5-HPV16L1/GS115重组菌诱导表达蛋白的初步鉴定
将上述重组阳性菌株,经增菌、诱导表达后,提取蛋白进行SDS-PAGE电泳,结果3号及43号菌株在55KD处有诱导蛋白带出现,与预计相符,见图1。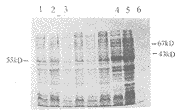
图1 HPV16L1重组蛋白SDS-PAGE结果
1.GS115菌株 2.未经诱导3号菌株 3.未经诱导的43号菌株 4.诱导后3号菌株 5.诱导后43号菌株
, 百拇医药
2.2 Western blotting电泳结果
经Western blotting对诱导表达蛋白的特异性进一步鉴定,取上述阳性表达株(3号、43号)提取的蛋白,经常规Western blotting实验,用鼠抗HPV16L1单克隆抗体进行免疫反应,结果出现了特异结合带,分子量约为55KD,与诱导蛋白带相符,结果如图2所示。
图2 HPV16L1重组蛋白Western blotting结果
1.标准蛋白分子量 2.GS115菌株 3.未经诱导3号菌株 4.诱导后3号菌株 5.诱导后43号菌株
2.3 电镜观察结果
电镜下可见直径约为50nm散在的类病毒颗粒(VLPs)的存在,如图3所示。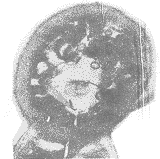
, 百拇医药
图3 HPV16L1 VLPs颗粒的电镜观察(×50 000)
3 讨论
研究表明,HPV16L1属于与宫颈癌发生发展密切相关的高危型别,流行病学调查表明,90%的宫颈癌组织中可检测出某一型别的HPV[6]。由于宫颈癌严重威胁妇女健康,其死亡率占妇女恶性肿瘤的第二位,目前对于宫颈癌又无有效的防治办法,因此研制HPV16预防性疫苗,防止宫颈癌的发生,意义重大。到目前为止,HPV仍不能经组织培养大量增殖,故有关HPV16预防性疫苗的研制,只有通过基因工程手段才能实现。
制备基因工程疫苗,目的基因的选择很重要。目前关于HPV基因工程疫苗目的基因的研究主要集中在E6、E7早期基因和L1晚期基因上。由于E6、E7基因易于整合到宿主细胞染色体上,存在潜在的致癌性,因而目前国际上研究的热点又集中在L1晚期基因上。L1基因编码的主要衣壳蛋白能刺激机体产生保护性抗体,可避免机体再受同型别HPV的感染。本文研究课题选择了HPV16L1基因,通过基因重组构建了酵母表达系统,并对表达的重组基因蛋白进行了一系列的研究,为研制基因工程蛋白疫苗奠定了基础。
, 百拇医药
对于基因工程蛋白疫苗的研制,除了目的基因的选择外,重组蛋白表达系统的选择也同样重要。原核表达系统所诱导表达出的L1蛋白其天然构象发生变化,抗原性亦可发生改变,影响有效地刺激机体产生高滴度保护性抗体;而真核表达系统所表达的L1蛋白,可自我组装成类病毒颗粒(VLPs)。大量研究已表明,VLPs具有良好的免疫原性和反应性,可诱导机体产生高滴度的中和抗体,故以此为基础来研制疫苗很有前途。目前国际上研究较多,适合工业化生产的是酵母表达系统,它不仅具有原核表达系统快捷、方便、费用低等优点,还兼有真核表达系统的翻译后加工、修饰等特点,使表达的L1蛋白能自我组装成VLPs,具有良好的抗原性。本研究选择P.pastoris酵母表达系统,经甲醇诱导表达出了分子量约为55KD的蛋白,经Western blotting进一步鉴定,该蛋白能与鼠抗HPV16L1单克隆抗体结合,出现特异反应带,证明该蛋白确实为HPV16L1重组体表达的蛋白。电镜观察结果表明,该蛋白在酵母菌内能自我组装成病毒样颗粒(VLPs),直径约为50nm,与HPV天然病毒颗粒极其相似,所有这些工作,都为研制HPV16L1重组蛋白疫苗和诊断试剂盒打下了基础。■
, http://www.100md.com
基金项目:黑龙江省科委重大攻关课题(编号G98-C0803)
作者简介:李秀荣(1967-),女,主治医师,硕士,现在解放军211医院工作
参考文献:
[1]De Bruijn ML,et al.L1-specific protection from tumor challenge elicited by HPV16 virus-like particles[J].Virology,1998,250(2):371-6.
[2]Murakami M,et al.Human papillomavirus vaccines for cervical cancer[J].J Immunother,1999,22(3):212-8.
[3]Lowy DR,et al.Papillomaviruses and cervical cancer:pathogenesis and vaccine development[J].J Natl Cancer Inst Monogr,1998,(23):27-30.
, http://www.100md.com
[4]Schiller JT.Papillomavirus-like particle vaccines for cervical cancer[J].Mol Med Today,1999,5(5):209-15.
[5]谷鸿喜,凌虹,隋丽华,等.中国妇女宫颈癌组织中HPV16L1晚期基因克隆及重组质粒的构建[J].哈尔滨医科大学学报,1997,31(5):356-359.
[6]Wheeler CM.Preventive vaccines for cervical cancer[J].Salud Publica Mex,1997,39(4):283-7.
收稿日期:1999-12-10, 百拇医药
单位:李秀荣(哈尔滨医科大学 微生物学教研室,黑龙江 哈尔滨 150086); 谷鸿喜(哈尔滨医科大学 微生物学教研室,黑龙江 哈尔滨 150086); 曲章义(哈尔滨医科大学 微生物学教研室,黑龙江 哈尔滨 150086); 张凤民(哈尔滨医科大学 微生物学教研室,黑龙江 哈尔滨 150086); 郭彩玲(哈尔滨医科大学 微生物学教研室,黑龙江 哈尔滨 150086)
关键词:HPV16L1;重组蛋白;诱导表达
哈尔滨医科大学学报000102 摘 要:目的 HPV16L1重组蛋白的表达为研制HPV16L1预防性蛋白疫苗及诊断试剂盒打下基础。方法 pPIC3.5-HPV16L1/GS115阳性菌株,经0.5%甲醇诱导,运用SDS-PAGE电泳检测L1蛋白;用鼠抗HPV16L1单克隆抗体,经Western Blotting检测蛋白的特异性;在透射电镜下观察类病毒颗粒(VLPs)。结果 SDS-PAGE检测结果表明,在55KD处有诱导蛋白带的出现;经Western Blotting验证,该蛋白能与HPV16L1单克隆抗体特异结合,证明该蛋白确为HPV16L1蛋白;电镜下见到了直径约为50nm、形态结构与天然病毒颗粒极其相似的VLPs。结论 pAIC3.5-HPV16L1重组质粒在甲醇营养型酵母菌中可经甲醇诱导产生HPV16L1晚期蛋白,该蛋白在酵母菌中可自我组装成VLPs。
, 百拇医药
分类号:R730.231+3 文献标识码:A
文章编号:1000-1905(2000)01-0003-03
Induction expression and identification of HPV16 late protein L1 in pichia pastoris
LI Xiu-rong GU Hong-xi QU Zhang-yi et al
(Department of Microbiology,Harbin Medical University,Harbin 150086,China)
Abstract:Objective To express the HPV16L1 protein for developing the diagnosis kit and preventive vaccine which is against HPV infection.Methods The positive strains GS115,which contained the recombinant plasmid pPI 3.5-HPV16L1,were induced with 0.5% methanol and expressed the L1 protein encoded by HPV16L1 gene in methanol-trophic yeast P.pastoris expression system.Expressed L1 protein was analyzed by SDS-PAGE.The Western blotting was employed to identify the L1 protein with HPV16L1 specific monoclonal antibody.The VLPs particles were observed under EM.Results The HPV16L1 protein could be induced with methanol in pichia pastoris.The molecular weight of the expressed protein,analyzed by SDS-PAGE,was 55KD.The Western blotting result showed that the expressed protein could be detected by HPV specific monoclonal antibody.Its molecular weight was 55KD which was same as the result of SDS-PAGE.The VLPs particles,which diameter was about 50 nm,could be observed under EM and the VLPs were similar to the natural virus particle both in structure and morphology.Conclusion The recombinant plasmid pPIC3.5-HPV16L1 could be induced to express the HPV16 late protein L1 by methanol in methanol-trophic yeast expression system.The L1 protein expressed could assemble automatously to form the VLPs.
, 百拇医药
Key words: HPV16L1;recombinant protein;induction expression▲
人乳头瘤病毒(Human papillomavirus,HPV)属乳头多瘤空泡病毒科乳头瘤病毒属,它具有严格的种属特异性,不能在动物体内感染,也不能做体外细胞培养。因此,对于HPV的研究,主要应用基因克隆及分子杂交方法。现已确定HPV有75个型别[1],根据它对细胞的转化能力可分为高危组和低危组,低危组主要引起人类多种良性皮肤和粘膜乳头状瘤或疣,高危组则与癌症尤其是宫颈癌密切相关。在我国,与宫颈癌发生关系最密切的是HPV16[2]。HPV为双股环状DNA,由3个基因区组成。按功能可分为早期区(E区)、晚期区(L区)和上游调节区(URR)[3]。E区与病毒复制、转录、转化细胞及致癌性有关;L区包括L1和L2,分别编码病毒的主要衣壳蛋白和次要衣壳蛋白,L1编码病毒的主要衣壳蛋白能刺激机体产生保护性抗体[4],保护机体不受同型别HPV的感染。因此,目前认为HPVL1基因是制备HPV基因工程疫苗的理想DNA片段。本研究将pPIC3.5-HPV16L1重组质粒在甲醇营养型酵母菌中进行了诱导表达,并对表达产物进行了特异性鉴定,现将实验方法和结果报告如下。
, 百拇医药
1 材料与方法
1.1 菌株
pPIC3.5-HPV16L1/GS115重组菌株,由微生物教研室谷鸿喜[5]构建并保存;GS115酵母菌株,由美国Invitrogen提供。
1.2 主要试剂及其配制
鼠抗HPV16L1单克隆抗体为美国Pharmingen公司产品;碱性磷酸酶标记的羊抗鼠二抗为Sigma产品;MGY培养基(增殖重组菌株用)、MM培养基(L1蛋白诱导表达用)均按pichia pastoris expression kit提供方法进行配制。SDS-PAGE电泳及Western blotting所用试剂均按《分子克隆实验指南》进行配制。
1.3 HPV16L1重组蛋白诱导表达
, http://www.100md.com
将筛选出的pPIC3.5-HPV16L1阳性转化株经MGY液体培养基增菌至OD600=2~6时,离心并用MM液体培养基重悬细胞团,30℃继续振摇培养,每天滴加甲醇使其终浓度为0.5%,以维持诱导表达,在不同时间(0、1、2、3、4、5、6天)分别取菌液0.5ml,离心后冻存细胞团并贮存于-60℃。
1.4 SDS-PAGE电泳
冻存的细胞团反复冻融后,采用玻璃珠机械破碎法,取裂解液上清行SDS-PAGE电泳,同时以GS115、pPCI3.5-HPV16L1/GS115未诱导为对照。电泳结束后取下凝胶进行考马斯亮蓝染色及脱色,并照相。
1.5 Western blotting
样品的制备及SDS-PAGE电脉,同上。蛋白质转移条件是恒流200mA、4℃、2h。一抗采用HPV16L1单克隆抗体,二抗采用碱性磷酸酶标记羊抗鼠抗体;在碱性磷酸酶生色底物中显色并照相。
, 百拇医药
1.6 电镜观察
将Western blotting阳性菌株诱导3天后,取0.2ml菌液离心,细胞团用2.5%戌二醛固定,送电镜室包埋,切片,寻找VLPs并照相。
2 结果
2.1 pPIC3.5-HPV16L1/GS115重组菌诱导表达蛋白的初步鉴定
将上述重组阳性菌株,经增菌、诱导表达后,提取蛋白进行SDS-PAGE电泳,结果3号及43号菌株在55KD处有诱导蛋白带出现,与预计相符,见图1。

图1 HPV16L1重组蛋白SDS-PAGE结果
1.GS115菌株 2.未经诱导3号菌株 3.未经诱导的43号菌株 4.诱导后3号菌株 5.诱导后43号菌株
, 百拇医药
2.2 Western blotting电泳结果
经Western blotting对诱导表达蛋白的特异性进一步鉴定,取上述阳性表达株(3号、43号)提取的蛋白,经常规Western blotting实验,用鼠抗HPV16L1单克隆抗体进行免疫反应,结果出现了特异结合带,分子量约为55KD,与诱导蛋白带相符,结果如图2所示。

图2 HPV16L1重组蛋白Western blotting结果
1.标准蛋白分子量 2.GS115菌株 3.未经诱导3号菌株 4.诱导后3号菌株 5.诱导后43号菌株
2.3 电镜观察结果
电镜下可见直径约为50nm散在的类病毒颗粒(VLPs)的存在,如图3所示。

, 百拇医药
图3 HPV16L1 VLPs颗粒的电镜观察(×50 000)
3 讨论
研究表明,HPV16L1属于与宫颈癌发生发展密切相关的高危型别,流行病学调查表明,90%的宫颈癌组织中可检测出某一型别的HPV[6]。由于宫颈癌严重威胁妇女健康,其死亡率占妇女恶性肿瘤的第二位,目前对于宫颈癌又无有效的防治办法,因此研制HPV16预防性疫苗,防止宫颈癌的发生,意义重大。到目前为止,HPV仍不能经组织培养大量增殖,故有关HPV16预防性疫苗的研制,只有通过基因工程手段才能实现。
制备基因工程疫苗,目的基因的选择很重要。目前关于HPV基因工程疫苗目的基因的研究主要集中在E6、E7早期基因和L1晚期基因上。由于E6、E7基因易于整合到宿主细胞染色体上,存在潜在的致癌性,因而目前国际上研究的热点又集中在L1晚期基因上。L1基因编码的主要衣壳蛋白能刺激机体产生保护性抗体,可避免机体再受同型别HPV的感染。本文研究课题选择了HPV16L1基因,通过基因重组构建了酵母表达系统,并对表达的重组基因蛋白进行了一系列的研究,为研制基因工程蛋白疫苗奠定了基础。
, 百拇医药
对于基因工程蛋白疫苗的研制,除了目的基因的选择外,重组蛋白表达系统的选择也同样重要。原核表达系统所诱导表达出的L1蛋白其天然构象发生变化,抗原性亦可发生改变,影响有效地刺激机体产生高滴度保护性抗体;而真核表达系统所表达的L1蛋白,可自我组装成类病毒颗粒(VLPs)。大量研究已表明,VLPs具有良好的免疫原性和反应性,可诱导机体产生高滴度的中和抗体,故以此为基础来研制疫苗很有前途。目前国际上研究较多,适合工业化生产的是酵母表达系统,它不仅具有原核表达系统快捷、方便、费用低等优点,还兼有真核表达系统的翻译后加工、修饰等特点,使表达的L1蛋白能自我组装成VLPs,具有良好的抗原性。本研究选择P.pastoris酵母表达系统,经甲醇诱导表达出了分子量约为55KD的蛋白,经Western blotting进一步鉴定,该蛋白能与鼠抗HPV16L1单克隆抗体结合,出现特异反应带,证明该蛋白确实为HPV16L1重组体表达的蛋白。电镜观察结果表明,该蛋白在酵母菌内能自我组装成病毒样颗粒(VLPs),直径约为50nm,与HPV天然病毒颗粒极其相似,所有这些工作,都为研制HPV16L1重组蛋白疫苗和诊断试剂盒打下了基础。■
, http://www.100md.com
基金项目:黑龙江省科委重大攻关课题(编号G98-C0803)
作者简介:李秀荣(1967-),女,主治医师,硕士,现在解放军211医院工作
参考文献:
[1]De Bruijn ML,et al.L1-specific protection from tumor challenge elicited by HPV16 virus-like particles[J].Virology,1998,250(2):371-6.
[2]Murakami M,et al.Human papillomavirus vaccines for cervical cancer[J].J Immunother,1999,22(3):212-8.
[3]Lowy DR,et al.Papillomaviruses and cervical cancer:pathogenesis and vaccine development[J].J Natl Cancer Inst Monogr,1998,(23):27-30.
, http://www.100md.com
[4]Schiller JT.Papillomavirus-like particle vaccines for cervical cancer[J].Mol Med Today,1999,5(5):209-15.
[5]谷鸿喜,凌虹,隋丽华,等.中国妇女宫颈癌组织中HPV16L1晚期基因克隆及重组质粒的构建[J].哈尔滨医科大学学报,1997,31(5):356-359.
[6]Wheeler CM.Preventive vaccines for cervical cancer[J].Salud Publica Mex,1997,39(4):283-7.
收稿日期:1999-12-10, 百拇医药