睫状神经营养因子防治强脉冲噪声对豚鼠内耳损伤的实验研究
作者:周义德 翟所强 杨伟炎 姜泗长 孙爱华 李兆基 周水淼 沈小华 何成
单位:翟所强、杨伟炎、姜泗长 北京 解放军总医院耳鼻咽喉科 100853;周义德 现在上海 第二军医大学长海医院、孙爱华、李兆基、周水淼、沈小华 第二军医大学长海医院耳鼻咽喉科, 何成 神经生物学教研室
关键词:神经生长因子;;耳蜗;;噪声;;爆震伤;;听觉丧失;噪声性
中华耳鼻咽喉科杂志990307 【摘要】 目的 探索应用睫状神经营养因子(ciliary neurotrophic factor ,CNTF)防治强脉冲噪声对豚鼠内耳损伤的可能性,为强脉冲噪声致聋的防治提供新的方法。方法 制作强脉冲噪声致聋豚鼠模型36只,18只应用CNTF肌内注射3周,18只等量的生理盐水作对照,正常对照豚鼠18只,进行耳蜗铺片计算机图像分析毛细胞计数,螺旋神经节细胞计数、耳蜗乙酰胆碱酯酶染色铺片观察和ABR反应阈测定。结果 正常对照组、噪声暴露后21 d的生理盐水对照组和CNTF组耳蜗毛细胞平均总数( ±s,下同)分别为9 094±103.6、7 351±196.5、8 522±203.1;而螺旋神经节细胞计数在耳蜗中轴切片第二回下段3组间差异有显著性,分别为51±4.72、27±6.94、37±10.4。乙酰胆碱酯酶染色铺片结果示CNTF组较生理盐水对照组耳蜗乙酰胆碱酯酶活性损失轻、范围小。结论 CNTF在一定程度上能防止受损的螺旋神经节细胞及外毛细胞发生变性坏死,并可能促进其损伤的修复。
±s,下同)分别为9 094±103.6、7 351±196.5、8 522±203.1;而螺旋神经节细胞计数在耳蜗中轴切片第二回下段3组间差异有显著性,分别为51±4.72、27±6.94、37±10.4。乙酰胆碱酯酶染色铺片结果示CNTF组较生理盐水对照组耳蜗乙酰胆碱酯酶活性损失轻、范围小。结论 CNTF在一定程度上能防止受损的螺旋神经节细胞及外毛细胞发生变性坏死,并可能促进其损伤的修复。
, 百拇医药
The protective effects of ciliary neurotrophic factor on inner ear damage induced by intensive impulse noise
ZHOU Yide,ZHAI Suoqiang,YANG Weiyan,et al. Department of Otorhinolaryngology, General Hospital of PLA, Beijing 100853
【Abstract】 Objective To evaluate the feasibility of using ciliary neurotrophic factor(CNTF) to treat intensive impulse noise-induced inner ear damage. Methods The guinea pigs were given either CNTF (CNTF group) or 0.9% sodium chloride (NS group) for 3 weeks after impulse noise exposure. The animals receiving neither medicine nor noise served as a control group. ABR threshold shifts, the cochlear AchE staining as well as the hair cell and spiral ganglion cell counting were carried out in three groups of animals. Results The numbers of damaged hair cells and spiral ganglion cells in the CNTF group was less than that in the NS group. AchE activity alteration was also less severe in the CNTF group. Similar to the morphological results, changes in the auditory function, represented by the ABR threshold shifts, was less in the CNTF group. Conclusion CNTF can protect cochlear hair cells and spiral ganglion cells against intensive impulse noise exposure by decreasing degeneration and necrosis of the hair cells in some extent and expedite hearing recovery.
, 百拇医药
【Key words】 Nerve growth factors Cochlea Noise Blast injuries Hearing loss,noise-induced
睫状神经营养因子(ciliary neurotrophic factor,CNTF)是多功能生长因子,最近几年的研究表明[1-3]CNTF对感觉神经元、运动神经元、海马胆碱能神经元、黑质多巴胺能神经元等均有促进存活及防止损伤作用,同时在神经系统发育、分化及损伤修复中也发挥重要作用。强脉冲噪声对内耳Corti器及螺旋神经节细胞都具有明显损害作用。本实验尝试应用CNTF来防治内耳声损伤,报道如下。
材料及方法
1. 动物的选择及分组:选用耳廓反射正常,体重200 g左右健康无中耳炎杂种豚鼠54只,随机分为3组,即正常对照组、生理盐水对照组和CNTF组,各18只。
, 百拇医药
2. 噪声源:强脉冲噪声声源系由特制的D-86电火花脉冲发生器(上海江湾一厂)产生。生理盐水对照组和CNTF组每只动物暴露80次,间隔2 s,脉宽0.5 ms,压力峰值172.0 dB SPL,正常对照组不接受噪声。
3. 试剂和给药:重组人CNTF制备按文献方法进行[4],由第二军医大学神经生物学教研室提供。生理盐水由解放军总医院制剂室提供。CNTF组噪声暴露后当天开始肌内注射CNTF每次0.22 mg/kg体重, 每日2次,共21 d;生理盐水对照组噪声暴露后当天开始肌内注射生理盐水每次2 ml/kg体重, 每日2次,共21 d。
4. ABR反应阈测定:用豚鼠固定装置固定豚鼠,用Madsenson-2250型脑干听觉诱发电位测试仪测定豚鼠清醒状态下听性脑干电位(auditory brainstem response,ABR)反应阈值,记录电极置颅顶正中部,参考电极和接地电极分别置于同侧和对侧耳廓。噪声暴露前后测试时电极放置位点相同。刺激声为宽频带短声(click),脉冲宽度为0.1 ms,扫描时程10 ms,叠加256次。以出现最稳定的I波刚消失时的刺激声压级作为该耳的听反应阈。两组实验豚鼠分别测定噪声暴露前及其后即刻、3 d和21 d的ABR阈值,正常对照组则在对应时间测试。
, 百拇医药
5. 琥珀酸脱氢酶染色铺片和计算机毛细胞计数:噪声暴露后21 d两试验组和对照组各取9只动物在麻醉状态下断头处死,快速取出左侧耳蜗并进行蜗管内灌注氯化硝基四氮唑蓝配制的琥珀酸脱氢酶作用液,37 ℃温箱内孵育60 min,固定,脱钙后解剖显微镜下剥去蜗壳,按Stockwell等[5]介绍的方法,制备耳蜗铺片标本。耳蜗毛细胞计数采用计算机图像分析处理。图像处理工作站包括1台MMX奔腾计算机加DT-2851、DF-2858图像板,1台彩色显示器、1块HIPAD plus数字化板、1台摄像机和1台显微镜。毛细胞计数是先测量从钩回到顶回基底膜上各回每排毛细胞的长度,再根据各回每排单位长度内毛细胞个数计算出各回毛细胞数,各回相加即得到毛细胞总数。
6. 螺旋神经节细胞计数:噪声暴露后21 d两试验组和对照组动物各取9只在麻醉状态下断头处死,快速取出右侧耳蜗并进行蜗管内灌注10%甲醛并固定于该液24 h,10%甲酸脱钙72 h,石蜡包埋,制作7μm厚连续中轴切片,HE染色。光镜下豚鼠耳蜗可见钩回,与耳蜗第1~4回对应的蜗螺旋管内螺旋神经节部位,由蜗底到蜗顶依次称为一下、一上、二下、二上、三下、三上、四。按文献[6]所述方法稍加改进,目镜加网格片,在40×10放大倍数下直接计数蜗螺旋管中有核神经节细胞数,每只耳蜗连续计数5张中轴切片,取其均值。
, http://www.100md.com
7. 耳蜗乙酰胆碱酯酶染色及铺片:噪声暴露后21 d试验组和对照组各取9只动物均在麻醉状态下断头处死,快速取出右侧耳蜗并进行蜗管内灌注2.5%戊二醛并将耳蜗置于该液中,在0~4 ℃冰箱内连续固定4 h,10%乙二胺四乙酸(ethylene-diaminotetraacetic acid ,EDTA)脱钙4 d后,于0.1 mol/L磷酸缓冲液中解剖显微镜下去除蜗壳,充分暴露各回Corti器。按Karnovsky等[7]所述硫胆碱-亚铁氰化铜反应显示胆碱酯酶的方法稍加改进后进行耳蜗组织化学反应,制备耳蜗铺片标本,光镜下观察诸耳蜗乙酰胆碱酯酶染色情况。
8. 统计学方法:各组均数的统计学处理均用t检验,以P<0.05为差异有显著性意义;P<0.01为差异有极显著性意义。
结果 1. 3组豚鼠ABR反应阈值变化见表1。
表1 3组豚鼠在实验不同时间的平均
, 百拇医药
ABR反应阈值( ±s dB SPL) 组别
±s dB SPL) 组别
例数
暴露前
暴露即刻
暴露后3 d
暴露后21 d
正常对照组
18
39.0±3.82
39.0±3.82
38.0±4.04
, 百拇医药
40.4±3.57
生理盐水组
18
37.5±3.04
93.5±6.93
84.5±6.56
80.0±8.94
CNTF组
18
38.5±2.96
95.0±7.38
80.5±6.15
, 百拇医药
68.5±9.62*
*与正常对照组21 d、生理盐水对照组 21 d和CNTF组3 d比较P<0.01
从表1可以看出,噪声暴露前各组豚鼠ABR阈值无差异,表明所用豚鼠各组间条件相同。CNTF组与生理盐水对照组噪声暴露后即刻ABR阈值相近,暴露后3 d有所差异,但无统计学意义;暴露后21 d,CNTF组ABR阈值比未暴露噪声的正常对照组要高,但低于生理盐水对照组,差异均有显著性。另外,CNTF组暴露后3 d与21 d的结果比较,差异也有显著性。
2. 3组豚鼠耳蜗琥珀酸脱氢酶染色毛细胞计数结果见表2。
表2 3组豚鼠实验后21 d毛细胞平均计数( ±s个) 组别
±s个) 组别
, http://www.100md.com
耳数
钩回
第一回
第二回
第三回
第四回
总数
正常对照组
9
1280±68.2
2693±108.5
2040±132.4
1636± 87.6
, http://www.100md.com
1446±112.7
9094±103.6*
生理盐水组
9
848±63.8
1943±210.4
1688±204.7
1511±112.3
1368±146.5
7351±196.5**
CNTF组
, 百拇医药
9
1020±87.7
2278±196.4
2012±217.3
1593±135.8
1432±138.2
8522±203.1
*与生理盐水对照组和CNTF组比较P<0.01 **与CNTF组比较P<0.01
耳蜗琥珀酸脱氢酶染色铺片见正常对照组各回均有整齐排列的3排外毛细胞和1排内毛细胞,毛细胞自然缺失率极少(图1);CNTF组和生理盐水对照组噪声暴露后21 d均出现程度不同的毛细胞缺失,其中生理盐水对照组毛细胞缺失更明显(图2)。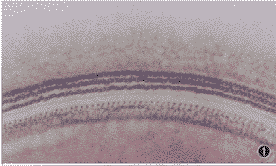
, 百拇医药
图1 正常对照组耳蜗琥珀酸脱氢酶染色铺片见整齐排列的3排外毛细胞和1排内毛细胞,毛细胞自然缺失率极少。×550
图2 生理盐水对照组噪声暴露后21 d耳蜗琥珀酸脱氢酶染色铺片可见明显的毛细胞缺失。×550
从表2可以看出,噪声暴露后21 d生理盐水对照组和CNTF组毛细胞减少主要在钩回、第一回、第二回,其中以第一回减少最明显。从总数来看,生理盐水对照组和CNTF组均有减少,但生理盐水对照组较CNTF组减少更加明显,差异有显著性。
3. 噪声暴露后21 d耳蜗螺旋神经节细胞计数结果见表3。
表3 实验后21 d耳蜗螺旋神经节细胞计数( ±s个) 组别
±s个) 组别
, 百拇医药
耳数
一下
一上
二下
二上
三下
三上
四
正常对照组
9
54±8.36
56±3.81*
51± 4.72*
, 百拇医药
42±2.96
41±2.83
43±5.10
41±2.97
生理盐水组
9
52±7.32
41±4.86
27± 6.94**
38±4.75
38±2.98
41±5.44
, http://www.100md.com
39±3.26
CNTF组
9
46±4.78
43±5.23
37±10.40
40±7.50
37±3.58
47±4.94
40±3.89
*与生理盐水对照组和CNTF组同部位比较P<0.01 **与CNTF组同部位比较P<0.05
, http://www.100md.com
从表3可以看出,噪声暴露后两实验组豚鼠螺旋神经节细胞数的减少主要发生在蜗螺旋管内螺旋神经节部位的一上和二下,与正常对照组比较差异有显著性;在二下生理盐水对照组比CNTF组减少更多,两组间差异有显著性。
4. 耳蜗乙酰胆碱酯酶染色结果:正常对照组豚鼠耳蜗乙酰胆碱酯酶活性主要分布于Corti器各回内毛细胞下的内螺旋束、隧道螺旋束、隧道上辐射纤维;第一和二回三排外毛细胞下的传出神经末梢;第三回外毛细胞下第一、二排神经末梢;第四回第一排外毛细胞的神经末梢乙酰胆碱酯酶终末反应产物(亚铁氰化铜)呈褐色,光镜下清晰可见(图3)。噪声暴露后耳蜗乙酰胆碱酯酶终末反应产物减少或消失,损伤主要分布在耳蜗一上和二下。通常将其分为3度:Ⅰ度:只有外毛细胞下大的神经末梢和隧道上辐射纤维乙酰胆碱酯酶终末反应产物减少或消失;Ⅱ度:外毛细胞下大的神经末梢、隧道螺旋束、隧道上辐射纤维乙酰胆碱酯酶终末反应产物均减少或消失;Ⅲ度:外毛细胞下大的神经末梢、隧道上辐射纤维、隧道螺旋束及内螺旋束乙酰胆碱酯酶终末反应产物均减少或消失。CNTF组9耳中以Ⅰ度损伤为主者3耳(图4),以Ⅱ度损伤为主者4耳(图5),以Ⅲ度损伤为主者2耳;生理盐水对照组以Ⅱ度损伤为主者4耳,以Ⅲ度损伤为主者5耳(图6)。
, 百拇医药
图3 正常对照组乙酰胆碱酯酶染色示耳蜗铺片乙酰胆碱酯酶终末反应产物呈褐色,分布于Corti器各回内毛细胞下的内螺旋束、隧道螺旋束、隧道上辐射纤维;外毛细胞下大的传出神经末梢。×550
图4 CNTF组乙酰胆碱酯酶染色示噪声暴露后I度损伤:只有外毛细胞下大的神经末梢和隧道上辐射纤维乙酰胆碱酯酶终末反应产物减少或消失。×550
图5 CNTF组乙酰胆碱酯酶染色示噪声暴露后II度损伤:外毛细胞下大的神经末梢、隧道螺旋束、隧道上辐射纤维乙酰胆碱酯酶终末反应产物均减少或消失。×550
图6 生理盐水对照组乙酰胆碱酯酶染色示噪声暴露后III度损伤:外毛细胞下大的神经末梢、隧道上辐射纤维、隧道螺旋束及内螺旋束乙酰胆碱酯酶终末反应产物均减少或消失。×550
, 百拇医药
讨论
CNTF能促进多种体外培养神经元成活,体内实验也表明CNTF能提高外周神经的传导功能,阻止受损神经元退行性变和促进横断神经纤维再生[8]。本实验在制作强脉冲噪声耳蜗损伤模型后,通过ABR测定、毛细胞计数及螺旋神经节细胞计数、耳蜗乙酰胆碱酯酶染色的方法,对CNTF的作用进行观察。实验结果显示,强脉冲噪声暴露后3周螺旋神经节细胞减少主要发生在蜗螺旋管内螺旋神经节部位的一上和二下,CNTF组的对应部位尽管螺旋神经节细胞数同正常对照组比较也有减少,但比生理盐水对照组多。乙酰胆碱酯酶染色结果也表明生理盐水对照组噪声暴露后耳蜗乙酰胆碱酯酶活性以Ⅲ度损伤为主;CNTF组主要以Ⅰ度和Ⅱ度损伤为主,少数区域有Ⅲ度损伤。强脉冲噪声对内耳损伤的机制是复杂的,既有机械性损伤,又有代谢性损伤;在代谢紊乱中,除物质代谢紊乱、能量代谢紊乱和氧代谢紊乱外,还有递质代谢紊乱,终末反应产物减少甚至消失,就意味着胆碱能神经突触功能下降或传导阻滞,Iurato等[9]认为乙酰胆碱酯酶活性未恢复则表示耳蜗传出神经系统的功能未恢复,而耳蜗乙酰胆碱酯酶阳性的传出神经对限制噪声所导致的听损伤极为重要。CNTF的作用一方面可能防止受损的耳蜗末梢神经及其传导通路发生变性坏死,另一方面可能促进受损神经的修复,从而使螺旋神经节细胞数仍能保持一定数量。
, 百拇医药
毛细胞计数结果还显示,强脉冲噪声暴露后毛细胞缺失主要发生在第一回和第二回下部,CNTF组毛细胞缺失较生理盐水对照组轻。在毛细胞将机械能转变成神经冲动传入听中枢时,听中枢亦有传出神经来支配毛细胞,耳蜗乙酰胆碱酯酶染色结果表明,CNTF组耳蜗的传出神经末梢乙酰胆碱酯酶活性损失较生理盐水对照组轻,而耳蜗传出神经系统在噪声防护过程中具有重要作用。耳蜗传出神经系统与受损毛细胞修复之间的关系有待进一步研究。
ABR检测结果显示,噪声暴露后21 d,CNTF组豚鼠的ABR阈值较生理盐水对照组低,且同组内21 d与3 d比较差异也有显著性,而生理盐水对照组未见此现象,说明CNTF在防止内耳Corti器及耳蜗末梢神经变性和促进损伤修复的同时,也促进了部分听功能的恢复。但是也应看到各组间ABR差异并不大,也可以说是听功能恢复并不理想,这除了与噪声本身过强而使耳蜗损伤过重等原因有关外,可能还与全身应用CNTF带来的副作用有关,因为在实验中我们发现CNTF组豚鼠食欲下降、体重减轻。
, 百拇医药
内耳发育过程中脑衍生物神经营养因子、神经营养素-3在毛细胞及前庭都有表达。目前尚不清楚在耳蜗毛细胞和听神经中是否存在CNTF及其受体。但有文献报道,在听觉系统发育过程中CNTF能促进听泡衍生因子对听泡神经节神经元轴突的生长作用[10]。有关CNTF通过内耳屏障及其在防治强脉冲噪声对豚鼠内耳损伤中的机制尚待进一步研究。
参考文献
1 Barbin G,Manthorpe M, Varon S. Purification of the chick eye ciliary neurotrophic factor. J Neurochem,1984,43:1468-1478.
2 Adler R. Ciliary neurotrophic factor as an injury factor.Curr Opin Neurobiol,1993,3:785-789.
, 百拇医药
3 Apfel SC, Arezzo JC, Moran M, et al. Effects of administration of ciliary neurotrophic factor on normal motor and sensory peripheral nerves in vivo. Brain Res,1993,604:1-6.
4 何成,陈江野,路长林,等.人睫状神经营养因子及突变体在大肠杆菌中的表达.生物化学与生物物理学报,1995,27:675-679.
5 Stockwell CW,Ades HW,Engstiom H.Patterns of hair cell damage after intense auditory stimulation. Ann Otol Rhinol Laryngol, 1969,78:1144-1168.
6 方耀云,姚行齐,姜泗长,等.老化豚鼠耳蜗毛细胞和螺旋神经节细胞定量研究.中国体视学与图像分析,1996,1:64-66.
, 百拇医药
7 Karnovsky MJ, Roots LA. A direct-coloring thiocholine method for cholinesterases. J Histochem Cytochem,1964,12:219-227.
8 Hagg T, Varon S. Ciliary neurotrophic factor prevents degeneration of adult rat substantia nigra dopaminergic neurons in vivo. Proc Natl Acad Sci USA, 1993,90:6315-6319.
9 Iurato S,Luciano L,Pannese E,et al.Histochemical localization of acetylcholinesterase(AChE) activity in the inner ear. Acta Otolaryngol Suppl,1971,279:1-50.
10 Bianchi LM,Cohan CS. Effects of the neurotrophins and CNTF on developing statoacoustic neurons: comparison with an otocyst-derived factor. Dev Biol,1993,159:353-365.
(收稿:1998-09-16 修回:1999-03-15), 百拇医药
单位:翟所强、杨伟炎、姜泗长 北京 解放军总医院耳鼻咽喉科 100853;周义德 现在上海 第二军医大学长海医院、孙爱华、李兆基、周水淼、沈小华 第二军医大学长海医院耳鼻咽喉科, 何成 神经生物学教研室
关键词:神经生长因子;;耳蜗;;噪声;;爆震伤;;听觉丧失;噪声性
中华耳鼻咽喉科杂志990307 【摘要】 目的 探索应用睫状神经营养因子(ciliary neurotrophic factor ,CNTF)防治强脉冲噪声对豚鼠内耳损伤的可能性,为强脉冲噪声致聋的防治提供新的方法。方法 制作强脉冲噪声致聋豚鼠模型36只,18只应用CNTF肌内注射3周,18只等量的生理盐水作对照,正常对照豚鼠18只,进行耳蜗铺片计算机图像分析毛细胞计数,螺旋神经节细胞计数、耳蜗乙酰胆碱酯酶染色铺片观察和ABR反应阈测定。结果 正常对照组、噪声暴露后21 d的生理盐水对照组和CNTF组耳蜗毛细胞平均总数(
 ±s,下同)分别为9 094±103.6、7 351±196.5、8 522±203.1;而螺旋神经节细胞计数在耳蜗中轴切片第二回下段3组间差异有显著性,分别为51±4.72、27±6.94、37±10.4。乙酰胆碱酯酶染色铺片结果示CNTF组较生理盐水对照组耳蜗乙酰胆碱酯酶活性损失轻、范围小。结论 CNTF在一定程度上能防止受损的螺旋神经节细胞及外毛细胞发生变性坏死,并可能促进其损伤的修复。
±s,下同)分别为9 094±103.6、7 351±196.5、8 522±203.1;而螺旋神经节细胞计数在耳蜗中轴切片第二回下段3组间差异有显著性,分别为51±4.72、27±6.94、37±10.4。乙酰胆碱酯酶染色铺片结果示CNTF组较生理盐水对照组耳蜗乙酰胆碱酯酶活性损失轻、范围小。结论 CNTF在一定程度上能防止受损的螺旋神经节细胞及外毛细胞发生变性坏死,并可能促进其损伤的修复。, 百拇医药
The protective effects of ciliary neurotrophic factor on inner ear damage induced by intensive impulse noise
ZHOU Yide,ZHAI Suoqiang,YANG Weiyan,et al. Department of Otorhinolaryngology, General Hospital of PLA, Beijing 100853
【Abstract】 Objective To evaluate the feasibility of using ciliary neurotrophic factor(CNTF) to treat intensive impulse noise-induced inner ear damage. Methods The guinea pigs were given either CNTF (CNTF group) or 0.9% sodium chloride (NS group) for 3 weeks after impulse noise exposure. The animals receiving neither medicine nor noise served as a control group. ABR threshold shifts, the cochlear AchE staining as well as the hair cell and spiral ganglion cell counting were carried out in three groups of animals. Results The numbers of damaged hair cells and spiral ganglion cells in the CNTF group was less than that in the NS group. AchE activity alteration was also less severe in the CNTF group. Similar to the morphological results, changes in the auditory function, represented by the ABR threshold shifts, was less in the CNTF group. Conclusion CNTF can protect cochlear hair cells and spiral ganglion cells against intensive impulse noise exposure by decreasing degeneration and necrosis of the hair cells in some extent and expedite hearing recovery.
, 百拇医药
【Key words】 Nerve growth factors Cochlea Noise Blast injuries Hearing loss,noise-induced
睫状神经营养因子(ciliary neurotrophic factor,CNTF)是多功能生长因子,最近几年的研究表明[1-3]CNTF对感觉神经元、运动神经元、海马胆碱能神经元、黑质多巴胺能神经元等均有促进存活及防止损伤作用,同时在神经系统发育、分化及损伤修复中也发挥重要作用。强脉冲噪声对内耳Corti器及螺旋神经节细胞都具有明显损害作用。本实验尝试应用CNTF来防治内耳声损伤,报道如下。
材料及方法
1. 动物的选择及分组:选用耳廓反射正常,体重200 g左右健康无中耳炎杂种豚鼠54只,随机分为3组,即正常对照组、生理盐水对照组和CNTF组,各18只。
, 百拇医药
2. 噪声源:强脉冲噪声声源系由特制的D-86电火花脉冲发生器(上海江湾一厂)产生。生理盐水对照组和CNTF组每只动物暴露80次,间隔2 s,脉宽0.5 ms,压力峰值172.0 dB SPL,正常对照组不接受噪声。
3. 试剂和给药:重组人CNTF制备按文献方法进行[4],由第二军医大学神经生物学教研室提供。生理盐水由解放军总医院制剂室提供。CNTF组噪声暴露后当天开始肌内注射CNTF每次0.22 mg/kg体重, 每日2次,共21 d;生理盐水对照组噪声暴露后当天开始肌内注射生理盐水每次2 ml/kg体重, 每日2次,共21 d。
4. ABR反应阈测定:用豚鼠固定装置固定豚鼠,用Madsenson-2250型脑干听觉诱发电位测试仪测定豚鼠清醒状态下听性脑干电位(auditory brainstem response,ABR)反应阈值,记录电极置颅顶正中部,参考电极和接地电极分别置于同侧和对侧耳廓。噪声暴露前后测试时电极放置位点相同。刺激声为宽频带短声(click),脉冲宽度为0.1 ms,扫描时程10 ms,叠加256次。以出现最稳定的I波刚消失时的刺激声压级作为该耳的听反应阈。两组实验豚鼠分别测定噪声暴露前及其后即刻、3 d和21 d的ABR阈值,正常对照组则在对应时间测试。
, 百拇医药
5. 琥珀酸脱氢酶染色铺片和计算机毛细胞计数:噪声暴露后21 d两试验组和对照组各取9只动物在麻醉状态下断头处死,快速取出左侧耳蜗并进行蜗管内灌注氯化硝基四氮唑蓝配制的琥珀酸脱氢酶作用液,37 ℃温箱内孵育60 min,固定,脱钙后解剖显微镜下剥去蜗壳,按Stockwell等[5]介绍的方法,制备耳蜗铺片标本。耳蜗毛细胞计数采用计算机图像分析处理。图像处理工作站包括1台MMX奔腾计算机加DT-2851、DF-2858图像板,1台彩色显示器、1块HIPAD plus数字化板、1台摄像机和1台显微镜。毛细胞计数是先测量从钩回到顶回基底膜上各回每排毛细胞的长度,再根据各回每排单位长度内毛细胞个数计算出各回毛细胞数,各回相加即得到毛细胞总数。
6. 螺旋神经节细胞计数:噪声暴露后21 d两试验组和对照组动物各取9只在麻醉状态下断头处死,快速取出右侧耳蜗并进行蜗管内灌注10%甲醛并固定于该液24 h,10%甲酸脱钙72 h,石蜡包埋,制作7μm厚连续中轴切片,HE染色。光镜下豚鼠耳蜗可见钩回,与耳蜗第1~4回对应的蜗螺旋管内螺旋神经节部位,由蜗底到蜗顶依次称为一下、一上、二下、二上、三下、三上、四。按文献[6]所述方法稍加改进,目镜加网格片,在40×10放大倍数下直接计数蜗螺旋管中有核神经节细胞数,每只耳蜗连续计数5张中轴切片,取其均值。
, http://www.100md.com
7. 耳蜗乙酰胆碱酯酶染色及铺片:噪声暴露后21 d试验组和对照组各取9只动物均在麻醉状态下断头处死,快速取出右侧耳蜗并进行蜗管内灌注2.5%戊二醛并将耳蜗置于该液中,在0~4 ℃冰箱内连续固定4 h,10%乙二胺四乙酸(ethylene-diaminotetraacetic acid ,EDTA)脱钙4 d后,于0.1 mol/L磷酸缓冲液中解剖显微镜下去除蜗壳,充分暴露各回Corti器。按Karnovsky等[7]所述硫胆碱-亚铁氰化铜反应显示胆碱酯酶的方法稍加改进后进行耳蜗组织化学反应,制备耳蜗铺片标本,光镜下观察诸耳蜗乙酰胆碱酯酶染色情况。
8. 统计学方法:各组均数的统计学处理均用t检验,以P<0.05为差异有显著性意义;P<0.01为差异有极显著性意义。
结果 1. 3组豚鼠ABR反应阈值变化见表1。
表1 3组豚鼠在实验不同时间的平均
, 百拇医药
ABR反应阈值(
 ±s dB SPL) 组别
±s dB SPL) 组别例数
暴露前
暴露即刻
暴露后3 d
暴露后21 d
正常对照组
18
39.0±3.82
39.0±3.82
38.0±4.04
, 百拇医药
40.4±3.57
生理盐水组
18
37.5±3.04
93.5±6.93
84.5±6.56
80.0±8.94
CNTF组
18
38.5±2.96
95.0±7.38
80.5±6.15
, 百拇医药
68.5±9.62*
*与正常对照组21 d、生理盐水对照组 21 d和CNTF组3 d比较P<0.01
从表1可以看出,噪声暴露前各组豚鼠ABR阈值无差异,表明所用豚鼠各组间条件相同。CNTF组与生理盐水对照组噪声暴露后即刻ABR阈值相近,暴露后3 d有所差异,但无统计学意义;暴露后21 d,CNTF组ABR阈值比未暴露噪声的正常对照组要高,但低于生理盐水对照组,差异均有显著性。另外,CNTF组暴露后3 d与21 d的结果比较,差异也有显著性。
2. 3组豚鼠耳蜗琥珀酸脱氢酶染色毛细胞计数结果见表2。
表2 3组豚鼠实验后21 d毛细胞平均计数(
 ±s个) 组别
±s个) 组别, http://www.100md.com
耳数
钩回
第一回
第二回
第三回
第四回
总数
正常对照组
9
1280±68.2
2693±108.5
2040±132.4
1636± 87.6
, http://www.100md.com
1446±112.7
9094±103.6*
生理盐水组
9
848±63.8
1943±210.4
1688±204.7
1511±112.3
1368±146.5
7351±196.5**
CNTF组
, 百拇医药
9
1020±87.7
2278±196.4
2012±217.3
1593±135.8
1432±138.2
8522±203.1
*与生理盐水对照组和CNTF组比较P<0.01 **与CNTF组比较P<0.01
耳蜗琥珀酸脱氢酶染色铺片见正常对照组各回均有整齐排列的3排外毛细胞和1排内毛细胞,毛细胞自然缺失率极少(图1);CNTF组和生理盐水对照组噪声暴露后21 d均出现程度不同的毛细胞缺失,其中生理盐水对照组毛细胞缺失更明显(图2)。

, 百拇医药
图1 正常对照组耳蜗琥珀酸脱氢酶染色铺片见整齐排列的3排外毛细胞和1排内毛细胞,毛细胞自然缺失率极少。×550

图2 生理盐水对照组噪声暴露后21 d耳蜗琥珀酸脱氢酶染色铺片可见明显的毛细胞缺失。×550
从表2可以看出,噪声暴露后21 d生理盐水对照组和CNTF组毛细胞减少主要在钩回、第一回、第二回,其中以第一回减少最明显。从总数来看,生理盐水对照组和CNTF组均有减少,但生理盐水对照组较CNTF组减少更加明显,差异有显著性。
3. 噪声暴露后21 d耳蜗螺旋神经节细胞计数结果见表3。
表3 实验后21 d耳蜗螺旋神经节细胞计数(
 ±s个) 组别
±s个) 组别, 百拇医药
耳数
一下
一上
二下
二上
三下
三上
四
正常对照组
9
54±8.36
56±3.81*
51± 4.72*
, 百拇医药
42±2.96
41±2.83
43±5.10
41±2.97
生理盐水组
9
52±7.32
41±4.86
27± 6.94**
38±4.75
38±2.98
41±5.44
, http://www.100md.com
39±3.26
CNTF组
9
46±4.78
43±5.23
37±10.40
40±7.50
37±3.58
47±4.94
40±3.89
*与生理盐水对照组和CNTF组同部位比较P<0.01 **与CNTF组同部位比较P<0.05
, http://www.100md.com
从表3可以看出,噪声暴露后两实验组豚鼠螺旋神经节细胞数的减少主要发生在蜗螺旋管内螺旋神经节部位的一上和二下,与正常对照组比较差异有显著性;在二下生理盐水对照组比CNTF组减少更多,两组间差异有显著性。
4. 耳蜗乙酰胆碱酯酶染色结果:正常对照组豚鼠耳蜗乙酰胆碱酯酶活性主要分布于Corti器各回内毛细胞下的内螺旋束、隧道螺旋束、隧道上辐射纤维;第一和二回三排外毛细胞下的传出神经末梢;第三回外毛细胞下第一、二排神经末梢;第四回第一排外毛细胞的神经末梢乙酰胆碱酯酶终末反应产物(亚铁氰化铜)呈褐色,光镜下清晰可见(图3)。噪声暴露后耳蜗乙酰胆碱酯酶终末反应产物减少或消失,损伤主要分布在耳蜗一上和二下。通常将其分为3度:Ⅰ度:只有外毛细胞下大的神经末梢和隧道上辐射纤维乙酰胆碱酯酶终末反应产物减少或消失;Ⅱ度:外毛细胞下大的神经末梢、隧道螺旋束、隧道上辐射纤维乙酰胆碱酯酶终末反应产物均减少或消失;Ⅲ度:外毛细胞下大的神经末梢、隧道上辐射纤维、隧道螺旋束及内螺旋束乙酰胆碱酯酶终末反应产物均减少或消失。CNTF组9耳中以Ⅰ度损伤为主者3耳(图4),以Ⅱ度损伤为主者4耳(图5),以Ⅲ度损伤为主者2耳;生理盐水对照组以Ⅱ度损伤为主者4耳,以Ⅲ度损伤为主者5耳(图6)。

, 百拇医药
图3 正常对照组乙酰胆碱酯酶染色示耳蜗铺片乙酰胆碱酯酶终末反应产物呈褐色,分布于Corti器各回内毛细胞下的内螺旋束、隧道螺旋束、隧道上辐射纤维;外毛细胞下大的传出神经末梢。×550

图4 CNTF组乙酰胆碱酯酶染色示噪声暴露后I度损伤:只有外毛细胞下大的神经末梢和隧道上辐射纤维乙酰胆碱酯酶终末反应产物减少或消失。×550

图5 CNTF组乙酰胆碱酯酶染色示噪声暴露后II度损伤:外毛细胞下大的神经末梢、隧道螺旋束、隧道上辐射纤维乙酰胆碱酯酶终末反应产物均减少或消失。×550

图6 生理盐水对照组乙酰胆碱酯酶染色示噪声暴露后III度损伤:外毛细胞下大的神经末梢、隧道上辐射纤维、隧道螺旋束及内螺旋束乙酰胆碱酯酶终末反应产物均减少或消失。×550
, 百拇医药
讨论
CNTF能促进多种体外培养神经元成活,体内实验也表明CNTF能提高外周神经的传导功能,阻止受损神经元退行性变和促进横断神经纤维再生[8]。本实验在制作强脉冲噪声耳蜗损伤模型后,通过ABR测定、毛细胞计数及螺旋神经节细胞计数、耳蜗乙酰胆碱酯酶染色的方法,对CNTF的作用进行观察。实验结果显示,强脉冲噪声暴露后3周螺旋神经节细胞减少主要发生在蜗螺旋管内螺旋神经节部位的一上和二下,CNTF组的对应部位尽管螺旋神经节细胞数同正常对照组比较也有减少,但比生理盐水对照组多。乙酰胆碱酯酶染色结果也表明生理盐水对照组噪声暴露后耳蜗乙酰胆碱酯酶活性以Ⅲ度损伤为主;CNTF组主要以Ⅰ度和Ⅱ度损伤为主,少数区域有Ⅲ度损伤。强脉冲噪声对内耳损伤的机制是复杂的,既有机械性损伤,又有代谢性损伤;在代谢紊乱中,除物质代谢紊乱、能量代谢紊乱和氧代谢紊乱外,还有递质代谢紊乱,终末反应产物减少甚至消失,就意味着胆碱能神经突触功能下降或传导阻滞,Iurato等[9]认为乙酰胆碱酯酶活性未恢复则表示耳蜗传出神经系统的功能未恢复,而耳蜗乙酰胆碱酯酶阳性的传出神经对限制噪声所导致的听损伤极为重要。CNTF的作用一方面可能防止受损的耳蜗末梢神经及其传导通路发生变性坏死,另一方面可能促进受损神经的修复,从而使螺旋神经节细胞数仍能保持一定数量。
, 百拇医药
毛细胞计数结果还显示,强脉冲噪声暴露后毛细胞缺失主要发生在第一回和第二回下部,CNTF组毛细胞缺失较生理盐水对照组轻。在毛细胞将机械能转变成神经冲动传入听中枢时,听中枢亦有传出神经来支配毛细胞,耳蜗乙酰胆碱酯酶染色结果表明,CNTF组耳蜗的传出神经末梢乙酰胆碱酯酶活性损失较生理盐水对照组轻,而耳蜗传出神经系统在噪声防护过程中具有重要作用。耳蜗传出神经系统与受损毛细胞修复之间的关系有待进一步研究。
ABR检测结果显示,噪声暴露后21 d,CNTF组豚鼠的ABR阈值较生理盐水对照组低,且同组内21 d与3 d比较差异也有显著性,而生理盐水对照组未见此现象,说明CNTF在防止内耳Corti器及耳蜗末梢神经变性和促进损伤修复的同时,也促进了部分听功能的恢复。但是也应看到各组间ABR差异并不大,也可以说是听功能恢复并不理想,这除了与噪声本身过强而使耳蜗损伤过重等原因有关外,可能还与全身应用CNTF带来的副作用有关,因为在实验中我们发现CNTF组豚鼠食欲下降、体重减轻。
, 百拇医药
内耳发育过程中脑衍生物神经营养因子、神经营养素-3在毛细胞及前庭都有表达。目前尚不清楚在耳蜗毛细胞和听神经中是否存在CNTF及其受体。但有文献报道,在听觉系统发育过程中CNTF能促进听泡衍生因子对听泡神经节神经元轴突的生长作用[10]。有关CNTF通过内耳屏障及其在防治强脉冲噪声对豚鼠内耳损伤中的机制尚待进一步研究。
参考文献
1 Barbin G,Manthorpe M, Varon S. Purification of the chick eye ciliary neurotrophic factor. J Neurochem,1984,43:1468-1478.
2 Adler R. Ciliary neurotrophic factor as an injury factor.Curr Opin Neurobiol,1993,3:785-789.
, 百拇医药
3 Apfel SC, Arezzo JC, Moran M, et al. Effects of administration of ciliary neurotrophic factor on normal motor and sensory peripheral nerves in vivo. Brain Res,1993,604:1-6.
4 何成,陈江野,路长林,等.人睫状神经营养因子及突变体在大肠杆菌中的表达.生物化学与生物物理学报,1995,27:675-679.
5 Stockwell CW,Ades HW,Engstiom H.Patterns of hair cell damage after intense auditory stimulation. Ann Otol Rhinol Laryngol, 1969,78:1144-1168.
6 方耀云,姚行齐,姜泗长,等.老化豚鼠耳蜗毛细胞和螺旋神经节细胞定量研究.中国体视学与图像分析,1996,1:64-66.
, 百拇医药
7 Karnovsky MJ, Roots LA. A direct-coloring thiocholine method for cholinesterases. J Histochem Cytochem,1964,12:219-227.
8 Hagg T, Varon S. Ciliary neurotrophic factor prevents degeneration of adult rat substantia nigra dopaminergic neurons in vivo. Proc Natl Acad Sci USA, 1993,90:6315-6319.
9 Iurato S,Luciano L,Pannese E,et al.Histochemical localization of acetylcholinesterase(AChE) activity in the inner ear. Acta Otolaryngol Suppl,1971,279:1-50.
10 Bianchi LM,Cohan CS. Effects of the neurotrophins and CNTF on developing statoacoustic neurons: comparison with an otocyst-derived factor. Dev Biol,1993,159:353-365.
(收稿:1998-09-16 修回:1999-03-15), 百拇医药