伯氏疏螺旋体鞭毛蛋白特异性区段的基因克隆和表达
作者:李新军 张启恩 张泮河 戴小红 张习坦
单位:军事医学科学院微生物流行病研究所
关键词:伯氏疏螺旋体;鞭毛蛋白;克隆;表达
中国人兽共患病杂志990407 摘 要 目的 表达伯氏疏螺旋体鞭毛蛋白特异性区段,探讨其作为诊断抗原的可行性。方法 用PCR方法获取与其它种属螺旋体编码鞭毛蛋白的基因序列同源性较低的第409-786bp区段,经DNA序列测定证实后,经克隆、转化,在大肠杆菌BL21(DE3)中表达,并做Western-bolt分析。结果 重组蛋白在宿主菌内表达高效、稳定,Western-blot示与抗鞭毛蛋白的单克隆抗体有较好的免疫反应性。结论 以重组鞭毛蛋白的特异性区段作为诊断抗原具有可行性。
GENE CLONE AND EXPRESSION OF THE SPECIFIC FRAGMENT
, 百拇医药
OF FLAGELLIN FROM BORRELIA BURGDORFERI
Li Xinjun Zhang Qien Zhang Panhe Dai Xiaohong Zhang Xitan
(Institute of Microbiology and Epidemiology,Academy of Military Medical Sciences Beijing 100850)
ABSTRACT Aim Expressing the specific fragment of flagellin from Borrelia burgdorferi,in order to evaluate the feasibility of this recombinant protein as a diagnostic antigen.Methods By using PCR method,to obtain the gene coding the Borrelia burgdorferi flagellin from 409bp to 786bp that exhibit low homology with related gene from other bacterial specise.Verified by DNA sequence detection,cloning and thansforming it was expressed in E.coli BL21(DE3)and evaluated by westernblot.Results The expressing of recombinant protein in host bacteria is effective and stable.Western-blot assay verified the immunological response to monoclone antidody to flagellin.Conclusion It showed the feasibility of recombinant protein as a diagnostic antigen.
, 百拇医药
KEY WORD Borrelia burgdorferi Flagellin Clone Expression.
莱姆病是一种多个器官系统受累的虫媒传染病。1982年,Burgdorferi等首先从莱姆病疫区的肩突硬蜱中分离出该病病原体,后被命名为伯氏疏螺旋体。现有的研究表明在不同宿主、地域分离的菌株其表型及遗传学特征均显示了较大的异源性,这不仅使莱姆病螺旋体的分类、鉴定变得较为复杂,也增加了实验诊断和免疫保护的难度。莱姆病螺旋体蛋白抗原因其可能在致病(毒力)和免疫保护反应中的重要作用而成为各国学者关注的焦点。分子生物学技术的应用使莱姆病螺旋体蛋白抗原基因及其产物的研究取得了积极进展。研究表明[1]在莱姆病螺旋体众多的蛋白成分中,P100、P41(鞭毛蛋白)、OSPA、OSPC与其它种属菌的交叉反应性较小。鞭毛蛋白具有很强的免疫原性,可在感染后最早检测到其抗体,其编码基因位于染色体上,在传代中不易丢失,其异源性较质粒编码的外膜蛋白为小,经基因核苷酸序列和编码蛋白的氨基酸序列的比较[2]发现莱姆病螺旋体鞭毛蛋白同梅毒螺旋体、大肠杆菌的鞭毛蛋白在N、C端有很高的同源性,而在中心区域则变异较大,该区域不与梅毒及正常人血清反应,提示可作为莱姆病早期血清学诊断的抗原标志。目前,诊断莱姆病的方法主要是病原体分离培养和血清学诊断,分离培养条件要求高、时间长,病人螺旋体血症持续时间短,故不利于早期诊断,常规采用ELISA和IFA测定血中特异性抗体IgM、IgG作为现症感染指标。近年来国外有较多报道用重组抗原代替全细胞抗原及纯化抗原,以简便经济快速特异地诊断莱姆病,但国内尚未见报道。我们以基因工程的方法获取了Bb鞭毛蛋白的特异性区段的重组“平截型蛋白”,为进一步探索以重组抗原为诊断抗原的血清学方法奠定了基础。
, 百拇医药
1 材料与方法
1.1 基因克隆、测序、表达所用的质粒和菌种 克隆载体:pBluescriptⅡKS+(简称T-载体),表达载体:pET-17xb,受体菌:E.coli XL1-Blue,E.coli.BL21(DE3)均有本所王海涛教授提供。
1.2 工具酶、试剂 溶菌酶、TaqDNA聚合酶、限制性内切酶EcoR I、T4DNA连接酶、RNaseA为Promega公司产品,dNTP、IPTG、X-Gal为华美公司产品,双链试剂盒为QIAGEN公司产品,35S-α dATP为DuPont公司产品,测序试剂盒T7Sequencing Kit为USB产品。
1.3 螺旋体菌株及培养 伯氏疏螺旋体B31株Stanek惠赠,本室保存。培养条件:BSKⅡ型培养基,28℃,10~14d,暗视野下可见螺旋体呈簇状生长。
, http://www.100md.com
1.4 螺旋体DNA的提取 参照文献[3]。
1.5 引物设计 根据已知的B31株编码鞭毛蛋白质的基因序列[4]。设计一对引物。编码鞭毛蛋白的基因全长共1008bp,选取自第5′端409-428为引物1序列。第766-786为引物2序列,两引物5′端均加有限制性内切酶EcoRI识别的位点。由本所合成。
P1∶5′CGGAATTCATG409CAAACAAATCTGCTTCTCA428-3′
P2∶5′GCGAATTCTTA786ATCACTTATCATTCTAATAGC766—3′
1.6 目的片段的扩增、纯化与回收
, 百拇医药 1.6.1 PCR反应参数和反应体系参照文献[2]
1.6.2 琼脂糖凝胶电泳检测扩增产物及目的片段的回收 参照文献[5]。
1.7 目的片段的克隆
1.7.1 连接 将纯化的目的片段与经EcoRI消化的T载体用T4DNA连接酶平端连接(片段与载体DNA之比为3~5∶1,反应体积15μl,15℃,12h)。
1.7.2 感受态XL1—Blue的制备及转化 采用1×TSS转化法[6]。
1.7.3 菌落PCR鉴定 随机挑取白色菌落传代培养,同时将一部分混入100μl纯水,煮沸5min,离心,上清液作为模板,进行PCR扩增鉴定。
, http://www.100md.com
1.7.4 质粒酶切鉴定 按QIAPrepSpin Plasmid Miniprep Kit(50)试剂盒说明书提取质粒并纯化[5],再经EcoRI切割(37℃,3h)2%琼脂糖凝胶电泳,紫外灯下观察结果。
1.8 目的片段重组表达质粒的构建 将插有目的片段的T-载体经EcoRI单酶切,低熔点琼脂糖凝胶回收目的片段,插入经EcoRI酶切的pET-17xb中,转化XL1-Blue受体菌,经菌落PCR、质粒酶切及DNA序列测定以鉴定阳性克隆。测序模板制备按QIAPrep Spin Plasmid Miniprep Kit(50)试剂盒说明书,测序反应参照文献[5]。
1.9 “平截型”鞭毛蛋白的表达和聚丙烯酰胺凝胶电泳鉴定
1.9.1 pET-17xb重组质粒转化E.coli BL21(DE3)受体菌 采用1×TSS转化法,同前。
, http://www.100md.com
1.9.2 诱导 采用化学诱导表达。转化的菌种接种LB液体培养基,经37℃、250r/min振摇至OD值为0.4、0.6、0.8时,加IPTG至终浓度为0.4mM/L,分别于1、2、3、4h收集菌液1ml,收集菌体。
1.9.3 聚丙烯酰胺凝胶电泳鉴定 参照文献[5]。
1.10 Westernblot分析 用伯氏疏螺旋体VLG2F9-AF单克隆抗体作为一抗[7],以HRP-羊抗鼠IgG为二抗,步骤参照文献[5]。
1.11 包涵体的溶解 参照文献[5]。
1.12 蛋白质的定量测定 以BSA为标准,采用Bradford法。
, http://www.100md.com
2 结果
2.1 目的基因的扩增与鉴定 PCR扩增出的基因片段,分子量大小约400bp,符合预期值(结果见图1)。将此片段克隆入T载体,经蓝/白斑、菌落PCR及质粒酶切鉴定,可筛出阳性克隆(酶切鉴定结果见图2)。
图1.Bp鞭毛蛋白编码基因的扩增结果
N:阴性对照1—4:1株扩增结果
M:PBR322/HinfIDNA分子量对照
Fig.1.PCR amplification of B31 flagellin gene.
N:Negative control.1-4:amplfied DNA from B31.
, 百拇医药
M:DNA molecular weight marker.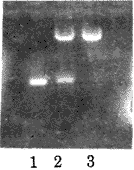
图2.重组T-载体的质粒酶切鉴定结果分析
1.原始PCR扩增产物对照 2.阳性克隆的酶切结果
3.空白T-载体的酶切结果对照
Fig.2.The analgss of recombinant T-vector digested by EcoR I
1.The PCR product
2.The positive clone digested by EcoR I
, http://www.100md.com
3.Primary T-vector digested by EcoR I
2.2 目的基因表达载体的构建与鉴定 T-载体用EcoRI切下的目的基因克隆入pET-17xb,与载体的T7噬菌体基因10相融合,转化入XL1-Blue受体菌,挑取20个克隆做菌落PCR,有15个阳性转化率75%。取阳性克隆做质粒的酶切鉴定,经EcoRI酶切后,可见从17xb切下一片段,与原始PCR产物长度一致,约400bp。取酶切阳性克隆用Sanger末端终止法进行DNA序列测定以证实序列的真实性(测序结果见图3)。
图3.重组载体阳性克隆的双脱氧末端终止法测序结果
Fig.3.DNA sequence of the recombinant T-vector by Sanger method.
, http://www.100md.com
2.3 “平截型”鞭毛蛋白表达、鉴定与复性 将阳性克隆的质粒转化入BL21(DE3)受体菌,B21(DE3)为溶原菌,带有LacUV5启动子控制下的T7噬菌体RNA聚合酶基因,故用IPTG诱导目的基因的表达。挑取5个克隆诱导后经SDS—PAGE电泳,可见3个克隆有表达的蛋白带(分子量介于45—50kD),未诱导者无此带,同时可见空白17xb转化的BL21(DE3)经诱导后有一约31kD的表达带,此蛋白为T7噬菌体基因10的表达产物。根据计算,目的基因与基因10表达的融合蛋白的分子量应为47kD,电泳结果与之相符合(图略)。
诱导结果表明,在细菌培养至OD值0.8~0.9时,加IPTG诱导4h后蛋白表达量较大,凝胶薄层扫描结果显示,表达蛋白约占菌体总蛋白的30%,并以包涵体的形式存在于受体菌内。
, 百拇医药
为证实所表达的特异性,经做Westernblot发现,该融合蛋白可与抗鞭毛蛋白的单克隆抗体起特异性反应,其它分子量蛋白未见有反应条带(图略)。可见,我们所克隆的基因的表达产物仍然保持着基本的免疫原性。采用常规的包涵体变性及蛋白复性技术,获得了所表达抗原的可溶性产物。经Bradford法进行蛋白定量,蛋白浓度为5mg/ml。
3 讨论
由于编码鞭毛蛋白的基因位于染色体上,因而在细菌生长过程中较稳定,不易丢失,在莱姆病螺旋体种属内不同地理株高度同源(99%左右),机体感染后,此抗原特异性的抗体出现最早,故是理想的全抗原替代者,但由于该菌鞭毛蛋白与其它种属细菌也有一定的同源性。如BbGeHo(欧洲代表株)与B.hermsill的同源性为95%,与梅毒螺旋体B2株为60%,与大肠杆菌为50%,存在一定的交叉性,从而影响了检测的特异性,故减少这种非特异性因素的影响,已成为当今Bb检测方法研究的当务之急。
, 百拇医药
DNA序列分析表明,Bb与其它种属菌如梅毒螺旋体的同源性主要集中在氨基端与羧基端。其氨基端(1-137)与梅毒螺旋体同源性为52%,羧基端(262-366)为54%,而中央区段(137-262)仅13%。X-射线衍射分析结果显示[8],在鞭毛蛋白的二级结构中,其氨基端与羧基端位于蛋白的疏水内核,而中央区段则构成蛋白质的外表面,在免疫应答过程中起重要作用,其氨基端与羧基端则在维持蛋白质稳定的空间构象上起重要作用。各国学者对鞭毛蛋白的各区段的抗原特异性的研究结果验证了这一结论。如Robinson[2]发现P137-262不与梅毒病人血清和正常人血清起反应,P64-311则有微小的交叉反应性,而54%的梅毒病人血清及17%的正常人血清与全区段抗原起反应,氨基端与羧基端区段与梅毒病人血清的反应性则分别为46%和15%。Berland[9]发现P165—261、P197—241、P197—273三个区段(位于鞭毛蛋白的中央区域)与莱姆病病人血清的反应性强于两个末端的各区段,稍差于全区段。
, http://www.100md.com
我们根据以上的研究结果,选取了序列特异、长度适中的137—262氨基酸残基区段在大肠杆菌中成功地进行了表达,经以抗BbVLG2F9-AF单克隆抗体为一抗的Westernblot分析,确认其有较好的免疫原性,显示出以B31重组的鞭毛蛋白的特异性区段作为诊断抗原的可行性,为诊断方法的建立奠定了基础。
参考文献
1.Bruckbauer H R,et al.Cross-reactive proteins of Borrelia burgdorferi.Eur J Clin Microbiol Infect Dis,1992,224.
2.Robinson,et al.Analysis of Humoral Response to the Flagellin Protein of Borrelia burgdorferi:Cloning of Regions Capable of Differentiating Lyme Disease from Syphilis.J Clin Microbiology,1993,31:629.
, http://www.100md.com
3.杜勇,等.伯氏疏螺旋体G+Cmol%含量测定,军事医学科学院院刊,1992,73:11.
4.Gassman,et al.Nucleotide sequence of a gene encoding the Borrelia burgdorferi flagellin.Nucleic Acid Res.1989.17:3590.
5.J Sambrook,et al.Molecular Clonig A Laboratory Manual.Cold Spring Harbour NY.1989.
6.卢圣栋.现代分子生物学实验技术.高等教育出版社,1993.
7.张泮河,等.用国内莱姆病螺旋体株制备单克隆抗体获得成功.军事医学科学院,1991,15:80.
8.Namba K.Structure of the core and cenrtal channel of bacterial flagella.Nature.1989,342:648.
9.R Berland,et al.Molecular Characterization of the Humoral Response to the 41kD FLagellar Antigen of Borrelia burgdorferi the Lyme Disease.Infect Immun,1991,59:3531.
1997年5月收稿, 百拇医药
单位:军事医学科学院微生物流行病研究所
关键词:伯氏疏螺旋体;鞭毛蛋白;克隆;表达
中国人兽共患病杂志990407 摘 要 目的 表达伯氏疏螺旋体鞭毛蛋白特异性区段,探讨其作为诊断抗原的可行性。方法 用PCR方法获取与其它种属螺旋体编码鞭毛蛋白的基因序列同源性较低的第409-786bp区段,经DNA序列测定证实后,经克隆、转化,在大肠杆菌BL21(DE3)中表达,并做Western-bolt分析。结果 重组蛋白在宿主菌内表达高效、稳定,Western-blot示与抗鞭毛蛋白的单克隆抗体有较好的免疫反应性。结论 以重组鞭毛蛋白的特异性区段作为诊断抗原具有可行性。
GENE CLONE AND EXPRESSION OF THE SPECIFIC FRAGMENT
, 百拇医药
OF FLAGELLIN FROM BORRELIA BURGDORFERI
Li Xinjun Zhang Qien Zhang Panhe Dai Xiaohong Zhang Xitan
(Institute of Microbiology and Epidemiology,Academy of Military Medical Sciences Beijing 100850)
ABSTRACT Aim Expressing the specific fragment of flagellin from Borrelia burgdorferi,in order to evaluate the feasibility of this recombinant protein as a diagnostic antigen.Methods By using PCR method,to obtain the gene coding the Borrelia burgdorferi flagellin from 409bp to 786bp that exhibit low homology with related gene from other bacterial specise.Verified by DNA sequence detection,cloning and thansforming it was expressed in E.coli BL21(DE3)and evaluated by westernblot.Results The expressing of recombinant protein in host bacteria is effective and stable.Western-blot assay verified the immunological response to monoclone antidody to flagellin.Conclusion It showed the feasibility of recombinant protein as a diagnostic antigen.
, 百拇医药
KEY WORD Borrelia burgdorferi Flagellin Clone Expression.
莱姆病是一种多个器官系统受累的虫媒传染病。1982年,Burgdorferi等首先从莱姆病疫区的肩突硬蜱中分离出该病病原体,后被命名为伯氏疏螺旋体。现有的研究表明在不同宿主、地域分离的菌株其表型及遗传学特征均显示了较大的异源性,这不仅使莱姆病螺旋体的分类、鉴定变得较为复杂,也增加了实验诊断和免疫保护的难度。莱姆病螺旋体蛋白抗原因其可能在致病(毒力)和免疫保护反应中的重要作用而成为各国学者关注的焦点。分子生物学技术的应用使莱姆病螺旋体蛋白抗原基因及其产物的研究取得了积极进展。研究表明[1]在莱姆病螺旋体众多的蛋白成分中,P100、P41(鞭毛蛋白)、OSPA、OSPC与其它种属菌的交叉反应性较小。鞭毛蛋白具有很强的免疫原性,可在感染后最早检测到其抗体,其编码基因位于染色体上,在传代中不易丢失,其异源性较质粒编码的外膜蛋白为小,经基因核苷酸序列和编码蛋白的氨基酸序列的比较[2]发现莱姆病螺旋体鞭毛蛋白同梅毒螺旋体、大肠杆菌的鞭毛蛋白在N、C端有很高的同源性,而在中心区域则变异较大,该区域不与梅毒及正常人血清反应,提示可作为莱姆病早期血清学诊断的抗原标志。目前,诊断莱姆病的方法主要是病原体分离培养和血清学诊断,分离培养条件要求高、时间长,病人螺旋体血症持续时间短,故不利于早期诊断,常规采用ELISA和IFA测定血中特异性抗体IgM、IgG作为现症感染指标。近年来国外有较多报道用重组抗原代替全细胞抗原及纯化抗原,以简便经济快速特异地诊断莱姆病,但国内尚未见报道。我们以基因工程的方法获取了Bb鞭毛蛋白的特异性区段的重组“平截型蛋白”,为进一步探索以重组抗原为诊断抗原的血清学方法奠定了基础。
, 百拇医药
1 材料与方法
1.1 基因克隆、测序、表达所用的质粒和菌种 克隆载体:pBluescriptⅡKS+(简称T-载体),表达载体:pET-17xb,受体菌:E.coli XL1-Blue,E.coli.BL21(DE3)均有本所王海涛教授提供。
1.2 工具酶、试剂 溶菌酶、TaqDNA聚合酶、限制性内切酶EcoR I、T4DNA连接酶、RNaseA为Promega公司产品,dNTP、IPTG、X-Gal为华美公司产品,双链试剂盒为QIAGEN公司产品,35S-α dATP为DuPont公司产品,测序试剂盒T7Sequencing Kit为USB产品。
1.3 螺旋体菌株及培养 伯氏疏螺旋体B31株Stanek惠赠,本室保存。培养条件:BSKⅡ型培养基,28℃,10~14d,暗视野下可见螺旋体呈簇状生长。
, http://www.100md.com
1.4 螺旋体DNA的提取 参照文献[3]。
1.5 引物设计 根据已知的B31株编码鞭毛蛋白质的基因序列[4]。设计一对引物。编码鞭毛蛋白的基因全长共1008bp,选取自第5′端409-428为引物1序列。第766-786为引物2序列,两引物5′端均加有限制性内切酶EcoRI识别的位点。由本所合成。
P1∶5′CGGAATTCATG409CAAACAAATCTGCTTCTCA428-3′
P2∶5′GCGAATTCTTA786ATCACTTATCATTCTAATAGC766—3′
1.6 目的片段的扩增、纯化与回收
, 百拇医药 1.6.1 PCR反应参数和反应体系参照文献[2]
1.6.2 琼脂糖凝胶电泳检测扩增产物及目的片段的回收 参照文献[5]。
1.7 目的片段的克隆
1.7.1 连接 将纯化的目的片段与经EcoRI消化的T载体用T4DNA连接酶平端连接(片段与载体DNA之比为3~5∶1,反应体积15μl,15℃,12h)。
1.7.2 感受态XL1—Blue的制备及转化 采用1×TSS转化法[6]。
1.7.3 菌落PCR鉴定 随机挑取白色菌落传代培养,同时将一部分混入100μl纯水,煮沸5min,离心,上清液作为模板,进行PCR扩增鉴定。
, http://www.100md.com
1.7.4 质粒酶切鉴定 按QIAPrepSpin Plasmid Miniprep Kit(50)试剂盒说明书提取质粒并纯化[5],再经EcoRI切割(37℃,3h)2%琼脂糖凝胶电泳,紫外灯下观察结果。
1.8 目的片段重组表达质粒的构建 将插有目的片段的T-载体经EcoRI单酶切,低熔点琼脂糖凝胶回收目的片段,插入经EcoRI酶切的pET-17xb中,转化XL1-Blue受体菌,经菌落PCR、质粒酶切及DNA序列测定以鉴定阳性克隆。测序模板制备按QIAPrep Spin Plasmid Miniprep Kit(50)试剂盒说明书,测序反应参照文献[5]。
1.9 “平截型”鞭毛蛋白的表达和聚丙烯酰胺凝胶电泳鉴定
1.9.1 pET-17xb重组质粒转化E.coli BL21(DE3)受体菌 采用1×TSS转化法,同前。
, http://www.100md.com
1.9.2 诱导 采用化学诱导表达。转化的菌种接种LB液体培养基,经37℃、250r/min振摇至OD值为0.4、0.6、0.8时,加IPTG至终浓度为0.4mM/L,分别于1、2、3、4h收集菌液1ml,收集菌体。
1.9.3 聚丙烯酰胺凝胶电泳鉴定 参照文献[5]。
1.10 Westernblot分析 用伯氏疏螺旋体VLG2F9-AF单克隆抗体作为一抗[7],以HRP-羊抗鼠IgG为二抗,步骤参照文献[5]。
1.11 包涵体的溶解 参照文献[5]。
1.12 蛋白质的定量测定 以BSA为标准,采用Bradford法。
, http://www.100md.com
2 结果
2.1 目的基因的扩增与鉴定 PCR扩增出的基因片段,分子量大小约400bp,符合预期值(结果见图1)。将此片段克隆入T载体,经蓝/白斑、菌落PCR及质粒酶切鉴定,可筛出阳性克隆(酶切鉴定结果见图2)。

图1.Bp鞭毛蛋白编码基因的扩增结果
N:阴性对照1—4:1株扩增结果
M:PBR322/HinfIDNA分子量对照
Fig.1.PCR amplification of B31 flagellin gene.
N:Negative control.1-4:amplfied DNA from B31.
, 百拇医药
M:DNA molecular weight marker.

图2.重组T-载体的质粒酶切鉴定结果分析
1.原始PCR扩增产物对照 2.阳性克隆的酶切结果
3.空白T-载体的酶切结果对照
Fig.2.The analgss of recombinant T-vector digested by EcoR I
1.The PCR product
2.The positive clone digested by EcoR I
, http://www.100md.com
3.Primary T-vector digested by EcoR I
2.2 目的基因表达载体的构建与鉴定 T-载体用EcoRI切下的目的基因克隆入pET-17xb,与载体的T7噬菌体基因10相融合,转化入XL1-Blue受体菌,挑取20个克隆做菌落PCR,有15个阳性转化率75%。取阳性克隆做质粒的酶切鉴定,经EcoRI酶切后,可见从17xb切下一片段,与原始PCR产物长度一致,约400bp。取酶切阳性克隆用Sanger末端终止法进行DNA序列测定以证实序列的真实性(测序结果见图3)。

图3.重组载体阳性克隆的双脱氧末端终止法测序结果
Fig.3.DNA sequence of the recombinant T-vector by Sanger method.
, http://www.100md.com
2.3 “平截型”鞭毛蛋白表达、鉴定与复性 将阳性克隆的质粒转化入BL21(DE3)受体菌,B21(DE3)为溶原菌,带有LacUV5启动子控制下的T7噬菌体RNA聚合酶基因,故用IPTG诱导目的基因的表达。挑取5个克隆诱导后经SDS—PAGE电泳,可见3个克隆有表达的蛋白带(分子量介于45—50kD),未诱导者无此带,同时可见空白17xb转化的BL21(DE3)经诱导后有一约31kD的表达带,此蛋白为T7噬菌体基因10的表达产物。根据计算,目的基因与基因10表达的融合蛋白的分子量应为47kD,电泳结果与之相符合(图略)。
诱导结果表明,在细菌培养至OD值0.8~0.9时,加IPTG诱导4h后蛋白表达量较大,凝胶薄层扫描结果显示,表达蛋白约占菌体总蛋白的30%,并以包涵体的形式存在于受体菌内。
, 百拇医药
为证实所表达的特异性,经做Westernblot发现,该融合蛋白可与抗鞭毛蛋白的单克隆抗体起特异性反应,其它分子量蛋白未见有反应条带(图略)。可见,我们所克隆的基因的表达产物仍然保持着基本的免疫原性。采用常规的包涵体变性及蛋白复性技术,获得了所表达抗原的可溶性产物。经Bradford法进行蛋白定量,蛋白浓度为5mg/ml。
3 讨论
由于编码鞭毛蛋白的基因位于染色体上,因而在细菌生长过程中较稳定,不易丢失,在莱姆病螺旋体种属内不同地理株高度同源(99%左右),机体感染后,此抗原特异性的抗体出现最早,故是理想的全抗原替代者,但由于该菌鞭毛蛋白与其它种属细菌也有一定的同源性。如BbGeHo(欧洲代表株)与B.hermsill的同源性为95%,与梅毒螺旋体B2株为60%,与大肠杆菌为50%,存在一定的交叉性,从而影响了检测的特异性,故减少这种非特异性因素的影响,已成为当今Bb检测方法研究的当务之急。
, 百拇医药
DNA序列分析表明,Bb与其它种属菌如梅毒螺旋体的同源性主要集中在氨基端与羧基端。其氨基端(1-137)与梅毒螺旋体同源性为52%,羧基端(262-366)为54%,而中央区段(137-262)仅13%。X-射线衍射分析结果显示[8],在鞭毛蛋白的二级结构中,其氨基端与羧基端位于蛋白的疏水内核,而中央区段则构成蛋白质的外表面,在免疫应答过程中起重要作用,其氨基端与羧基端则在维持蛋白质稳定的空间构象上起重要作用。各国学者对鞭毛蛋白的各区段的抗原特异性的研究结果验证了这一结论。如Robinson[2]发现P137-262不与梅毒病人血清和正常人血清起反应,P64-311则有微小的交叉反应性,而54%的梅毒病人血清及17%的正常人血清与全区段抗原起反应,氨基端与羧基端区段与梅毒病人血清的反应性则分别为46%和15%。Berland[9]发现P165—261、P197—241、P197—273三个区段(位于鞭毛蛋白的中央区域)与莱姆病病人血清的反应性强于两个末端的各区段,稍差于全区段。
, http://www.100md.com
我们根据以上的研究结果,选取了序列特异、长度适中的137—262氨基酸残基区段在大肠杆菌中成功地进行了表达,经以抗BbVLG2F9-AF单克隆抗体为一抗的Westernblot分析,确认其有较好的免疫原性,显示出以B31重组的鞭毛蛋白的特异性区段作为诊断抗原的可行性,为诊断方法的建立奠定了基础。
参考文献
1.Bruckbauer H R,et al.Cross-reactive proteins of Borrelia burgdorferi.Eur J Clin Microbiol Infect Dis,1992,224.
2.Robinson,et al.Analysis of Humoral Response to the Flagellin Protein of Borrelia burgdorferi:Cloning of Regions Capable of Differentiating Lyme Disease from Syphilis.J Clin Microbiology,1993,31:629.
, http://www.100md.com
3.杜勇,等.伯氏疏螺旋体G+Cmol%含量测定,军事医学科学院院刊,1992,73:11.
4.Gassman,et al.Nucleotide sequence of a gene encoding the Borrelia burgdorferi flagellin.Nucleic Acid Res.1989.17:3590.
5.J Sambrook,et al.Molecular Clonig A Laboratory Manual.Cold Spring Harbour NY.1989.
6.卢圣栋.现代分子生物学实验技术.高等教育出版社,1993.
7.张泮河,等.用国内莱姆病螺旋体株制备单克隆抗体获得成功.军事医学科学院,1991,15:80.
8.Namba K.Structure of the core and cenrtal channel of bacterial flagella.Nature.1989,342:648.
9.R Berland,et al.Molecular Characterization of the Humoral Response to the 41kD FLagellar Antigen of Borrelia burgdorferi the Lyme Disease.Infect Immun,1991,59:3531.
1997年5月收稿, 百拇医药