长期大强度运动大鼠脑组织阿黑皮素原mRNA表达的变化*
作者:陈家旭 杨维益 梁嵘 黄启福 刘晓兰 董浩
单位:北京中医药大学基础医学院 (北京 100029)
关键词:前阿片黑素细胞皮质激素;RNA;信使;杂交
长期大强度运动大鼠脑组织阿黑皮素 原mRNA表达的变化 摘要 目的和方法:采用生物素标记阿黑皮素原(POMC) cRNA探针(Bio-cRNA)原位杂交法结合图象分析,从基因转录水平观察长时期(共7周)大强度(速度由15 m/min递增至35 m/min,运动时间为20~25 min/d)跑台运动的大鼠不同脑区POMC mRNA表达。结果:该强度下大鼠末次运动结束后POMC基因表达在额叶皮层、海马CA1下降(前者至运动结束后3 h仍未恢复,后者至运动结束后30 min即恢复),在下丘脑则增强。结论:POMC mRNA表达在该强度下运动的大鼠不同脑区呈现不同的动态变化趋势。
, 百拇医药
Effects of long term and high intensity exercise on pro-opiomelanocortin
gene expression in rat brain
CHEN Jia-Xu,YANG Wei-Yi,LIANG Rong,HUANG Qi-Fu,LIU Xiao-Lan,DONG Hao
Bejing University of Chinese Medicine,Beijing (100029)
Abstract AIM and METHODS:In situ hybridization using biotin-labeled pro-opiomelanocortin (POMC) cRNA probe,and integrating image pattern analysis were used to observe the effect of long term (total 7 weeks) and high intensity treadmill exercise (speed from 15 m/min gradually increased to 35 m/min with 0 degree,20 to 25 min/d duration) on the changes of POMC mRNA expression in different areas of rat brain.RESULTS:Post-exercise instantly,the expression of POMC mRNA was decreased in frontal cortex,in which it was not recovery yet at post-exercise 3 hours;also decreased in hippocampal CA1,in which it was recovery at post-exercise 30 minutes.But the expression of POMC mRNA was increased in hypothalama.CONCLUSION:The dynamic changes of POMC gene expression in different areas of rat brain responding to such long term and high intensity exercise were not the same.
, 百拇医药
MeSH Pro-opiomelanocortin;RNA,messenger;Hybridization
运动为一种应激源,而应激与阿黑皮素原(pro-opiomelanocortin,POMC)系统有关[1]。我们已报道长期(共7周)大强度跑台运动(速度由15 m/min递增至35 m/min,运动时间为20~25 min/d)下对大鼠血乳酸、血β-内啡肽及强啡肽A1-13、亮氨酸脑啡肽的影响[2]。本研究运用生物素标记POMC cRNA探针进行原位杂交并结合图象分析,观察该强度运动下大鼠脑组织POMC信使RNA(messenger RNA,mRNA)表达的变化。
材料与方法
动物:二级Spargue-Dawley雄性大鼠,体重180~220 g。由北京医科大学、解放军301医院等实验动物中心提供。
, http://www.100md.com
适应训练:实验动物(200只)置于室温(20±2℃)、湿度40%动物室中,每5只1笼,自由进食饮水;适应实验环境1~2 d后开始训练,采用递增强度的方式在国产电动鼠类跑台(购自杭州)上运动,坡度为0。从训练第一周起,每周递增速度,每周速度分别为15 m/min、22 m/min、27 m/min、31 m/min、35 m/min。每天训练20 min,每周5 d,共训练5周。第5周后按以下方案进行训练。
一般训练:于第6、7周每只动物每日按35 m/min的速度,在坡度为0的跑台上跑20 min。
强化训练:于第6、7周每只动物每日按35 m/min的速度,在坡度为0的跑台上跑25 min。
造模周期共计7周,于第8周始取材,末次运动速度仍为35 m/min,时间为30 min。
安静对照组(A组,n=13):自实验开始第1~7周直到第8周取材日不进行任何运动训练。
, http://www.100md.com
训练对照组(B组,n=12):接受5周的适应训练后,进一步进行2周的一般训练,于第8周取材日安静状态下取材。
强化训练组(C组,n=56):接受5周的适应训练后,再接受2周的强化训练。于第8周取材日将动物随机分为运动前安静态(C)、运动后即刻(E)、运动结束后30 min(F)与3 h(G)。
大鼠经10%水合氯醛(400 mg/kg体重)麻醉后,剖开胸腔,经左心室向升主动脉插管,先以预冷的0.9%生理盐水速灌冲洗,一般约需100~200 mL,直至流出液体变清为止;继之灌入预冷的4%多聚甲醛溶液(0.1 mol/L PB配制,pH7.4) 300 mL,约30 min;取脑置于4%多聚甲醛溶液中4℃后固定6~10 h。然后将脑组织移至20%蔗糖溶液(0.1 mol/L PB配制,pH7.4)中于4℃保存,待组织下沉后,液氮骤冷,于-20 ℃在LEICA-CM 1900型恒冷箱切片机中制备10 μm切片,裱贴在预先经2%APES(3-aminopropyltriethoxysilane,购自北京中山生物技术有限公司)胶处理的载玻片上,空气中干燥后置-70℃冰箱中备用。
, http://www.100md.com
质粒的转化、扩增与提取:含POMC cDNA片段的质粒(克隆载体为PGEM-4Z,含442 bp的POMC cDNA片段)由澳大利亚Dr.DOMINIC AUTELTANO赠送。按碱裂解法对该质粒进行大量制备。
生物素标记试POMC cRNA探针的制备:随机引物标记试剂盒(Promega产品),PCR生物素标记试剂盒、Taq酶等购自华美生物工程公司。在Eppendorf管中按顺序加入50 ng DNA模板(POMC),3 μL随机引物(Random Primer),3 μL 2 mmol/L NTP (2mmol/L ATP、CTP、GTP, 1mmol/L TTP、1mmol/L Biotin-UTP),8 μL 10×PCR缓冲液,30.5 μL无菌水,0.5 μL Taq酶。然后加封石蜡油,置于PCR仪,变性、退火、延伸的参考温度分别为94℃、35 ℃、72 ℃,时间均为40 s,共35个循环。
POMC原位杂交程序:冰冻切片经室温平衡,水化后继之按以下步骤进行。0.3%甲醇-H2O2封闭,避光,37℃,30 min; 0.1 mol/L HCl, 室温,10 min;100 μg/mL蛋白酶K, 37℃消化20 min; 4%多聚甲醛固定,室温,5 min;以上各步之间用PBS(pH 7.4)充分漂洗;70%冷乙醇、100%冷乙醇各5 min;滴加杂交液,22 μL/片,杂交液组成为:10 μL 50%甲酰胺,4 μL 20×SSC, 2 μL 20×Denhard's液,1 μL ssDNA,1 μL 1 M DTT,2 μL 50% Dextra sulfate,2 μL POMC Biotin-cRNA探针,经过60~90℃变性3~5 min;置于湿盒中(含50%甲酰胺),42℃孵育,24 h;2×SSC,15 min 2次;1×SSC,15 min 2次;ABC复合物(试剂盒为Vector公司产品,稀释度为1∶100),37℃,1 h; PBS 3 min 3次;0.05% DAB 加0.01% H2O2,镜下控制显色时间,酒精梯度脱水、二甲苯透明、树胶封片。
, 百拇医药
阴性对照组:用不含POMC生物素化的cRNA探针杂交液进行杂交,其它步骤同上;阴性对照实验中未发现阳性细胞出现,即无特异性反应。
采用Cambridge QTM 970型图象分析系统,对杂交阳性细胞进行定量检测。放大倍数为40×2×20(物镜放大倍物×透射放大倍数×电路放大倍数),每组随机测试6张切片,每一部位随机测试1个视野;分别测量POMC阳性细胞个数(number)、数密度(numberical area,×100/mm2)、阳性物面积(area,μm2)、平均光密度(mean optical density,MOD)、积分光密度(integrated optical density,IOD)和阳性物面密度(area density)。用光密度表示各蛋白的相对含量,因IOD结合了阳性物面积和MOD两方面因素,故主要选取IOD表示mRNA水平的相对含量。
实验结果均以平均值±标准差(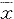 ±s)表示,两两比较采用Student't检验;组间差异采用方差分析(analysis of variance,ANOVA),继之以Duncan's检验;以P<0.05作为差异显著性的标准。
±s)表示,两两比较采用Student't检验;组间差异采用方差分析(analysis of variance,ANOVA),继之以Duncan's检验;以P<0.05作为差异显著性的标准。
, 百拇医药
结果
光镜下可见,POMC杂交阳性信号位于胞浆内,胞核不着色,呈棕黄色颗粒,阳性细胞广泛分布于皮质、海马、丘脑、下丘脑等脑区及其核团。对额叶皮质、海马CA1区和下丘脑阳性细胞进行图象分析,结果分别见表1。
表1 各组大鼠不同脑区POMC mRNA表达图象分析结果
Tab 1 Quantitative results of POMC mRNA gene expression of rat brain in each group (IOD,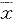 ±s)
±s)
Group
, http://www.100md.com
Frontal cortex
Hippocampal CA1
Hypothalama
A:Normal control
1649.8±379.5
5604.4±1986.8
1521.4±585.5
B:Exercise control
1125.2±211.0△
4700.9±810.5
, 百拇医药
1974.7±296.2△
C:Pre-exercise
3805.2±828.9△△○○
6763.8±2973.7
1629.3±470.4
E:post-exercise instantly
1608.2±233.6▲▲
2685.0±614.8▲▲
2376.3±973.2▲
, 百拇医药
F:Post-exercise 30 min
1680.6±583.7▲▲
5582.2±905.4★★
2516.6±787.4▲▲
G:Post-exercise 3h
1689.0±402.2▲▲
6616.6±1569.4★★
2255.4±728.3▲
△P<0.05,△△P<0.01,vs A group;○○P<0.01,vs B group;▲P<0.05,▲▲P<0.01,vs C group;★★P<0.01,vs E group
, 百拇医药
1.POMC阳性信号在额叶皮层的IOD变化情况:在安静状态下A、B组IOD均分别显著低于C组(P<0.01),B组IOD较A组显著下降(P<0.05)。强化训练运动后即刻E、30 min F及3 h G之间IOD无明显差异(P>0.05),但均较运动前安静态C呈极显著下降(P<0.01)。
2.POMC阳性信号在海马CA1区IOD变化的情况:在安静状态下各组IOD差异不显著。强化训练运动后即刻E其IOD显著低于C组(P<0.01),在恢复过程中30 min F、3 h G其IOD分别较即刻E极显著增高(P<0.01)而至正常水平。
3.POMC阳性信号在下丘脑IOD变化的情况:在安静状态下B组IOD显著高于A组(P<0.05),强化训练运动后即刻E、30 min F、3 h G其IOD均分别显著高于C组(P<0.05或P<0.01),但E、F、G间IOD无显著差异(P>0.05)。
, http://www.100md.com
讨论
POMC是促肾上腺皮质激素、β-内啡肽、α-促黑激素等的前体,主要在垂体合成,除垂体之外,有关POMC基因表达部位还有下丘脑、杏仁核、大脑皮层[3]等。POMC纤维少量分布于下丘脑弓状核,但腹侧正中至前连合区域有大量的POMC神经分布[4],应激与POMC系统有关[1];有资料显示急性应激除影响β-内啡肽释放外,也增加POMC合成和加工的速度[5,6];反复足电震一周后POMC mRNA水平仅在垂体前叶增加,而在垂体中叶无变化[7]。
本实验用原位杂交方法,显示POMC阳性细胞广泛分布于大鼠脑皮层、海马、丘脑、下丘脑等脑区及其核团。对于慢性运动应激,POMC积分光密度于额叶皮层在安静状态C显著升高,在海马CA1区与下丘脑则变化不明显;表明长期运动应激仅使额叶皮层POMC表达增强。而在此基础上强化训练运动结束后即刻POMC含量在额叶皮层、海马CA1区较运动前均显著下降,可能是大强度运动使该区POMC基因表达下调,在额叶皮层POMC于运动结束后30 min、3 h仍未恢复,在海马CA1区于运动结束后30 min即得以恢复;而在下丘脑POMC含量于强化训练运动结束后较运动前持续升高,可能是大强度运动使下丘脑区POMC基因表达增强。
, http://www.100md.com
此结果表明:长期(共7周)大强度的跑台运动(速度由15 m/min递增至35 m/min,运动时间为20至25 min/d)的大鼠,末次运动结束后POMC基因表达在额叶皮层、海马CA1下降(前者至运动结束后3 h仍未恢复,后者至运动结束后30 min即恢复),在下丘脑则其表达增强;表明该强度下应激的大鼠POMC基因表达在不同脑区呈现“双向”变化。
*国家自然科学基金重点项目(No.39430140)
参考文献
1 Przewlocki R.Opioid systems and stress.In:Albert Herz.ed.Opioids Ⅱ.Springer-Verlag,1993.294~297.
2 陈家旭,杨维益,梁 嵘,等.长时期大强度运动对大鼠血乳酸、β-内啡肽、强啡肽A1-13、亮氨酸脑啡肽影响的实验研究.中国应用生理学杂志,1997,14:371.
, http://www.100md.com
3 Civelli O,Birnberg N,Herbert E,et al.Detection and quantitation of proopiomelanocortin mRNA in pituitary and brain tissues from different species.J Biol Chem,1982,257:6783.
4 Khachatarian H,Lewis ME,Schafer MKH,et al.Anatomy of the CNS opioid systems.Trends Neurosci,1985,8:111.
5 Harbuz MS,Lightman SL.Responses of hypothalamic and pituittary mRNA to physical and psychological stress in the rat.J Endocrinol,1989,122:705.
, http://www.100md.com
6 Shiomi H,Akil H.Pulse-chase studies of the POMC/β-endorphin system in the pituitary of acutely and chronically stressed rats.Life Sci,1982,31:2271.
7 Hollt V,Przewlocki R,Haarmann I,et al.Stress-induced alternations in the levels of messenger RNA coding for proopiomelanocortin and prolactin in rat pituitary.Neuroendocrinology,1986,43:277.
(1998年5月4日收稿,1998年8月28日修回), http://www.100md.com
单位:北京中医药大学基础医学院 (北京 100029)
关键词:前阿片黑素细胞皮质激素;RNA;信使;杂交
长期大强度运动大鼠脑组织阿黑皮素 原mRNA表达的变化 摘要 目的和方法:采用生物素标记阿黑皮素原(POMC) cRNA探针(Bio-cRNA)原位杂交法结合图象分析,从基因转录水平观察长时期(共7周)大强度(速度由15 m/min递增至35 m/min,运动时间为20~25 min/d)跑台运动的大鼠不同脑区POMC mRNA表达。结果:该强度下大鼠末次运动结束后POMC基因表达在额叶皮层、海马CA1下降(前者至运动结束后3 h仍未恢复,后者至运动结束后30 min即恢复),在下丘脑则增强。结论:POMC mRNA表达在该强度下运动的大鼠不同脑区呈现不同的动态变化趋势。
, 百拇医药
Effects of long term and high intensity exercise on pro-opiomelanocortin
gene expression in rat brain
CHEN Jia-Xu,YANG Wei-Yi,LIANG Rong,HUANG Qi-Fu,LIU Xiao-Lan,DONG Hao
Bejing University of Chinese Medicine,Beijing (100029)
Abstract AIM and METHODS:In situ hybridization using biotin-labeled pro-opiomelanocortin (POMC) cRNA probe,and integrating image pattern analysis were used to observe the effect of long term (total 7 weeks) and high intensity treadmill exercise (speed from 15 m/min gradually increased to 35 m/min with 0 degree,20 to 25 min/d duration) on the changes of POMC mRNA expression in different areas of rat brain.RESULTS:Post-exercise instantly,the expression of POMC mRNA was decreased in frontal cortex,in which it was not recovery yet at post-exercise 3 hours;also decreased in hippocampal CA1,in which it was recovery at post-exercise 30 minutes.But the expression of POMC mRNA was increased in hypothalama.CONCLUSION:The dynamic changes of POMC gene expression in different areas of rat brain responding to such long term and high intensity exercise were not the same.
, 百拇医药
MeSH Pro-opiomelanocortin;RNA,messenger;Hybridization
运动为一种应激源,而应激与阿黑皮素原(pro-opiomelanocortin,POMC)系统有关[1]。我们已报道长期(共7周)大强度跑台运动(速度由15 m/min递增至35 m/min,运动时间为20~25 min/d)下对大鼠血乳酸、血β-内啡肽及强啡肽A1-13、亮氨酸脑啡肽的影响[2]。本研究运用生物素标记POMC cRNA探针进行原位杂交并结合图象分析,观察该强度运动下大鼠脑组织POMC信使RNA(messenger RNA,mRNA)表达的变化。
材料与方法
动物:二级Spargue-Dawley雄性大鼠,体重180~220 g。由北京医科大学、解放军301医院等实验动物中心提供。
, http://www.100md.com
适应训练:实验动物(200只)置于室温(20±2℃)、湿度40%动物室中,每5只1笼,自由进食饮水;适应实验环境1~2 d后开始训练,采用递增强度的方式在国产电动鼠类跑台(购自杭州)上运动,坡度为0。从训练第一周起,每周递增速度,每周速度分别为15 m/min、22 m/min、27 m/min、31 m/min、35 m/min。每天训练20 min,每周5 d,共训练5周。第5周后按以下方案进行训练。
一般训练:于第6、7周每只动物每日按35 m/min的速度,在坡度为0的跑台上跑20 min。
强化训练:于第6、7周每只动物每日按35 m/min的速度,在坡度为0的跑台上跑25 min。
造模周期共计7周,于第8周始取材,末次运动速度仍为35 m/min,时间为30 min。
安静对照组(A组,n=13):自实验开始第1~7周直到第8周取材日不进行任何运动训练。
, http://www.100md.com
训练对照组(B组,n=12):接受5周的适应训练后,进一步进行2周的一般训练,于第8周取材日安静状态下取材。
强化训练组(C组,n=56):接受5周的适应训练后,再接受2周的强化训练。于第8周取材日将动物随机分为运动前安静态(C)、运动后即刻(E)、运动结束后30 min(F)与3 h(G)。
大鼠经10%水合氯醛(400 mg/kg体重)麻醉后,剖开胸腔,经左心室向升主动脉插管,先以预冷的0.9%生理盐水速灌冲洗,一般约需100~200 mL,直至流出液体变清为止;继之灌入预冷的4%多聚甲醛溶液(0.1 mol/L PB配制,pH7.4) 300 mL,约30 min;取脑置于4%多聚甲醛溶液中4℃后固定6~10 h。然后将脑组织移至20%蔗糖溶液(0.1 mol/L PB配制,pH7.4)中于4℃保存,待组织下沉后,液氮骤冷,于-20 ℃在LEICA-CM 1900型恒冷箱切片机中制备10 μm切片,裱贴在预先经2%APES(3-aminopropyltriethoxysilane,购自北京中山生物技术有限公司)胶处理的载玻片上,空气中干燥后置-70℃冰箱中备用。
, http://www.100md.com
质粒的转化、扩增与提取:含POMC cDNA片段的质粒(克隆载体为PGEM-4Z,含442 bp的POMC cDNA片段)由澳大利亚Dr.DOMINIC AUTELTANO赠送。按碱裂解法对该质粒进行大量制备。
生物素标记试POMC cRNA探针的制备:随机引物标记试剂盒(Promega产品),PCR生物素标记试剂盒、Taq酶等购自华美生物工程公司。在Eppendorf管中按顺序加入50 ng DNA模板(POMC),3 μL随机引物(Random Primer),3 μL 2 mmol/L NTP (2mmol/L ATP、CTP、GTP, 1mmol/L TTP、1mmol/L Biotin-UTP),8 μL 10×PCR缓冲液,30.5 μL无菌水,0.5 μL Taq酶。然后加封石蜡油,置于PCR仪,变性、退火、延伸的参考温度分别为94℃、35 ℃、72 ℃,时间均为40 s,共35个循环。
POMC原位杂交程序:冰冻切片经室温平衡,水化后继之按以下步骤进行。0.3%甲醇-H2O2封闭,避光,37℃,30 min; 0.1 mol/L HCl, 室温,10 min;100 μg/mL蛋白酶K, 37℃消化20 min; 4%多聚甲醛固定,室温,5 min;以上各步之间用PBS(pH 7.4)充分漂洗;70%冷乙醇、100%冷乙醇各5 min;滴加杂交液,22 μL/片,杂交液组成为:10 μL 50%甲酰胺,4 μL 20×SSC, 2 μL 20×Denhard's液,1 μL ssDNA,1 μL 1 M DTT,2 μL 50% Dextra sulfate,2 μL POMC Biotin-cRNA探针,经过60~90℃变性3~5 min;置于湿盒中(含50%甲酰胺),42℃孵育,24 h;2×SSC,15 min 2次;1×SSC,15 min 2次;ABC复合物(试剂盒为Vector公司产品,稀释度为1∶100),37℃,1 h; PBS 3 min 3次;0.05% DAB 加0.01% H2O2,镜下控制显色时间,酒精梯度脱水、二甲苯透明、树胶封片。
, 百拇医药
阴性对照组:用不含POMC生物素化的cRNA探针杂交液进行杂交,其它步骤同上;阴性对照实验中未发现阳性细胞出现,即无特异性反应。
采用Cambridge QTM 970型图象分析系统,对杂交阳性细胞进行定量检测。放大倍数为40×2×20(物镜放大倍物×透射放大倍数×电路放大倍数),每组随机测试6张切片,每一部位随机测试1个视野;分别测量POMC阳性细胞个数(number)、数密度(numberical area,×100/mm2)、阳性物面积(area,μm2)、平均光密度(mean optical density,MOD)、积分光密度(integrated optical density,IOD)和阳性物面密度(area density)。用光密度表示各蛋白的相对含量,因IOD结合了阳性物面积和MOD两方面因素,故主要选取IOD表示mRNA水平的相对含量。
实验结果均以平均值±标准差(
, 百拇医药
结果
光镜下可见,POMC杂交阳性信号位于胞浆内,胞核不着色,呈棕黄色颗粒,阳性细胞广泛分布于皮质、海马、丘脑、下丘脑等脑区及其核团。对额叶皮质、海马CA1区和下丘脑阳性细胞进行图象分析,结果分别见表1。
表1 各组大鼠不同脑区POMC mRNA表达图象分析结果
Tab 1 Quantitative results of POMC mRNA gene expression of rat brain in each group (IOD,
Group
, http://www.100md.com
Frontal cortex
Hippocampal CA1
Hypothalama
A:Normal control
1649.8±379.5
5604.4±1986.8
1521.4±585.5
B:Exercise control
1125.2±211.0△
4700.9±810.5
, 百拇医药
1974.7±296.2△
C:Pre-exercise
3805.2±828.9△△○○
6763.8±2973.7
1629.3±470.4
E:post-exercise instantly
1608.2±233.6▲▲
2685.0±614.8▲▲
2376.3±973.2▲
, 百拇医药
F:Post-exercise 30 min
1680.6±583.7▲▲
5582.2±905.4★★
2516.6±787.4▲▲
G:Post-exercise 3h
1689.0±402.2▲▲
6616.6±1569.4★★
2255.4±728.3▲
△P<0.05,△△P<0.01,vs A group;○○P<0.01,vs B group;▲P<0.05,▲▲P<0.01,vs C group;★★P<0.01,vs E group
, 百拇医药
1.POMC阳性信号在额叶皮层的IOD变化情况:在安静状态下A、B组IOD均分别显著低于C组(P<0.01),B组IOD较A组显著下降(P<0.05)。强化训练运动后即刻E、30 min F及3 h G之间IOD无明显差异(P>0.05),但均较运动前安静态C呈极显著下降(P<0.01)。
2.POMC阳性信号在海马CA1区IOD变化的情况:在安静状态下各组IOD差异不显著。强化训练运动后即刻E其IOD显著低于C组(P<0.01),在恢复过程中30 min F、3 h G其IOD分别较即刻E极显著增高(P<0.01)而至正常水平。
3.POMC阳性信号在下丘脑IOD变化的情况:在安静状态下B组IOD显著高于A组(P<0.05),强化训练运动后即刻E、30 min F、3 h G其IOD均分别显著高于C组(P<0.05或P<0.01),但E、F、G间IOD无显著差异(P>0.05)。
, http://www.100md.com
讨论
POMC是促肾上腺皮质激素、β-内啡肽、α-促黑激素等的前体,主要在垂体合成,除垂体之外,有关POMC基因表达部位还有下丘脑、杏仁核、大脑皮层[3]等。POMC纤维少量分布于下丘脑弓状核,但腹侧正中至前连合区域有大量的POMC神经分布[4],应激与POMC系统有关[1];有资料显示急性应激除影响β-内啡肽释放外,也增加POMC合成和加工的速度[5,6];反复足电震一周后POMC mRNA水平仅在垂体前叶增加,而在垂体中叶无变化[7]。
本实验用原位杂交方法,显示POMC阳性细胞广泛分布于大鼠脑皮层、海马、丘脑、下丘脑等脑区及其核团。对于慢性运动应激,POMC积分光密度于额叶皮层在安静状态C显著升高,在海马CA1区与下丘脑则变化不明显;表明长期运动应激仅使额叶皮层POMC表达增强。而在此基础上强化训练运动结束后即刻POMC含量在额叶皮层、海马CA1区较运动前均显著下降,可能是大强度运动使该区POMC基因表达下调,在额叶皮层POMC于运动结束后30 min、3 h仍未恢复,在海马CA1区于运动结束后30 min即得以恢复;而在下丘脑POMC含量于强化训练运动结束后较运动前持续升高,可能是大强度运动使下丘脑区POMC基因表达增强。
, http://www.100md.com
此结果表明:长期(共7周)大强度的跑台运动(速度由15 m/min递增至35 m/min,运动时间为20至25 min/d)的大鼠,末次运动结束后POMC基因表达在额叶皮层、海马CA1下降(前者至运动结束后3 h仍未恢复,后者至运动结束后30 min即恢复),在下丘脑则其表达增强;表明该强度下应激的大鼠POMC基因表达在不同脑区呈现“双向”变化。
*国家自然科学基金重点项目(No.39430140)
参考文献
1 Przewlocki R.Opioid systems and stress.In:Albert Herz.ed.Opioids Ⅱ.Springer-Verlag,1993.294~297.
2 陈家旭,杨维益,梁 嵘,等.长时期大强度运动对大鼠血乳酸、β-内啡肽、强啡肽A1-13、亮氨酸脑啡肽影响的实验研究.中国应用生理学杂志,1997,14:371.
, http://www.100md.com
3 Civelli O,Birnberg N,Herbert E,et al.Detection and quantitation of proopiomelanocortin mRNA in pituitary and brain tissues from different species.J Biol Chem,1982,257:6783.
4 Khachatarian H,Lewis ME,Schafer MKH,et al.Anatomy of the CNS opioid systems.Trends Neurosci,1985,8:111.
5 Harbuz MS,Lightman SL.Responses of hypothalamic and pituittary mRNA to physical and psychological stress in the rat.J Endocrinol,1989,122:705.
, http://www.100md.com
6 Shiomi H,Akil H.Pulse-chase studies of the POMC/β-endorphin system in the pituitary of acutely and chronically stressed rats.Life Sci,1982,31:2271.
7 Hollt V,Przewlocki R,Haarmann I,et al.Stress-induced alternations in the levels of messenger RNA coding for proopiomelanocortin and prolactin in rat pituitary.Neuroendocrinology,1986,43:277.
(1998年5月4日收稿,1998年8月28日修回), http://www.100md.com