TGF-β信号通路中Smad蛋白与基因转录调节研究进展
作者:汪娟 柳惠图
单位:北京师范大学生命科学学院,细胞增殖及调控生物学教育部重点实验室,北京10 0875
关键词:
解剖学报00zk04
【中图分类号】 Q257 【文献标识码】 A 【文章编号】 0529-1356(2000)增-13
THE RELATIONSHIP BETWEEN Smads AND REGULATION OF GENE TRANSCRIPTION IN TGF-β SIGNALING PATHWAY
转化生长因子β(transforming growth factor)家族由一类结构、功能相关的多肽生长因子 亚家族组成,其中包括TGF-β、活化素(activin)、骨形态发生蛋白(BMP)、生长分化因子( GDF)等[1]。TGF-β除了影响细胞的增殖、分化,还在胚胎发育、胞外基质形成、 骨的形成和重建等方面起着重要作用。TGF-β家族成员广泛存在于从果蝇到人多种生物的 各种组织中,对正常细胞、癌变细胞都有着显著作用。
, 百拇医药
【基金项目】国家自然科学基金资助项目(39780014),国家重点基础研 究项目(G1999053901),北京市自然科学基金资助项目(7961001)(G10000539901)
【作者简介】 汪娟(1975—),女(汉族),河南省信阳市人,在读博士
转化生长因子β(transforming growth factor)家族由一类结构、功能相关的多肽生长因子 亚家族组成,其中包括TGF-β、活化素(activin)、骨形态发生蛋白(BMP)、生长分化因子( GDF)等[1]。TGF-β除了影响细胞的增殖、分化,还在胚胎发育、胞外基质形成、 骨的形成和重建等方面起着重要作用。TGF-β家族成员广泛存在于从果蝇到人多种生物的 各种组织中,对正常细胞、癌变细胞都有着显著作用。
由于TGF-β作用的多功能性和广泛性,所以从1981年Robert[2]发现TGF ̄β以来 ,对它的研究是沿着不同的路线进行的,但对其信号传导的通路一直不清楚。直到近来发现 了细胞内信号转导蛋白Smad家族,才较深入地阐明了TGF-β信号从膜到核转运的分子机理 。
, 百拇医药
TGF-β家族成员通过与两种类型的跨膜丝氨酸/苏氨酸激酶受体异源复合物结合,启动了细 胞反应。胞内信号蛋白Smads被受体激酶活化,形成异源蛋白复合物转移到核内,与特定的D NA序列结合,指导转录,从而实现TGF-β对基因表达的调控。
通过EST文库和cDNA文库筛选,已经在脊椎动物中至少已克隆出9种Smad基因[3],在 Drosophila(果蝇)和Caenorhabditis elegans(尼采蝇) 中发现 了它们的同源物。Smad蛋白的分子量大约在42kD到60kD,其N端和C端各有一段高度保守的区 域,分别称为MH1区和MH2区(mad ̄homology domain ),中间有一段富含pro的L区连接。 在非活性状态下,Smad的MH1区和MH2区相互作用,形成自我抑制,被受体激活后,分子 打开,Smad形成异源复合物,转移到核内。
, 百拇医药 不同的Smad家族在信号传递中作用不同。根据结构和功能上的特点,Smad蛋白被分为3类:( 1)R-Smad (receptor-activated Smads),包括Smad1、2、3、5、8,它们是Ⅰ型受体激酶 的底物,具有通路特异性(pathway-restricted)(2)Co-Smad(common ̄mediator sm ads),脊 椎动物中Smad4属于此类,它通过此类与R-Smad的结合,参与信号传递;(3)I-Smads(inhi bitory Smads),包括Smad6,7,它们抑制R-Smad的信号传递功能(附表)。附表 Smad蛋白家族
Table The Smad family 配体
ligand
R-Smad
Co-Smad
, 百拇医药 I-Smad
脊椎动物
vertebrate
BMPs
activin,TGF-β
Unknown
果蝇
Smad1,5,8
Smad2,3
Smad4
Smad4
Smad10注
, 百拇医药
Smad6(Sma d7)
Smad7(Smad6)
Drosophila
Dpp
dActivin
尼采蝇
MAD
dSmad2
Me dea
DAD
C.elegans
Dbl-1
, 百拇医药
Daf-7
Sma-2,-3
Daf-8,-14
Sma-4
Daf-3
注:Smad10[4]与Smad4有高度保守的序列。因此,被归为Co-Smad。
Smad10 shares a high level of sequence identity with Smad4.Thus it is ragarded a s Co-Smad.
1.Smad信号传递与其他通路的交联(crosstalk)
现在对Smads如何介导配体信号激活目的基因转录的机制已大致清楚。TGF-β超家族成员先 与细胞膜上的TGF-βⅡ型受体结合,然后吸收Ⅰ型受体在细胞膜上形成一个异源复合物, Ⅰ型受体被Ⅱ受体激酶磷酸化并被激活,活化的Ⅰ型受体与R-Smads暂时结合,磷酸化R-S madsC端SS(V/M)S区的ser残基。Smad1,5,8被BMP受体磷酸化,介导BMP信号,而Smad2,3被 activin和TGF-β受体所活化,介导这些因子的效应。受体对R-Smads的磷酸化使活化的Sm ads构象发生变化后从受体上解离下来,并与Smad4结合。结合后异源寡聚物转移到核内,激 活特定基因的转录。(图1)
, 百拇医药
近年来,随着对不同信号通路间相互交联(crosstalk)的研究,人们发现Smads蛋白不仅受 T GF-β信号的调节,而且很多信号通路对其都有调控作用。Smad信号和生长因子激活的酪氨 酸激酶受体信号以及随后的MAPK通路在若干水平上发生交联。有研究发现,EGF和HGF激活的 酪氨酸激酶受体可以激活依赖于Smad2的基因表达。这种效应是由于Smad2的磷酸化所致。但 是这种磷酸化不是发生在activin和TGF-β受体激酶作用的C端ser位点上[5]。虽 然 还需要进一步确定上述激酶的效应,但上述结果仍然显示Smad的激活可能并不仅仅依赖于TG F-β相关因子受体。Smad2还可以被MEKK-1(MAPK kinase kinase-1)所激活。MEKK-1是S AP K/JNK(stress-activated protein kinase/c-Jun Nterminal kinase)通路的激活物。ME KK-1对Smad2的磷酸化加强了Smad2~Smad4的相互作用和核内积累,同时也增强了Smad2与 转录辅激活因子CBP(CREB-binding protein)的结合[6]。另外,MEKK-1,JNK1和 MEK-4(MEK-4是JNK上游的一种激活因子)的显性失活形式会抑制TGF-β诱导的基因表达, 这都显示了SAPK/JNK通路参与了TGF-β信号传递[6~8]。但目前还不清楚HGF和EG F对Smad2的激活作用是否是SAPK/JNK通路对其磷酸化的结果。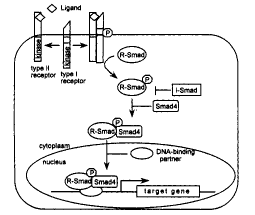
, 百拇医药
图1 TGF-β/SMAD通路
Fig.1 The transforming growth factor β(TGF-β)/SMAD pathway
与SAPK/JNK通路的正调作用相比,传统的MAPK/ERK(mitogen-activated protein kinase/extracellular-sigal-related kinase)通路可能是Smad信号传递的负调因子。MAP激酶Er k可以磷酸化Smad1L区段PXSP单元的ser残基[9]。这种磷酸化作用会抑制Smad1的核 转 移和转录激活作用,这说明酪氨酸激酶受体抑制BMP的信号传递。同样,活化的MAPK Kinase 1(MEK-1)或癌基因产物Ras也可以诱导TGF ̄β活化的Smad2和Smad3核内的积累和依赖于Sma d的转录[10]。现在还不清楚SAPK/JNK或MAPK/Erk对Smads的磷酸化作用是否发生在 同一位点。但是,上述发现证明了Smads能够整合来源于细胞内不同信号的通路。
, 百拇医药
酪氨酸激酶受体通路对Smad信号通路的抑制作用还可以通过诱导抑制型Smad6和Smad7的表达 而实现。EGF具有与TGF-β相似的诱导Smad6和Smad7表达的作用。另外,PKC的激活剂PMA在 激活MAPK通路的同时大大增强了TGF-β诱导的Smad6和Smad7的表达[11]。干扰素 γ 通过激活酪氨酸激酶Jak1,然后磷酸化转录因子Stat1而发生作用。已经发现干扰素γ可以 诱导Smad7的表达,但不能诱导Smad6[12]。对抑制型Smad的诱导可以抑制R-Smad 的信号 传递作用,从而抑制TGF-β家族成员的作用。因此,诱导抑制型Smad的表达可能是Jak-S tat通路反式调控Smad信号传递的机制。
综上所述,Smad不仅是TGF-β通路的胞内信号蛋白,而且受到多种信号通路的影响。这 些都说明了不同信号在胞内的整合作用。
2.Smad蛋白与基因转录
, 百拇医药
2.1 Smad与DNA启动子序列的结合:在过去的十几年中,在不同的启动子中已经发现了多 种TG F-β和活化素的效应元件,但它们没有明显一致的序列,只是发现TGF-β诱导的转录作用 常常需要一些已知的转录因子如AP-1,Sp1,CTF/NT-1之类的结合位点。近年来人们才逐步 了解Smads调节转录的机制,Smads与启动子序列直接结合,并与其他转录因子一起协同调节 转录。
进入核以后,磷酸化的Smads异源复合物与效应物配体的启动子序列之间相互作用,调节转 录。首次被确证与Smads结合作用于启动子DNA的蛋白是FAST(forehead activin signal tr ansducer)。介导activin效应的Smad2/4复合物与FAST-1结合,作用于非洲爪蟾的Mix2 启动 子,FAST-1是一种翼状螺旋转录因子,是activin的效应元件[13,14]。在上述 过 程中,Smad2与FAST-1之间是直接作用的,而Smad4则是通过它与Smad2的结合,参与到Smad2 /FAST-1复合物中[14,15]。Smad2/4复合物还通过类似的方式作用于小鼠的 goosecoid启动子。不过,在goosecoid启动子上,参与结合的是 FAST -2,而不是FASF1,FAST-2与FAST-1结构上相关,它所结合的序列与FAST-1的相似 [16]。Smad 3/4与PAI-1[17~19],JunB[20],collagenase[21]等启动子的 作用也与上述过程类似。
, http://www.100md.com
Smads与确定的启动子序列直接作用,这一点让人有些吃惊。因为第1篇报道Smad2和 Mix2启动子之间作用的文章强调它们是通过FAST-1间接作用的[13]。 但是 ,现在已经有很多文献说明了Smads在不同启动子中是与DNA直接结合的。果蝇中Mad直接结 合vestigial启动子上GC富集序列。但全长的Mad不能结合这段序列,只有去除C端结构 域的M ad才能结合[22]。C端结构域抑制N-L区段与DNA的结合,这种现象可以用N,C结构 域 的相互作用来解释。通常状态,N,C结构域相互作用,受体激活时,才暴露N,C区段[ 2 3]。Medea的N端结构域也同样作用于tinman启动子的GC富集区[24]。
通过PCR技术选择,Smad3和Smad4的最佳DNA结合序列被确定。这个made结合元件的序列是 GTCTAGAC,具有两个拷贝的GTCT回文序列,在它的互补链上是反向互补的AGAC序列。TGF- β诱导的转录激活作用必须有这段序列的串联重复[25]。Smad3和4也结合象TGAGTC AGA这样的序列,它是AP-1结合位点TGAGCA与Smad结合序列AGAC的交错重叠[21,26] 。 在PAI-1和JunB启动子中,Smad3和4直接结合CAGA序列[17,20]。这些序列与Smad 结 合元件的多联化能够发挥TGF-β和Smad3/4的作用,这些序列包括了串联重复的 AGAC或反 向互补序列GTCT。与Mad跟DNA结合的特性一致,C端结构域的缺失也能够大大增强Smads与这 些序列的亲合力[17,21,25]。
, http://www.100md.com
晶体学的分析也证实了Smad3的N端结构域与Smad结合元件之间的直接作用[27]。晶 体 分析结果显示,Smad3N端结构域11个氨基酸的β发夹结构插入到DNA大沟中,与特异的GTCT 序列联接。β发夹结构中的3个氨基酸残基与大沟中的3个碱基形成5个氢键以及另外3处与DN A磷酸骨架的联系。GTCT序列上单个的碱基突变会降低DNA与Smad的亲合力[25]。这 些 都说明GTCT(或AGAC)是Smad3的最佳结合序列。GTCT序列上第2个残基与Smad3的N端没有直接 的联系[27],它的突变几乎不改变DNA的亲合力[17,21,25]。
值得一提的是,尽管Smad2和Smad3有92%的序列同源性,但Smad2不结合上述序列,这也说 明Smad2和3在功能上不等同。这种不同可能是由于Smad2N端的β发夹结构之前,恰好插入了 一段30个氨基酸残基的序列,干扰了DNA的识别[27]。Smad2和Smad3在DNA结合特性 上 的差异也说明了为什么Smad3不能替代Smad2激活goosecoid启动子的转录 。[16]。
, 百拇医药
2.2 Smad与核内其他因子的协同作用:在TGF-β/activin/BMP信号通路中,通过实验表明 Smads与DNA结合蛋白在基因转录调节中 存在协同作用,即Smads的转录激活作用不仅依赖于自身与DNA序列的结合,也需要与其他转 录因子一起构成核蛋白复合物而起作用。Smads蛋白家族可通过结合不同蛋白去调节靶基因 的转录。图2如活化素和Smads2/4介导的Mix2或goosecoid等启动子的转录作用,必 须在Sma d2和FAST-1或2的相互作用下才能完成[14~16]。Smad3的N-C区段与C-Jun相 互 作用,C区段与C-Fos相互作用,形成多蛋白复合体,在启动子的AP-1-Smad3结合序列上 结合。Smad3/4与C-Jun/C-Fos的协同作用使启动子在TGF-β的诱导下转录[21,2 8 ]。Smads3/4还与TTE-3蛋白协同诱导TGF-β效应元件PAII-1启动子的转录。虽然还没 有发现Sm ad3/4与TFE-3之间的作用,但这3种蛋白都作用于启动子的1个区段,这个序列既包括了TF E-3结合的Ebox的序列,也包括了1个Smad3的结合位点[19]。CKIp15和p21的启动 子 对TGF-β效应定位在Sp-1结合点上,说明TGF-β介导的Smad的转录激活作用需要Sp1蛋白 [29]。Smad3与C-Jun[21],Smad2与FAST-1[14]或FAST-2 [16]结合都依赖膜受体的激活作用。
, http://www.100md.com
果蝇中,对Dpp诱导的tinman和Ubx启动子的转录作用 的分 析,进一步证明了上述的协同转录模式。同时具有Medea/Mad和Tinman结合位点的启动子才 能诱导tinman的转录。因此,Dpp介导的Medea/Mad复合体可能是和Tinman 蛋白一起协同介导tinman的转录。[24]。同样, Ubx[ WTBZ〗 启动子既有Mad的结合序列,也包括一段CRE(CAMP效应元件),Dpp诱导转录需要它们,因此M edea/Mad复合物与CREB协同诱导Ubx转录。[30]。
虽然只发现了Smads与FAST-1和FAST-2,C-Jun/C-Fos的直接作用,但在配体诱导下, Smad可与其他转录因子结合发挥协同作用。Smad3在这种作用下增强了C-Jun在AP-1结合位 点 处的活性[21]。但仍不清楚FAST-1和FAST-2是本身具有转录活性,还是在Smad2/ 4的转录作用中仅仅充当衔接子的角色。也不确定,Smad3/4是否加强了TFE-3本身的转录活 性 。虽然已经发现Smad与多种信号通路中的转录因子协同作用,但这种作用的结构基础仍需探 讨。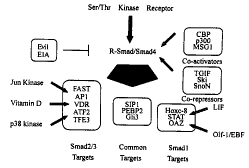
, 百拇医药
图2 Smads核内伴侣
在核内,R-Smad/Smad4复合物与调节的基因转录的多种蛋白相互作用。不同的DNA结合蛋白 能够特异地与Smad1或Smad2/3结合。SIP1、PEBP2和Gli3与两种R-Smads都可结合。在有些 情 况下,这些DNA结合蛋白也同时受到其他信号通路的调控。Smads可以通过与辅激活物或辅抑 制物 的相互作用调整基因表达。而E1A和Evi-1与Smads的相互作用可阻抑Smad介导的转录激活作 用。(引自 Cell, Vol.100,Jeffrey L 2000)*方框中表示转录调节蛋白。
Fig.2 The nuclear partners for Smads
In the nucleus,the R-Smad/Smad4 complex interacts with a variety of proteins to regulate transcription of target genes. Various DNA-binding proteins can inte r act specifically with either Smad1 or Smad2/3.SIP1,PEBP2,and Gli3 can bind with both R-Smads. In some cases,these DNA-binding proteins also receive inputs from other signaling pathways as indicated.Smads can then modulate gene expression b y recruiting either coactivators or corepressors.Interactions with proteins such as Evi-1 and E1A can block Smad-mediated transcriptional activation.(Cell,Vol. 100,Jeffrey L2000)
, 百拇医药
Smad的转录活性还依赖于辅激活因子的作用。Smad或3可增强Smad3的转录活性,这说明R-S mad的寡聚作用可以调节转录活性[18]。虽然Smad4本身不能激活转录,但它是Smad 复 合物中重要的辅激活因子。在Smad2/4与FAST-1的相互作用中,Smad4促进Smad复合物与D NA启动 子的结合[15]。在Smad2/4与FAST-2作用中,Smad4与DNA结合才能启动转录[ 16 ]。另外,Smad4辅激活因子还能稳定Smad复合物与通用转录因子的作用。[15,18 ]。这些都说明了为什么Smad4能够大大增强Smad1,2,3的转录活性。
CBP/p300也是Smad活性的重要辅助因子。已有研究证实,TGF-β介导的p15和p21的表达需 要CBP/p300的参与[31]。在HaCaT细胞中,E1A可以阻止TGF-β介导的生长抑制作 用 ,另外它也可以结合Rb并使Rb失活。而这些作用都来自于它与CBP/p300的结合,这种结合阻 碍了TGF-β介导的p15和p21的表达,从而使cyclin/CDK不受阻抑[32]。CBP/p300 能够把特异序列的激活因子转到通用转录复合物的附近,乙酰化组蛋白,修饰染色质的结构 。 CBP/p300是Smad2/Smad3的辅助激活因子,它们与Smad的C端结构直接作用[18,33,34,3 5]。在TGF-β的诱导下Smad3与CBP/p300结合,而Smad3C端的磷酸化促进这种结合。S mad3 必须结合CBP/p300才能激活转录。缺失C端的Smad3不能结合CBP,因而不能激活转录,而CBP 的作用受到影响也会抑制Smad3/4和TGF-β诱导的转录。因此,CBP/p300表达的增强可以 增 加Smad3的转录活性。但在缺乏Smad4的情况下,CBP不能发挥作用,这可能是因为Smad4能使 Smad3/CBP复合物稳定[18]。由于CBP/p300是多种转录因子的辅激活物,所以它们 促 进了Smad信号与其他信号通路的交联。Stat和Smad信号整合就说明了这一点。CBP/p300可以 使Stat3和Smad1在编码胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)基 因 的启动子处形成复合物[36]。细胞因子LIF(Leukemia inhibitory factor)通过受 体 相连的SAK激酶的酪氨酸磷酸化作用活化Stat3,活化的Stat3转移到核内,与特定基因的启动 子结合,并与p300N端序列相互作用诱导基因转录。BMP受体活化的Smad1与Smad4的复合物与 p300 N端序列相互作用诱导基因转录。BMP受体活化的Smad1与Smad4的复合物与p300 C端 相互 作用,所以很可能在GFAP启动子上也有一段结合序列。Stat3和Smad1与p300不同区段的相互 作用为不同信号通路转录水平的交联提供了另一种可能的机制。另有实验表明,在细胞活化 过程中,TGF-β可以抑制白介素12或4介导的Jak-Stat信号通路,这也说明了Stat和Smad 信号传递之间的交联[37,38]。
, http://www.100md.com
上述研究表明,Smad蛋白家族是TGF-β信号通路的胞内信号蛋白,而且作为转录因子介导T GF-β效应。同时,Smad还受到多种其他信号通路的调控,并与多种通路调节的其他转录因 子协同作用,共同调控目的基因的表达。以往的研究已证实TGF-β信号通路与MAPK、SAPK/ JNK、JAK/STAT等通路相关。Vitamin D3 与VitaminD受体结合,并激活VitaminD受体。Vita min D受体是核受体家庭成员,它在配体结合状态下可直接作用与特定启动子的VitaminD效 应元件从而介导Vitamin D的转录效应。在 SRC-1/TIE-2(steroid receptor coactivator - 1/transcriptional intermediary factor 2)蛋白家族成员存在时,Smad3可与Vitamin D受 体结合增强 Vitamin D受体的转录活性[39]。
总之,Smad蛋白的发现及对其功能的研究使我们对TGF-β信号通路有了清晰的了解,作为 信号蛋白,Smad与其他通路的交联,可能是胞内各信号通路整合的机制之一。另外,Smad与 其他通路转录因子的协同作用,也体现了信号传递的交联,并为TGF-β及其相关因子的多 功 能效应提供了理论依据,对Smad蛋白参与信号传递诱导基因转录作用分子机理的研究有助于 揭示TGF-β多功能作用的分子基础,并为阐明胞内信号通路之间的交联提供了新的线索。
, 百拇医药
参考文献
[1] Massague J.[C].Annu Rev Biochem,1998,67:753-791.
[2] Robert A B,Anzano M A,Lamb L C,et al.[J].Proc Natl Acad Sci USA,1 981,78(9 ):5339-5343.
[3] Ying Zhang, Rik Derynck. [J]. Trends in Cell Biology,1999,9(7):27 4-279.
[4] Le Sueur J A, Graff J M.[J]. Development, 1999,126(1):137-146.[ ZK)
[5] de Caestecker M P, Parks W T, Frank C J, et al.[J]. Genes Dev,199 8,12(11):1587-1592.
, http://www.100md.com
[6] Brown J D, Dichiara M R, Anderson K R, et al.[J]. J Biol Chem,199 9,247(13):8797-8805.
[7] Atfi A, Djelloul S, Chastre E, et al.[J]. J Biol Chem, 1997,272(3 ):1429-1432.
[8] Hocevar B A, Brown T L, Howe P H.[J], EMBO J, 1999,18(5):1345-1356.
[9] Kretzschmar M, Doody J, Massague J.[J]. Nature,1997,389(6651):618 -622.
[10] Kretzschmar M, Doody J, Timokhina I, et al.[J]. Genes Dev, 1999, 13(7):804-816.
, 百拇医药
[11] Afrakhte M, Moren A, Jossan S, et al. [J]. Biochem Biophys Res C ommun,1998,249(2):50 5-511.
[12] Ulloa L, Doody J, Massague J.[J]. Nature,1999,397(6721):710 -713.
[13] Chen X, Rubock M J, Whiteman M.[J]. Nature,1996,383(6602):691-6 96.
[14] Chen X, Weisberg E, Fridmacher V, et al.[J]. Nature,1997,389(664 6):85-89.
[15] Liu F, Pouponnot C, Massague J,[J]. Genes Dev,1997,11(23):3157 -3167.
, http://www.100md.com
[16] Labbe E, Silvestri C, Hoodless P A, et al.[J], Mol Cell,1998,2(1 ):109-120.
[17] Dennler S, Itoh S, Vivien D, et al.[J]. EMBO J,1998,17(11):3091 -3100.
[18] Feng XH, Zhang Y, Wu RY, et al.[J]. Genes Dev,1998,12(14):2153- 2163.
[19] Hua X, Liu X, Ansari D O, et al.[J]. Gene Dev,1998,12(19):3084- 3095.
[20] Jonk L, Itoh S, Heidin C-H,et al.[J]. J Biol Chem,1998,273(33) :21145-21152.
, 百拇医药
[21] Zhang Y, Feng XH, Derynck R,[J]. Nature,1998,394(6696):909-913.
[22] Kim J, Johnson K, Chen H, et al.[J]. Nature,1997,388(6639):3 04-308.
[23] Hata A, Lo R S, Wotton D, et al.[J]. Nature,1997,388(6637):82-8 7.
[24] Xu X, Yin Z, Hudson J B, et al.[J]. Genes Dev,1998,12(15):2354- 2370.
[25] Zawel L, Dai S, Buckhanlts P, et al.[J]. Mol Cell,1998,1(4):611 -617.
, 百拇医药
[26] Ying Ling J, Datto M, Wong C, et al.[J]. Mol Cell 1997,17(12):70 19-7028.
[27] Shi Y, Wang YF, Jayaraman L, et al.[J]. Cell,1998,94(5 ):585-594.
[28] Wong C, Koupier-Chapman EM, Frederick SP, et al.[J]. Mol Cell B iol,1999,19(3):1812-1830.
[29] Datto MB, YU Y, Wang XF.[J]. J Biol Chem,1995, 270(48):28623-28628.
[30] Szuts D, Eresh S, Bienz M.[J]. Genes Dev, 1998,12(13):2022-203 5.
, 百拇医药
[31] Datto M B, Hu P P-C, Kowalik T F, et al.[J]. M ol Cell Biol,1997,17(4):2030-2037.
[32] Missero C, Calautti E, Eckner R, et al.[J]. Proc Natl Acad Sci U SA,1995,92(12):5451-5455.
[33] Janknecht R, Wells N J, Hunter T.[J]. Genes and Dev,1998, 12(14):2114-2119.
[34] Pouponnot C, Jayaraman L, Massague J.[J]. J Biol Chem,1998,273(3 6):22865-22868.
[35] Topper J N, Dichiara MR. Brown JD, et al.[J]. Proc Natl Acad Sci USA,1998,95(16):9506-9 511.
, http://www.100md.com
[36] Nakashima K, Yanagisawa M, Arakawa H, et al.[J]. Science, 1999,2 84(5413):479-482.
[37] Bright J J, Sriram S.[J]. J Immanol,1998,161(4):1772-1777.
[38] Pardoux C.[J]. Blood,1999,93(5):1448-1455.
[39] Junn Y, Yasuo Y, Yoshikazu M, et al.[J]. Science,1999,283 (5406):1317-1321.
【收稿日期】2000-08-31 【修回日期】2000-09-15, http://www.100md.com
单位:北京师范大学生命科学学院,细胞增殖及调控生物学教育部重点实验室,北京10 0875
关键词:
解剖学报00zk04
【中图分类号】 Q257 【文献标识码】 A 【文章编号】 0529-1356(2000)增-13
THE RELATIONSHIP BETWEEN Smads AND REGULATION OF GENE TRANSCRIPTION IN TGF-β SIGNALING PATHWAY
转化生长因子β(transforming growth factor)家族由一类结构、功能相关的多肽生长因子 亚家族组成,其中包括TGF-β、活化素(activin)、骨形态发生蛋白(BMP)、生长分化因子( GDF)等[1]。TGF-β除了影响细胞的增殖、分化,还在胚胎发育、胞外基质形成、 骨的形成和重建等方面起着重要作用。TGF-β家族成员广泛存在于从果蝇到人多种生物的 各种组织中,对正常细胞、癌变细胞都有着显著作用。
, 百拇医药
【基金项目】国家自然科学基金资助项目(39780014),国家重点基础研 究项目(G1999053901),北京市自然科学基金资助项目(7961001)(G10000539901)
【作者简介】 汪娟(1975—),女(汉族),河南省信阳市人,在读博士
转化生长因子β(transforming growth factor)家族由一类结构、功能相关的多肽生长因子 亚家族组成,其中包括TGF-β、活化素(activin)、骨形态发生蛋白(BMP)、生长分化因子( GDF)等[1]。TGF-β除了影响细胞的增殖、分化,还在胚胎发育、胞外基质形成、 骨的形成和重建等方面起着重要作用。TGF-β家族成员广泛存在于从果蝇到人多种生物的 各种组织中,对正常细胞、癌变细胞都有着显著作用。
由于TGF-β作用的多功能性和广泛性,所以从1981年Robert[2]发现TGF ̄β以来 ,对它的研究是沿着不同的路线进行的,但对其信号传导的通路一直不清楚。直到近来发现 了细胞内信号转导蛋白Smad家族,才较深入地阐明了TGF-β信号从膜到核转运的分子机理 。
, 百拇医药
TGF-β家族成员通过与两种类型的跨膜丝氨酸/苏氨酸激酶受体异源复合物结合,启动了细 胞反应。胞内信号蛋白Smads被受体激酶活化,形成异源蛋白复合物转移到核内,与特定的D NA序列结合,指导转录,从而实现TGF-β对基因表达的调控。
通过EST文库和cDNA文库筛选,已经在脊椎动物中至少已克隆出9种Smad基因[3],在 Drosophila(果蝇)和Caenorhabditis elegans(尼采蝇) 中发现 了它们的同源物。Smad蛋白的分子量大约在42kD到60kD,其N端和C端各有一段高度保守的区 域,分别称为MH1区和MH2区(mad ̄homology domain ),中间有一段富含pro的L区连接。 在非活性状态下,Smad的MH1区和MH2区相互作用,形成自我抑制,被受体激活后,分子 打开,Smad形成异源复合物,转移到核内。
, 百拇医药 不同的Smad家族在信号传递中作用不同。根据结构和功能上的特点,Smad蛋白被分为3类:( 1)R-Smad (receptor-activated Smads),包括Smad1、2、3、5、8,它们是Ⅰ型受体激酶 的底物,具有通路特异性(pathway-restricted)(2)Co-Smad(common ̄mediator sm ads),脊 椎动物中Smad4属于此类,它通过此类与R-Smad的结合,参与信号传递;(3)I-Smads(inhi bitory Smads),包括Smad6,7,它们抑制R-Smad的信号传递功能(附表)。附表 Smad蛋白家族
Table The Smad family 配体
ligand
R-Smad
Co-Smad
, 百拇医药 I-Smad
脊椎动物
vertebrate
BMPs
activin,TGF-β
Unknown
果蝇
Smad1,5,8
Smad2,3
Smad4
Smad4
Smad10注
, 百拇医药
Smad6(Sma d7)
Smad7(Smad6)
Drosophila
Dpp
dActivin
尼采蝇
MAD
dSmad2
Me dea
DAD
C.elegans
Dbl-1
, 百拇医药
Daf-7
Sma-2,-3
Daf-8,-14
Sma-4
Daf-3
注:Smad10[4]与Smad4有高度保守的序列。因此,被归为Co-Smad。
Smad10 shares a high level of sequence identity with Smad4.Thus it is ragarded a s Co-Smad.
1.Smad信号传递与其他通路的交联(crosstalk)
现在对Smads如何介导配体信号激活目的基因转录的机制已大致清楚。TGF-β超家族成员先 与细胞膜上的TGF-βⅡ型受体结合,然后吸收Ⅰ型受体在细胞膜上形成一个异源复合物, Ⅰ型受体被Ⅱ受体激酶磷酸化并被激活,活化的Ⅰ型受体与R-Smads暂时结合,磷酸化R-S madsC端SS(V/M)S区的ser残基。Smad1,5,8被BMP受体磷酸化,介导BMP信号,而Smad2,3被 activin和TGF-β受体所活化,介导这些因子的效应。受体对R-Smads的磷酸化使活化的Sm ads构象发生变化后从受体上解离下来,并与Smad4结合。结合后异源寡聚物转移到核内,激 活特定基因的转录。(图1)
, 百拇医药
近年来,随着对不同信号通路间相互交联(crosstalk)的研究,人们发现Smads蛋白不仅受 T GF-β信号的调节,而且很多信号通路对其都有调控作用。Smad信号和生长因子激活的酪氨 酸激酶受体信号以及随后的MAPK通路在若干水平上发生交联。有研究发现,EGF和HGF激活的 酪氨酸激酶受体可以激活依赖于Smad2的基因表达。这种效应是由于Smad2的磷酸化所致。但 是这种磷酸化不是发生在activin和TGF-β受体激酶作用的C端ser位点上[5]。虽 然 还需要进一步确定上述激酶的效应,但上述结果仍然显示Smad的激活可能并不仅仅依赖于TG F-β相关因子受体。Smad2还可以被MEKK-1(MAPK kinase kinase-1)所激活。MEKK-1是S AP K/JNK(stress-activated protein kinase/c-Jun Nterminal kinase)通路的激活物。ME KK-1对Smad2的磷酸化加强了Smad2~Smad4的相互作用和核内积累,同时也增强了Smad2与 转录辅激活因子CBP(CREB-binding protein)的结合[6]。另外,MEKK-1,JNK1和 MEK-4(MEK-4是JNK上游的一种激活因子)的显性失活形式会抑制TGF-β诱导的基因表达, 这都显示了SAPK/JNK通路参与了TGF-β信号传递[6~8]。但目前还不清楚HGF和EG F对Smad2的激活作用是否是SAPK/JNK通路对其磷酸化的结果。

, 百拇医药
图1 TGF-β/SMAD通路
Fig.1 The transforming growth factor β(TGF-β)/SMAD pathway
与SAPK/JNK通路的正调作用相比,传统的MAPK/ERK(mitogen-activated protein kinase/extracellular-sigal-related kinase)通路可能是Smad信号传递的负调因子。MAP激酶Er k可以磷酸化Smad1L区段PXSP单元的ser残基[9]。这种磷酸化作用会抑制Smad1的核 转 移和转录激活作用,这说明酪氨酸激酶受体抑制BMP的信号传递。同样,活化的MAPK Kinase 1(MEK-1)或癌基因产物Ras也可以诱导TGF ̄β活化的Smad2和Smad3核内的积累和依赖于Sma d的转录[10]。现在还不清楚SAPK/JNK或MAPK/Erk对Smads的磷酸化作用是否发生在 同一位点。但是,上述发现证明了Smads能够整合来源于细胞内不同信号的通路。
, 百拇医药
酪氨酸激酶受体通路对Smad信号通路的抑制作用还可以通过诱导抑制型Smad6和Smad7的表达 而实现。EGF具有与TGF-β相似的诱导Smad6和Smad7表达的作用。另外,PKC的激活剂PMA在 激活MAPK通路的同时大大增强了TGF-β诱导的Smad6和Smad7的表达[11]。干扰素 γ 通过激活酪氨酸激酶Jak1,然后磷酸化转录因子Stat1而发生作用。已经发现干扰素γ可以 诱导Smad7的表达,但不能诱导Smad6[12]。对抑制型Smad的诱导可以抑制R-Smad 的信号 传递作用,从而抑制TGF-β家族成员的作用。因此,诱导抑制型Smad的表达可能是Jak-S tat通路反式调控Smad信号传递的机制。
综上所述,Smad不仅是TGF-β通路的胞内信号蛋白,而且受到多种信号通路的影响。这 些都说明了不同信号在胞内的整合作用。
2.Smad蛋白与基因转录
, 百拇医药
2.1 Smad与DNA启动子序列的结合:在过去的十几年中,在不同的启动子中已经发现了多 种TG F-β和活化素的效应元件,但它们没有明显一致的序列,只是发现TGF-β诱导的转录作用 常常需要一些已知的转录因子如AP-1,Sp1,CTF/NT-1之类的结合位点。近年来人们才逐步 了解Smads调节转录的机制,Smads与启动子序列直接结合,并与其他转录因子一起协同调节 转录。
进入核以后,磷酸化的Smads异源复合物与效应物配体的启动子序列之间相互作用,调节转 录。首次被确证与Smads结合作用于启动子DNA的蛋白是FAST(forehead activin signal tr ansducer)。介导activin效应的Smad2/4复合物与FAST-1结合,作用于非洲爪蟾的Mix2 启动 子,FAST-1是一种翼状螺旋转录因子,是activin的效应元件[13,14]。在上述 过 程中,Smad2与FAST-1之间是直接作用的,而Smad4则是通过它与Smad2的结合,参与到Smad2 /FAST-1复合物中[14,15]。Smad2/4复合物还通过类似的方式作用于小鼠的 goosecoid启动子。不过,在goosecoid启动子上,参与结合的是 FAST -2,而不是FASF1,FAST-2与FAST-1结构上相关,它所结合的序列与FAST-1的相似 [16]。Smad 3/4与PAI-1[17~19],JunB[20],collagenase[21]等启动子的 作用也与上述过程类似。
, http://www.100md.com
Smads与确定的启动子序列直接作用,这一点让人有些吃惊。因为第1篇报道Smad2和 Mix2启动子之间作用的文章强调它们是通过FAST-1间接作用的[13]。 但是 ,现在已经有很多文献说明了Smads在不同启动子中是与DNA直接结合的。果蝇中Mad直接结 合vestigial启动子上GC富集序列。但全长的Mad不能结合这段序列,只有去除C端结构 域的M ad才能结合[22]。C端结构域抑制N-L区段与DNA的结合,这种现象可以用N,C结构 域 的相互作用来解释。通常状态,N,C结构域相互作用,受体激活时,才暴露N,C区段[ 2 3]。Medea的N端结构域也同样作用于tinman启动子的GC富集区[24]。
通过PCR技术选择,Smad3和Smad4的最佳DNA结合序列被确定。这个made结合元件的序列是 GTCTAGAC,具有两个拷贝的GTCT回文序列,在它的互补链上是反向互补的AGAC序列。TGF- β诱导的转录激活作用必须有这段序列的串联重复[25]。Smad3和4也结合象TGAGTC AGA这样的序列,它是AP-1结合位点TGAGCA与Smad结合序列AGAC的交错重叠[21,26] 。 在PAI-1和JunB启动子中,Smad3和4直接结合CAGA序列[17,20]。这些序列与Smad 结 合元件的多联化能够发挥TGF-β和Smad3/4的作用,这些序列包括了串联重复的 AGAC或反 向互补序列GTCT。与Mad跟DNA结合的特性一致,C端结构域的缺失也能够大大增强Smads与这 些序列的亲合力[17,21,25]。
, http://www.100md.com
晶体学的分析也证实了Smad3的N端结构域与Smad结合元件之间的直接作用[27]。晶 体 分析结果显示,Smad3N端结构域11个氨基酸的β发夹结构插入到DNA大沟中,与特异的GTCT 序列联接。β发夹结构中的3个氨基酸残基与大沟中的3个碱基形成5个氢键以及另外3处与DN A磷酸骨架的联系。GTCT序列上单个的碱基突变会降低DNA与Smad的亲合力[25]。这 些 都说明GTCT(或AGAC)是Smad3的最佳结合序列。GTCT序列上第2个残基与Smad3的N端没有直接 的联系[27],它的突变几乎不改变DNA的亲合力[17,21,25]。
值得一提的是,尽管Smad2和Smad3有92%的序列同源性,但Smad2不结合上述序列,这也说 明Smad2和3在功能上不等同。这种不同可能是由于Smad2N端的β发夹结构之前,恰好插入了 一段30个氨基酸残基的序列,干扰了DNA的识别[27]。Smad2和Smad3在DNA结合特性 上 的差异也说明了为什么Smad3不能替代Smad2激活goosecoid启动子的转录 。[16]。
, 百拇医药
2.2 Smad与核内其他因子的协同作用:在TGF-β/activin/BMP信号通路中,通过实验表明 Smads与DNA结合蛋白在基因转录调节中 存在协同作用,即Smads的转录激活作用不仅依赖于自身与DNA序列的结合,也需要与其他转 录因子一起构成核蛋白复合物而起作用。Smads蛋白家族可通过结合不同蛋白去调节靶基因 的转录。图2如活化素和Smads2/4介导的Mix2或goosecoid等启动子的转录作用,必 须在Sma d2和FAST-1或2的相互作用下才能完成[14~16]。Smad3的N-C区段与C-Jun相 互 作用,C区段与C-Fos相互作用,形成多蛋白复合体,在启动子的AP-1-Smad3结合序列上 结合。Smad3/4与C-Jun/C-Fos的协同作用使启动子在TGF-β的诱导下转录[21,2 8 ]。Smads3/4还与TTE-3蛋白协同诱导TGF-β效应元件PAII-1启动子的转录。虽然还没 有发现Sm ad3/4与TFE-3之间的作用,但这3种蛋白都作用于启动子的1个区段,这个序列既包括了TF E-3结合的Ebox的序列,也包括了1个Smad3的结合位点[19]。CKIp15和p21的启动 子 对TGF-β效应定位在Sp-1结合点上,说明TGF-β介导的Smad的转录激活作用需要Sp1蛋白 [29]。Smad3与C-Jun[21],Smad2与FAST-1[14]或FAST-2 [16]结合都依赖膜受体的激活作用。
, http://www.100md.com
果蝇中,对Dpp诱导的tinman和Ubx启动子的转录作用 的分 析,进一步证明了上述的协同转录模式。同时具有Medea/Mad和Tinman结合位点的启动子才 能诱导tinman的转录。因此,Dpp介导的Medea/Mad复合体可能是和Tinman 蛋白一起协同介导tinman的转录。[24]。同样, Ubx[ WTBZ〗 启动子既有Mad的结合序列,也包括一段CRE(CAMP效应元件),Dpp诱导转录需要它们,因此M edea/Mad复合物与CREB协同诱导Ubx转录。[30]。
虽然只发现了Smads与FAST-1和FAST-2,C-Jun/C-Fos的直接作用,但在配体诱导下, Smad可与其他转录因子结合发挥协同作用。Smad3在这种作用下增强了C-Jun在AP-1结合位 点 处的活性[21]。但仍不清楚FAST-1和FAST-2是本身具有转录活性,还是在Smad2/ 4的转录作用中仅仅充当衔接子的角色。也不确定,Smad3/4是否加强了TFE-3本身的转录活 性 。虽然已经发现Smad与多种信号通路中的转录因子协同作用,但这种作用的结构基础仍需探 讨。

, 百拇医药
图2 Smads核内伴侣
在核内,R-Smad/Smad4复合物与调节的基因转录的多种蛋白相互作用。不同的DNA结合蛋白 能够特异地与Smad1或Smad2/3结合。SIP1、PEBP2和Gli3与两种R-Smads都可结合。在有些 情 况下,这些DNA结合蛋白也同时受到其他信号通路的调控。Smads可以通过与辅激活物或辅抑 制物 的相互作用调整基因表达。而E1A和Evi-1与Smads的相互作用可阻抑Smad介导的转录激活作 用。(引自 Cell, Vol.100,Jeffrey L 2000)*方框中表示转录调节蛋白。
Fig.2 The nuclear partners for Smads
In the nucleus,the R-Smad/Smad4 complex interacts with a variety of proteins to regulate transcription of target genes. Various DNA-binding proteins can inte r act specifically with either Smad1 or Smad2/3.SIP1,PEBP2,and Gli3 can bind with both R-Smads. In some cases,these DNA-binding proteins also receive inputs from other signaling pathways as indicated.Smads can then modulate gene expression b y recruiting either coactivators or corepressors.Interactions with proteins such as Evi-1 and E1A can block Smad-mediated transcriptional activation.(Cell,Vol. 100,Jeffrey L2000)
, 百拇医药
Smad的转录活性还依赖于辅激活因子的作用。Smad或3可增强Smad3的转录活性,这说明R-S mad的寡聚作用可以调节转录活性[18]。虽然Smad4本身不能激活转录,但它是Smad 复 合物中重要的辅激活因子。在Smad2/4与FAST-1的相互作用中,Smad4促进Smad复合物与D NA启动 子的结合[15]。在Smad2/4与FAST-2作用中,Smad4与DNA结合才能启动转录[ 16 ]。另外,Smad4辅激活因子还能稳定Smad复合物与通用转录因子的作用。[15,18 ]。这些都说明了为什么Smad4能够大大增强Smad1,2,3的转录活性。
CBP/p300也是Smad活性的重要辅助因子。已有研究证实,TGF-β介导的p15和p21的表达需 要CBP/p300的参与[31]。在HaCaT细胞中,E1A可以阻止TGF-β介导的生长抑制作 用 ,另外它也可以结合Rb并使Rb失活。而这些作用都来自于它与CBP/p300的结合,这种结合阻 碍了TGF-β介导的p15和p21的表达,从而使cyclin/CDK不受阻抑[32]。CBP/p300 能够把特异序列的激活因子转到通用转录复合物的附近,乙酰化组蛋白,修饰染色质的结构 。 CBP/p300是Smad2/Smad3的辅助激活因子,它们与Smad的C端结构直接作用[18,33,34,3 5]。在TGF-β的诱导下Smad3与CBP/p300结合,而Smad3C端的磷酸化促进这种结合。S mad3 必须结合CBP/p300才能激活转录。缺失C端的Smad3不能结合CBP,因而不能激活转录,而CBP 的作用受到影响也会抑制Smad3/4和TGF-β诱导的转录。因此,CBP/p300表达的增强可以 增 加Smad3的转录活性。但在缺乏Smad4的情况下,CBP不能发挥作用,这可能是因为Smad4能使 Smad3/CBP复合物稳定[18]。由于CBP/p300是多种转录因子的辅激活物,所以它们 促 进了Smad信号与其他信号通路的交联。Stat和Smad信号整合就说明了这一点。CBP/p300可以 使Stat3和Smad1在编码胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)基 因 的启动子处形成复合物[36]。细胞因子LIF(Leukemia inhibitory factor)通过受 体 相连的SAK激酶的酪氨酸磷酸化作用活化Stat3,活化的Stat3转移到核内,与特定基因的启动 子结合,并与p300N端序列相互作用诱导基因转录。BMP受体活化的Smad1与Smad4的复合物与 p300 N端序列相互作用诱导基因转录。BMP受体活化的Smad1与Smad4的复合物与p300 C端 相互 作用,所以很可能在GFAP启动子上也有一段结合序列。Stat3和Smad1与p300不同区段的相互 作用为不同信号通路转录水平的交联提供了另一种可能的机制。另有实验表明,在细胞活化 过程中,TGF-β可以抑制白介素12或4介导的Jak-Stat信号通路,这也说明了Stat和Smad 信号传递之间的交联[37,38]。
, http://www.100md.com
上述研究表明,Smad蛋白家族是TGF-β信号通路的胞内信号蛋白,而且作为转录因子介导T GF-β效应。同时,Smad还受到多种其他信号通路的调控,并与多种通路调节的其他转录因 子协同作用,共同调控目的基因的表达。以往的研究已证实TGF-β信号通路与MAPK、SAPK/ JNK、JAK/STAT等通路相关。Vitamin D3 与VitaminD受体结合,并激活VitaminD受体。Vita min D受体是核受体家庭成员,它在配体结合状态下可直接作用与特定启动子的VitaminD效 应元件从而介导Vitamin D的转录效应。在 SRC-1/TIE-2(steroid receptor coactivator - 1/transcriptional intermediary factor 2)蛋白家族成员存在时,Smad3可与Vitamin D受 体结合增强 Vitamin D受体的转录活性[39]。
总之,Smad蛋白的发现及对其功能的研究使我们对TGF-β信号通路有了清晰的了解,作为 信号蛋白,Smad与其他通路的交联,可能是胞内各信号通路整合的机制之一。另外,Smad与 其他通路转录因子的协同作用,也体现了信号传递的交联,并为TGF-β及其相关因子的多 功 能效应提供了理论依据,对Smad蛋白参与信号传递诱导基因转录作用分子机理的研究有助于 揭示TGF-β多功能作用的分子基础,并为阐明胞内信号通路之间的交联提供了新的线索。
, 百拇医药
参考文献
[1] Massague J.[C].Annu Rev Biochem,1998,67:753-791.
[2] Robert A B,Anzano M A,Lamb L C,et al.[J].Proc Natl Acad Sci USA,1 981,78(9 ):5339-5343.
[3] Ying Zhang, Rik Derynck. [J]. Trends in Cell Biology,1999,9(7):27 4-279.
[4] Le Sueur J A, Graff J M.[J]. Development, 1999,126(1):137-146.[ ZK)
[5] de Caestecker M P, Parks W T, Frank C J, et al.[J]. Genes Dev,199 8,12(11):1587-1592.
, http://www.100md.com
[6] Brown J D, Dichiara M R, Anderson K R, et al.[J]. J Biol Chem,199 9,247(13):8797-8805.
[7] Atfi A, Djelloul S, Chastre E, et al.[J]. J Biol Chem, 1997,272(3 ):1429-1432.
[8] Hocevar B A, Brown T L, Howe P H.[J], EMBO J, 1999,18(5):1345-1356.
[9] Kretzschmar M, Doody J, Massague J.[J]. Nature,1997,389(6651):618 -622.
[10] Kretzschmar M, Doody J, Timokhina I, et al.[J]. Genes Dev, 1999, 13(7):804-816.
, 百拇医药
[11] Afrakhte M, Moren A, Jossan S, et al. [J]. Biochem Biophys Res C ommun,1998,249(2):50 5-511.
[12] Ulloa L, Doody J, Massague J.[J]. Nature,1999,397(6721):710 -713.
[13] Chen X, Rubock M J, Whiteman M.[J]. Nature,1996,383(6602):691-6 96.
[14] Chen X, Weisberg E, Fridmacher V, et al.[J]. Nature,1997,389(664 6):85-89.
[15] Liu F, Pouponnot C, Massague J,[J]. Genes Dev,1997,11(23):3157 -3167.
, http://www.100md.com
[16] Labbe E, Silvestri C, Hoodless P A, et al.[J], Mol Cell,1998,2(1 ):109-120.
[17] Dennler S, Itoh S, Vivien D, et al.[J]. EMBO J,1998,17(11):3091 -3100.
[18] Feng XH, Zhang Y, Wu RY, et al.[J]. Genes Dev,1998,12(14):2153- 2163.
[19] Hua X, Liu X, Ansari D O, et al.[J]. Gene Dev,1998,12(19):3084- 3095.
[20] Jonk L, Itoh S, Heidin C-H,et al.[J]. J Biol Chem,1998,273(33) :21145-21152.
, 百拇医药
[21] Zhang Y, Feng XH, Derynck R,[J]. Nature,1998,394(6696):909-913.
[22] Kim J, Johnson K, Chen H, et al.[J]. Nature,1997,388(6639):3 04-308.
[23] Hata A, Lo R S, Wotton D, et al.[J]. Nature,1997,388(6637):82-8 7.
[24] Xu X, Yin Z, Hudson J B, et al.[J]. Genes Dev,1998,12(15):2354- 2370.
[25] Zawel L, Dai S, Buckhanlts P, et al.[J]. Mol Cell,1998,1(4):611 -617.
, 百拇医药
[26] Ying Ling J, Datto M, Wong C, et al.[J]. Mol Cell 1997,17(12):70 19-7028.
[27] Shi Y, Wang YF, Jayaraman L, et al.[J]. Cell,1998,94(5 ):585-594.
[28] Wong C, Koupier-Chapman EM, Frederick SP, et al.[J]. Mol Cell B iol,1999,19(3):1812-1830.
[29] Datto MB, YU Y, Wang XF.[J]. J Biol Chem,1995, 270(48):28623-28628.
[30] Szuts D, Eresh S, Bienz M.[J]. Genes Dev, 1998,12(13):2022-203 5.
, 百拇医药
[31] Datto M B, Hu P P-C, Kowalik T F, et al.[J]. M ol Cell Biol,1997,17(4):2030-2037.
[32] Missero C, Calautti E, Eckner R, et al.[J]. Proc Natl Acad Sci U SA,1995,92(12):5451-5455.
[33] Janknecht R, Wells N J, Hunter T.[J]. Genes and Dev,1998, 12(14):2114-2119.
[34] Pouponnot C, Jayaraman L, Massague J.[J]. J Biol Chem,1998,273(3 6):22865-22868.
[35] Topper J N, Dichiara MR. Brown JD, et al.[J]. Proc Natl Acad Sci USA,1998,95(16):9506-9 511.
, http://www.100md.com
[36] Nakashima K, Yanagisawa M, Arakawa H, et al.[J]. Science, 1999,2 84(5413):479-482.
[37] Bright J J, Sriram S.[J]. J Immanol,1998,161(4):1772-1777.
[38] Pardoux C.[J]. Blood,1999,93(5):1448-1455.
[39] Junn Y, Yasuo Y, Yoshikazu M, et al.[J]. Science,1999,283 (5406):1317-1321.
【收稿日期】2000-08-31 【修回日期】2000-09-15, http://www.100md.com