重组日本血吸虫SjGST-Sj32蛋白诱导小鼠保护性免疫的研究①
作者:蔡 春 易新元 曾宪芳 周金春 舒新华
单位:寄生虫学教研室 长沙 410078
关键词:日本血吸虫;重组蛋白类;疫苗;免疫;小鼠
湖南医科大学学报990304 提要 应用基因工程技术分别表达出SjGST-Sj32,Sj32和SjGST,用于保护性免疫的动物实验及其体液免疫机制的初步探讨。结果:与对照组相比,重组SjGST-Sj32组,Sj32组,Sj32+SjGST组均有明显的减虫效果(P<0.05)。上述三组及SjGST组的肝脏虫卵计数均较对照组为少(P<0.01)。提示重组Sj32kD蛋白可诱导小鼠产生明显的抗日本血吸虫攻击感染的保护性免疫及抗生殖免疫效果,而SjGST仅表现出一定的抗生殖免疫效果。
中国图书分类号 R383.24
Schistosoma japonicum: Protective immunity induced
, http://www.100md.com
in mice immunized with SjGST-Sj32①
Cai Chun Yi Xinyuan② Zeng Xianfang Zhou Jinchun Shu Xinhua
(Department of Parasitology, Hunan Medical University, Changsha 410078)
Schistosoma japonicum glutathione-s-transferase(SjGST), Schistosoma japonicum 32000 protein(Sj32) and SjGST-Sj32 were expressed and purified to study on protective immunity against Schistosoma japonicum. The result showed that compared with the adjuvant control group, the worm burden was decreased significantly in mice immunized with recombinant SjGST-Sj32, Sj32 and Sj32+SjGST (P<0.05). At the same time, the liver egg per gram(EPG) was decreased in mice immunized with SjGST-Sj32, Sj32, Sj32+SjGST and SjGST. It is concluded that Sj32 significantly induces both protective immunity and anti-fecundity immunity, but SjGST only has an anti-fecundity effect.
, 百拇医药
Key words Schistosoma japonicum; recombinant proteins; vaccine; immune; mice
①Supported by WHO/TDR Grant(ID980225) and Hunan Provincial Research Grant(98SSY1007)
②Suppervisor
日本血吸虫(Schistosoma japonicum, Sj)成虫营养主要来源于两方面,一方面通过虫体表膜转运糖类、氨基酸及核酸前体,另一方面通过肠道内的血红蛋白酶消化宿主的血红蛋白获得营养。后者为血吸虫的主要营养来源。我室曾对日本血吸虫成分31000/32000抗原诱导保护性免疫的可能性进行探讨,发现该抗原可诱导小鼠产生较强的抗生殖免疫[1]。为此,作者等采用基因工程技术,制备了重组日本血吸虫成虫32000抗原(Sj32)、日本血吸虫26000谷胱甘肽-S-转移酶(SjGST)及二者的融合蛋白(SjGST-Sj32),通过免疫小鼠,观察其减虫、减卵作用,同时测定了血清抗体滴度及动态,对保护性免疫的机制进行了初步探讨。
, 百拇医药
1 材料与方法
1.1 动物 BALB/c近交系小鼠,8~10周龄,雄性,中国科学院上海实验动物中心提供。
1.2 免疫原的制备 共制备4种免疫原,均为重组蛋白。Sj32:将Sj32基因亚克隆至pET16b载体,使之表达Sj32蛋白。SjGST-Sj32:将Sj32基因亚克隆至pGEX-5X-3载体(含SjGST基因),使之表达SjGST-Sj32融合蛋白;SjGST26由pGEX-5X-3表达。将单独的SjGST和Sj32在试管内相加,即SjGST+Sj32。表达的产物加8M尿素溶解,免疫前依次经过含1M尿素,2mM还原型谷胱甘肽、0.02mM氧化型谷胱甘肽及0.005%吐温-80的Tris-HCl缓冲液(pH 8.0)和0.2M磷酸盐缓冲液(pH 7.2)透析复性后备用。
1.3 免疫方法 按随机区组设计,将小鼠随机分为5组。实验组在0,3,5周每鼠注射50μg重组蛋白加福氏完全佐剂(FCA)。佐剂对照组在同一时间注射FCA。第三次免疫后5周每鼠经皮肤感染50条尾蚴,45d后采用门脉灌注法收集成虫计数。取1g肝脏进行每克肝卵(EPG)计数和每雌肝卵(EPF)计数,观察各组抗感染免疫及抗生殖免疫效果。
, 百拇医药
1.4 血清采集 于第一次免疫前,0周(S1),第二次免疫前,3周(S2),第三次免疫前,5周(S3),第三次免疫后2周,7周(S4),攻击感染前,10周(S5)及解剖冲虫前,16周(S6)采血,每次150μl。收集血清置-20℃保存用于抗体检测。
1.5 体液免疫水平测定 用ELISA法测定:①攻击感染前鼠血清抗体滴度,从1∶100开始倍比稀释至 1∶51200。②血清以1∶800稀释,检测每只鼠6个不同时间点的血清。每份血清的每个滴度测2个平行孔,用Tris-HCl-8M尿素(pH8.0)稀释Sj32和SjGST,使其终浓度分别为7μg.ml-1和10μg.ml-1。每孔100μl包板,同时设参考阳性,参考阴性及空白对照。E960酶标仪测定光密度值(OD)。按照测试样本OD值与参考阴性OD值的比值S/N≥2.1判为阳性。
, 百拇医药
2 结 果
2.1 SjGST-Sj32蛋白免疫小鼠的减虫效果 与佐剂对照组相比,SjGST-Sj32组,Sj32+SjGST组和Sj32组虫数明显减少,统计学上差异有显著性(P<0.05),而SjGST组虫数减少不明显。说明Sj32能引起小鼠产生抗日本血吸虫攻击感染的保护性免疫,而SjGST则不具备此作用。两者无论以融合蛋白形式或混合形式均有减虫作用(表1)。
表1 SjGST-Sj32蛋白免疫小鼠的减虫效果 组别
鼠数
(只)
平均检获成虫数
(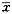 ±s)
±s)
, 百拇医药
减虫率
(%)
FCA对照
9
18.7±4.8
-
Sj32+SjGST
10
10.0±4.9
46.4①
Sj32+SjGST
10
, http://www.100md.com 10.9±6.5
41.6①
Sj32
12
11.5±8.2
38.4①
SjGST
11
17.6±8.9
5.5①
①与FCA对照相比:P<0.05
2.2 SjGST-Sj32蛋白免疫小鼠的肝卵计数 与对照组比较,SjGST-Sj32组,Sj32+SjGST组,Sj32组和SjGST组的每克肝卵数均明显减少,统计学上差异有高度显著性(P<0.01);前三组组间差异无显著性(P>0.05)。与对照组比较,SjGST-Sj32组,Sj32+SjGST组,Sj32组和SjGST组每雌肝组织虫卵计数均明显减少,差异有高度显著性(P<0.01),而4组之间差异无显著性(表2)。
, http://www.100md.com
表2 重组SjGST-Sj32蛋白免疫小鼠的肝卵计数 组别
鼠数(只)
EPG
(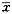 ±s)
±s)
EPG减卵率
(%)
EPF
(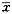 ±s)
±s)
EPF减卵率
(%)
, 百拇医药
FCA对照
9
73642.0±17436.4
-
8592.3±2821.7
-
SjGST-Sj32
10
25092.9±12172.6
65.9①
4974.2±822.6
42.1①
, http://www.100md.com
Sj32+SjGST
10
29391.0±18552.4
60.1①
5525.2±2605.0
35.7①
Sj32
12
29818.4±22250.9
59.5①
5015.4±934.1
, 百拇医药
41.6①
SjGST
11
42507.4±20125.1
42.3①
4940.9±436.6
42.5①
①与FCA对照:P<0.01
2.3 SjGST-Sj32蛋白免疫小鼠的特异性抗体滴度 分别用SjGST和Sj32包板,ELISA法检测末次免疫后5w(即攻击感染前)小鼠血清中特异性抗体的滴度。结果显示:与对照组相比,用Sj32包板,SjGST-Sj32组,SjGST+Sj32组和Sj32组攻击感染前平均抗体滴度有明显升高,差异有显著性(P<0.05);用SjGST包板,SjGST-Sj32组、SjGST+Sj32组及SjGST组攻击感染前也可诱导出较高水平的抗体滴度,差异有显著性(P<0.05)(图1,图2)。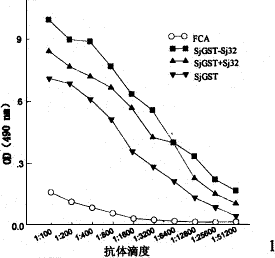
, 百拇医药
图1 SjGST和Sj32免疫小鼠后抗体滴度(SjGST包板)
Fig. 1 Antibody titer in sera of BALB/c mice after the third immunization with Sj32 and/or SjGST (antibody to SjGST)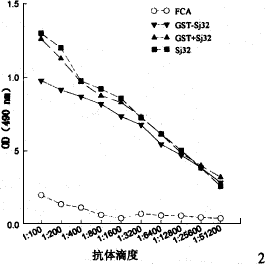
图2 SjGST和Sj32免疫小鼠后抗体滴度(Sj32包板)
Fig. 2 Antibody titer in sera of BALB/c mice after the third immunization with Sj32 and/or SjGST(antibody to Sj32)
2.4 SjGST-Sj32蛋白免疫小鼠的特异性抗体动态 在6个不同时点采血,分别用Sj32和SjGST包板以ELISA法测定免疫血清中特异性抗体的动态。结果显示:在第一组免疫后2w血清中即可检测到特异性抗体;加强免疫后抗体滴度继续升高,至攻击感染前达最高(图3,图4)。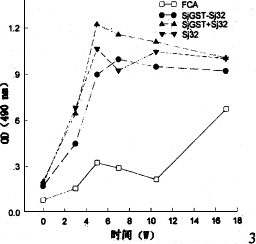
, 百拇医药
图3 SjGST和Sj32免疫小鼠后抗体动态(Sj32包板)
Fig. 3 Dynamics of antibody to Sj32 in mice vaccinated with Sj32 and/or SjGST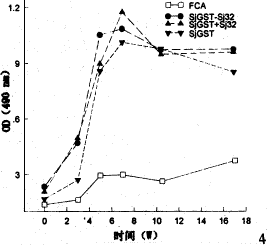
图4 SjGST和Sj32免疫小鼠后抗体动态(SjGST包板)
Fig. 4 Dynamics of antibody to SjGST in mice vaccinated with Sj32 and/or SjGST
3 讨 论
Timms和Bueding(1959)[2]最早报告曼氏血吸虫匀浆上清液具有对珠蛋白或血红蛋白专一性的酸性蛋白酶,称之为“血红蛋白酶”。其后证明,“血红蛋白酶”并非单一的酶类,它由一组酶组成,包括组织蛋白酶、门冬氨酸蛋白酶、门冬酰胺蛋白酶及某些肽类[3]。由于血吸虫血红蛋白酶在该虫的生活史中起着重要作用,一旦该酶的活性被抑制,虫体的生长、发育及生存都受到威胁[4]。沈定文[5]等采用天然的日本血吸虫成虫31000/32000蛋白免疫小鼠诱导28.1%的保护力。我室陈焱[1]等用天然的Sj31/32免疫小鼠后粪卵减少63.8%~78.3%,雌虫子宫内虫卵降低53.2%,肝肠中死卵明显增加[1]。谷胱甘肽-S-转移酶(GST)系一种主要的解毒酶。Balloul[6]等用纯化天然的曼氏血吸虫(Sm)GST免疫小鼠获得40%的保护力。
, 百拇医药
随着分子生物学技术的发展,血吸虫GST及32kD蛋白的氨基酸序列均已阐明。根据生化特性及氨基酸序列的类同性,Sj32/Sm32近来被重新命名为血吸虫Legumain[7]。该酶无直接水解蛋白的活性,但可激活其它蛋白酶而发挥作用[8]。我室利用基因重组技术将此两种保护性抗原融合组成一种混合疫苗,用于免疫小鼠,结果SjGST-Sj32和Sj32均可诱导小鼠产生抗日本血吸虫攻击感染保护性免疫力及抗生殖免疫力,且单独Sj32蛋白与SjGST-Sj32融合蛋白并无区别。据此提示,保护性可能由Sj32而非SjGST引起;且二者混合注射与以融合蛋白注射对保护效果无影响。SjGST仅引起抗生殖免疫。此结果与Boulanger[9]等用曼氏血吸虫(Sm)GST免疫狒狒后引起明显的抗血吸虫生殖作用相一致。尽管SjGST与Sj32均引起抗生殖免疫,但两者间并无协同作用。抗体动态及攻击感染前抗体滴度的检测表明,Sj32和SjGST-Sj32均可诱导宿主产生明显的体液免疫应答。这与Ruppel[10]等发现血吸虫血红蛋白酶在感染了血吸虫的人和动物体内都能引起强烈的抗体应答相一致。至于SjGST-Sj32融合蛋白是否引起细胞免疫应答及其在保护性免疫及抗生殖免疫中的作用,尚待进一步研究。
, 百拇医药
①本课题由WHO/TDR基金(编号980255)及湖南省科委基金(编号98ssy1007)资助 ②导师
作者:蔡春 女 28岁 博士研究生
参考文献
1 陈焱,易新元,曾宪芳,等.日本血吸虫成虫31/32kD抗原诱导小鼠产生抗卵免疫的初步研究.中国血吸虫病防治杂志,1995,7(2):72~79
2 Timms AR, Bueding E. Studies of a proteolytic enzyme from Schistosoma mansoni. Br J Pharmacol, 1959,14:68~73
3 Klinkert M, Kunz W. Digestion of haemoglobin by schistosomes. Parasitol Today, 1996,4:165
, http://www.100md.com
4 Brindley PJ, Kalinna BH, Dalton JP, et al. Proteolytic degradation of host hemoglobin by schistosomes. Mol Biochem Parasitol, 1997,89:1~9
5 沈定文,李雍龙,韩家俊,等.日本血吸虫成虫31/32kDa蛋白的纯化及保护性免疫力的研究.中国寄生虫学与寄生虫病杂志,1993,11(4):241~243
6 Balloul JM, Grzych JM, Pierce RJ, et al. A purified 28000 dalton protein from Schistosoma mansoni adult worms protects rats and mice against experimental schistosomiasis. J Immunol, 1987,138(10):3448~3453
, 百拇医药
7 Dalton JP, Brindly PJ. Schistosome legumain. In: Barrett AJ eds. Handbook of Proteolytic Enzymes. London: Academic Press, 1997:11~12
8 Dalton JP, Brindley PJ. Schistosome asparaginyl endopeptidase Sm32 in haemoglobin digestion. Parasitol Today, 1996,12:125
9 Boulanger D, Reid GD, Sturrock RF, et al. Immunization of mice and baboons with the recombinant Sm28GST affects both worm viability and fecundity after experimental infection with Schistosoma mansoni. Paraslte Immunol, 1991,13(5):473~490
10 Ruppel A, Diesfeld HJ, Rother U. Immunoblot analysis of Schistosoma mansoni antigen with sera of schistosomiasis patients: diagnostic potential of an adult schistosome polypeptide. Clin Exp Immunol, 1985,62:499~506
(本文编辑 薛绍莲)
1999-03-12 收稿, 百拇医药
单位:寄生虫学教研室 长沙 410078
关键词:日本血吸虫;重组蛋白类;疫苗;免疫;小鼠
湖南医科大学学报990304 提要 应用基因工程技术分别表达出SjGST-Sj32,Sj32和SjGST,用于保护性免疫的动物实验及其体液免疫机制的初步探讨。结果:与对照组相比,重组SjGST-Sj32组,Sj32组,Sj32+SjGST组均有明显的减虫效果(P<0.05)。上述三组及SjGST组的肝脏虫卵计数均较对照组为少(P<0.01)。提示重组Sj32kD蛋白可诱导小鼠产生明显的抗日本血吸虫攻击感染的保护性免疫及抗生殖免疫效果,而SjGST仅表现出一定的抗生殖免疫效果。
中国图书分类号 R383.24
Schistosoma japonicum: Protective immunity induced
, http://www.100md.com
in mice immunized with SjGST-Sj32①
Cai Chun Yi Xinyuan② Zeng Xianfang Zhou Jinchun Shu Xinhua
(Department of Parasitology, Hunan Medical University, Changsha 410078)
Schistosoma japonicum glutathione-s-transferase(SjGST), Schistosoma japonicum 32000 protein(Sj32) and SjGST-Sj32 were expressed and purified to study on protective immunity against Schistosoma japonicum. The result showed that compared with the adjuvant control group, the worm burden was decreased significantly in mice immunized with recombinant SjGST-Sj32, Sj32 and Sj32+SjGST (P<0.05). At the same time, the liver egg per gram(EPG) was decreased in mice immunized with SjGST-Sj32, Sj32, Sj32+SjGST and SjGST. It is concluded that Sj32 significantly induces both protective immunity and anti-fecundity immunity, but SjGST only has an anti-fecundity effect.
, 百拇医药
Key words Schistosoma japonicum; recombinant proteins; vaccine; immune; mice
①Supported by WHO/TDR Grant(ID980225) and Hunan Provincial Research Grant(98SSY1007)
②Suppervisor
日本血吸虫(Schistosoma japonicum, Sj)成虫营养主要来源于两方面,一方面通过虫体表膜转运糖类、氨基酸及核酸前体,另一方面通过肠道内的血红蛋白酶消化宿主的血红蛋白获得营养。后者为血吸虫的主要营养来源。我室曾对日本血吸虫成分31000/32000抗原诱导保护性免疫的可能性进行探讨,发现该抗原可诱导小鼠产生较强的抗生殖免疫[1]。为此,作者等采用基因工程技术,制备了重组日本血吸虫成虫32000抗原(Sj32)、日本血吸虫26000谷胱甘肽-S-转移酶(SjGST)及二者的融合蛋白(SjGST-Sj32),通过免疫小鼠,观察其减虫、减卵作用,同时测定了血清抗体滴度及动态,对保护性免疫的机制进行了初步探讨。
, 百拇医药
1 材料与方法
1.1 动物 BALB/c近交系小鼠,8~10周龄,雄性,中国科学院上海实验动物中心提供。
1.2 免疫原的制备 共制备4种免疫原,均为重组蛋白。Sj32:将Sj32基因亚克隆至pET16b载体,使之表达Sj32蛋白。SjGST-Sj32:将Sj32基因亚克隆至pGEX-5X-3载体(含SjGST基因),使之表达SjGST-Sj32融合蛋白;SjGST26由pGEX-5X-3表达。将单独的SjGST和Sj32在试管内相加,即SjGST+Sj32。表达的产物加8M尿素溶解,免疫前依次经过含1M尿素,2mM还原型谷胱甘肽、0.02mM氧化型谷胱甘肽及0.005%吐温-80的Tris-HCl缓冲液(pH 8.0)和0.2M磷酸盐缓冲液(pH 7.2)透析复性后备用。
1.3 免疫方法 按随机区组设计,将小鼠随机分为5组。实验组在0,3,5周每鼠注射50μg重组蛋白加福氏完全佐剂(FCA)。佐剂对照组在同一时间注射FCA。第三次免疫后5周每鼠经皮肤感染50条尾蚴,45d后采用门脉灌注法收集成虫计数。取1g肝脏进行每克肝卵(EPG)计数和每雌肝卵(EPF)计数,观察各组抗感染免疫及抗生殖免疫效果。
, 百拇医药
1.4 血清采集 于第一次免疫前,0周(S1),第二次免疫前,3周(S2),第三次免疫前,5周(S3),第三次免疫后2周,7周(S4),攻击感染前,10周(S5)及解剖冲虫前,16周(S6)采血,每次150μl。收集血清置-20℃保存用于抗体检测。
1.5 体液免疫水平测定 用ELISA法测定:①攻击感染前鼠血清抗体滴度,从1∶100开始倍比稀释至 1∶51200。②血清以1∶800稀释,检测每只鼠6个不同时间点的血清。每份血清的每个滴度测2个平行孔,用Tris-HCl-8M尿素(pH8.0)稀释Sj32和SjGST,使其终浓度分别为7μg.ml-1和10μg.ml-1。每孔100μl包板,同时设参考阳性,参考阴性及空白对照。E960酶标仪测定光密度值(OD)。按照测试样本OD值与参考阴性OD值的比值S/N≥2.1判为阳性。
, 百拇医药
2 结 果
2.1 SjGST-Sj32蛋白免疫小鼠的减虫效果 与佐剂对照组相比,SjGST-Sj32组,Sj32+SjGST组和Sj32组虫数明显减少,统计学上差异有显著性(P<0.05),而SjGST组虫数减少不明显。说明Sj32能引起小鼠产生抗日本血吸虫攻击感染的保护性免疫,而SjGST则不具备此作用。两者无论以融合蛋白形式或混合形式均有减虫作用(表1)。
表1 SjGST-Sj32蛋白免疫小鼠的减虫效果 组别
鼠数
(只)
平均检获成虫数
(
 ±s)
±s), 百拇医药
减虫率
(%)
FCA对照
9
18.7±4.8
-
Sj32+SjGST
10
10.0±4.9
46.4①
Sj32+SjGST
10
, http://www.100md.com 10.9±6.5
41.6①
Sj32
12
11.5±8.2
38.4①
SjGST
11
17.6±8.9
5.5①
①与FCA对照相比:P<0.05
2.2 SjGST-Sj32蛋白免疫小鼠的肝卵计数 与对照组比较,SjGST-Sj32组,Sj32+SjGST组,Sj32组和SjGST组的每克肝卵数均明显减少,统计学上差异有高度显著性(P<0.01);前三组组间差异无显著性(P>0.05)。与对照组比较,SjGST-Sj32组,Sj32+SjGST组,Sj32组和SjGST组每雌肝组织虫卵计数均明显减少,差异有高度显著性(P<0.01),而4组之间差异无显著性(表2)。
, http://www.100md.com
表2 重组SjGST-Sj32蛋白免疫小鼠的肝卵计数 组别
鼠数(只)
EPG
(
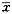 ±s)
±s)EPG减卵率
(%)
EPF
(
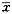 ±s)
±s)EPF减卵率
(%)
, 百拇医药
FCA对照
9
73642.0±17436.4
-
8592.3±2821.7
-
SjGST-Sj32
10
25092.9±12172.6
65.9①
4974.2±822.6
42.1①
, http://www.100md.com
Sj32+SjGST
10
29391.0±18552.4
60.1①
5525.2±2605.0
35.7①
Sj32
12
29818.4±22250.9
59.5①
5015.4±934.1
, 百拇医药
41.6①
SjGST
11
42507.4±20125.1
42.3①
4940.9±436.6
42.5①
①与FCA对照:P<0.01
2.3 SjGST-Sj32蛋白免疫小鼠的特异性抗体滴度 分别用SjGST和Sj32包板,ELISA法检测末次免疫后5w(即攻击感染前)小鼠血清中特异性抗体的滴度。结果显示:与对照组相比,用Sj32包板,SjGST-Sj32组,SjGST+Sj32组和Sj32组攻击感染前平均抗体滴度有明显升高,差异有显著性(P<0.05);用SjGST包板,SjGST-Sj32组、SjGST+Sj32组及SjGST组攻击感染前也可诱导出较高水平的抗体滴度,差异有显著性(P<0.05)(图1,图2)。

, 百拇医药
图1 SjGST和Sj32免疫小鼠后抗体滴度(SjGST包板)
Fig. 1 Antibody titer in sera of BALB/c mice after the third immunization with Sj32 and/or SjGST (antibody to SjGST)

图2 SjGST和Sj32免疫小鼠后抗体滴度(Sj32包板)
Fig. 2 Antibody titer in sera of BALB/c mice after the third immunization with Sj32 and/or SjGST(antibody to Sj32)
2.4 SjGST-Sj32蛋白免疫小鼠的特异性抗体动态 在6个不同时点采血,分别用Sj32和SjGST包板以ELISA法测定免疫血清中特异性抗体的动态。结果显示:在第一组免疫后2w血清中即可检测到特异性抗体;加强免疫后抗体滴度继续升高,至攻击感染前达最高(图3,图4)。

, 百拇医药
图3 SjGST和Sj32免疫小鼠后抗体动态(Sj32包板)
Fig. 3 Dynamics of antibody to Sj32 in mice vaccinated with Sj32 and/or SjGST

图4 SjGST和Sj32免疫小鼠后抗体动态(SjGST包板)
Fig. 4 Dynamics of antibody to SjGST in mice vaccinated with Sj32 and/or SjGST
3 讨 论
Timms和Bueding(1959)[2]最早报告曼氏血吸虫匀浆上清液具有对珠蛋白或血红蛋白专一性的酸性蛋白酶,称之为“血红蛋白酶”。其后证明,“血红蛋白酶”并非单一的酶类,它由一组酶组成,包括组织蛋白酶、门冬氨酸蛋白酶、门冬酰胺蛋白酶及某些肽类[3]。由于血吸虫血红蛋白酶在该虫的生活史中起着重要作用,一旦该酶的活性被抑制,虫体的生长、发育及生存都受到威胁[4]。沈定文[5]等采用天然的日本血吸虫成虫31000/32000蛋白免疫小鼠诱导28.1%的保护力。我室陈焱[1]等用天然的Sj31/32免疫小鼠后粪卵减少63.8%~78.3%,雌虫子宫内虫卵降低53.2%,肝肠中死卵明显增加[1]。谷胱甘肽-S-转移酶(GST)系一种主要的解毒酶。Balloul[6]等用纯化天然的曼氏血吸虫(Sm)GST免疫小鼠获得40%的保护力。
, 百拇医药
随着分子生物学技术的发展,血吸虫GST及32kD蛋白的氨基酸序列均已阐明。根据生化特性及氨基酸序列的类同性,Sj32/Sm32近来被重新命名为血吸虫Legumain[7]。该酶无直接水解蛋白的活性,但可激活其它蛋白酶而发挥作用[8]。我室利用基因重组技术将此两种保护性抗原融合组成一种混合疫苗,用于免疫小鼠,结果SjGST-Sj32和Sj32均可诱导小鼠产生抗日本血吸虫攻击感染保护性免疫力及抗生殖免疫力,且单独Sj32蛋白与SjGST-Sj32融合蛋白并无区别。据此提示,保护性可能由Sj32而非SjGST引起;且二者混合注射与以融合蛋白注射对保护效果无影响。SjGST仅引起抗生殖免疫。此结果与Boulanger[9]等用曼氏血吸虫(Sm)GST免疫狒狒后引起明显的抗血吸虫生殖作用相一致。尽管SjGST与Sj32均引起抗生殖免疫,但两者间并无协同作用。抗体动态及攻击感染前抗体滴度的检测表明,Sj32和SjGST-Sj32均可诱导宿主产生明显的体液免疫应答。这与Ruppel[10]等发现血吸虫血红蛋白酶在感染了血吸虫的人和动物体内都能引起强烈的抗体应答相一致。至于SjGST-Sj32融合蛋白是否引起细胞免疫应答及其在保护性免疫及抗生殖免疫中的作用,尚待进一步研究。
, 百拇医药
①本课题由WHO/TDR基金(编号980255)及湖南省科委基金(编号98ssy1007)资助 ②导师
作者:蔡春 女 28岁 博士研究生
参考文献
1 陈焱,易新元,曾宪芳,等.日本血吸虫成虫31/32kD抗原诱导小鼠产生抗卵免疫的初步研究.中国血吸虫病防治杂志,1995,7(2):72~79
2 Timms AR, Bueding E. Studies of a proteolytic enzyme from Schistosoma mansoni. Br J Pharmacol, 1959,14:68~73
3 Klinkert M, Kunz W. Digestion of haemoglobin by schistosomes. Parasitol Today, 1996,4:165
, http://www.100md.com
4 Brindley PJ, Kalinna BH, Dalton JP, et al. Proteolytic degradation of host hemoglobin by schistosomes. Mol Biochem Parasitol, 1997,89:1~9
5 沈定文,李雍龙,韩家俊,等.日本血吸虫成虫31/32kDa蛋白的纯化及保护性免疫力的研究.中国寄生虫学与寄生虫病杂志,1993,11(4):241~243
6 Balloul JM, Grzych JM, Pierce RJ, et al. A purified 28000 dalton protein from Schistosoma mansoni adult worms protects rats and mice against experimental schistosomiasis. J Immunol, 1987,138(10):3448~3453
, 百拇医药
7 Dalton JP, Brindly PJ. Schistosome legumain. In: Barrett AJ eds. Handbook of Proteolytic Enzymes. London: Academic Press, 1997:11~12
8 Dalton JP, Brindley PJ. Schistosome asparaginyl endopeptidase Sm32 in haemoglobin digestion. Parasitol Today, 1996,12:125
9 Boulanger D, Reid GD, Sturrock RF, et al. Immunization of mice and baboons with the recombinant Sm28GST affects both worm viability and fecundity after experimental infection with Schistosoma mansoni. Paraslte Immunol, 1991,13(5):473~490
10 Ruppel A, Diesfeld HJ, Rother U. Immunoblot analysis of Schistosoma mansoni antigen with sera of schistosomiasis patients: diagnostic potential of an adult schistosome polypeptide. Clin Exp Immunol, 1985,62:499~506
(本文编辑 薛绍莲)
1999-03-12 收稿, 百拇医药