鼠T淋巴细胞亚群对复发性单纯疱疹病毒性基质性角膜炎的免疫介导作用
作者:夏丽坤 舒红 高殿文
单位:夏丽坤(沈阳,中国医科大学附属第二医院眼科 110003);高殿文(沈阳,中国医科大学附属第二医院眼科 110003);舒红(病理科)
关键词:眼感染;病毒性;T淋巴细胞
中华眼科杂志000108 【摘要】 目的 研究T淋巴细胞亚群在复发性单纯疱疹病毒性基质性角膜炎(stromal keratitis,SK)中的作用。方法 采用复发性单纯疱疹病毒性SK的NIH鼠模型,应用单克隆抗体GK 1.5、H-35选择性地排除鼠体内的CD+ 4 、CD+ 8 T淋巴细胞后,观察鼠的SK的复发率、临床特征、角膜病理切片及鼠的迟发型超敏反应(delayed-hypersensitivity,DTH)的能力。结果 90%以上的CD+ 4 T淋巴细胞及95%以上的CD+ 8 T淋巴细胞被排除。CD+ 4 T淋巴细胞的排除降低了SK的复发率,减轻了SK的疾病程度,损伤了鼠的DTH反应能力。而CD+ 8 T淋巴细胞的排除对此却无明显影响。SK的角膜病理显示:排除了CD+ 8 T淋巴细胞的鼠的角膜基质层内可见大量的淋巴细胞和中性粒细胞浸润(类似于对照组角膜病理改变),而排除了CD+ 4 T淋巴细胞的鼠的角膜基质层内偶见淋巴细胞浸润。结论 CD+ 4 T淋巴细胞是介导复发性单纯疱疹病毒性SK免疫病理反应的主要因子。
, 百拇医药
An experimental study of immune mediating action of T-lymphocyte subsets on recurrent herpetic stromal keratitis
XIA Likun, SHU Hong, GAO Dianwen.
(Department of Ophthalmology, The Second Affiliated Hospital, China Medical University, Shenyang 110003,China )
【Abstract】 Objective To investigate the role of T-lymphocyte subsets in the recurrent herpetic stromal keratitis (SK). Methods In a recurrent SK NIH mouse model, rat monoclonal antibodies were used to selectively deplete in vivo the CD+4 and CD+8 T-lymphocytes in mice, and the effects of the subsets on recurrent herpetic SK were evaluated. Results As measured by flow cytometry, in the mice treated with GK1.5, >90% of CD+4 T cells were depleted; and in the mice treated with H-35, >95% of CD+8 T cells were depleted. Depletion of CD+4 T cells could halt the recurrence of SK, reduce the severity of recurrent SK and impair the delayed type hypersensitivity. In contrast, depletion of CD+8 T cells had no effect on the outcome of the disease. Histopathologic examination of the recurrent SK demonstrated that the stromal inflammation in CD+8 T-cell depleted and control mice was characterized by extensive lymphocyte and polymorphonuclear leukocyte infiltration, but only occasional lymphocytes were observed in CD+4 T-cell depleted mice. Conclusion The results provide evidence that recurrent herpetic SK represents an immunopathologic process mediated by CD+4 T cells.
, 百拇医药
【Key words】 Eye infections, viral; T-lymphocytes
单纯疱疹病毒1型(herpes simplex virus type 1,HSV-1)引起的基质性角膜炎(stromal keratitis,SK)是人类主要的致盲性眼病之一,其主要原因在于HSV-1的潜伏感染和反复激活,引起SK的反复发作、角膜基质混浊的反复加重,最终造成角膜白斑而致盲。SK的发病机制尚不清楚。以往的研究表明,复发性单纯疱疹病毒性SK是一种由HSV-1抗原引起的由T淋巴细胞介导的免疫病理性疾病[1-3]。但是,这些研究均采用的是原发性病毒性角膜炎的动物模型,这种动物模型缺少人类复发性SK的许多特征[4]。 因此,我们改进了由Shimeld等[5,6]建立的鼠的复发性SK的模型,并应用单克隆抗体选择性地排除了鼠的CD+ 4、CD+ 8T淋巴细胞,以期观察CD+ 4、CD+8T 淋巴细胞的排除对SK的复发率及疾病程度的影响,同时对其发病机制进行探讨。
, 百拇医药
材料与方法
一、动物模型的制备
1.病毒和细胞:病毒为隔离的人的高神经毒力的HSV-1 Mckrae毒株(美国华盛顿大学眼科中心提供),使用前滴度为2.2×109空斑单位(plague forming unit,PFU)/ml。生产和检测病毒的细胞为非洲绿猴肾细胞。培养非洲绿猴肾细胞的营养液为含5%胎牛血清、青霉素(1×105 U/L)及链霉素(0.1 g/L)改进的最小基础培养基(dulbecco′s modified eagle medium,DMEM,美国Gibco Grand Island公司提供)。
2.鼠和角膜感染的程序:(1) 动物:选用4~6周,体重为18~22g的雌性NIH鼠(英国Harlan Olac Ltd公司提供)130只作为实验对象。其中100只鼠的角膜接种HSV-1,另30只为空白对照。(2)方法:实验鼠麻醉后置于显微镜下,用25号刀片交叉划伤鼠右眼角膜上皮层呈“≡”字形;将5 μl含有1×106 PFU病毒的DMEM滴于右眼角膜表面,同时向鼠的腹腔内注射人的抗病毒血清1 ml(美国Chemicon公司提供,该血清中和HSV-1的半数有效剂量为1/640),使病毒潜伏于三叉神经节或角膜内而角膜恢复透明,限制病毒感染外周组织使鼠100%存活;3 d后,用蘸有DMEM的湿棉签擦拭右眼角膜,然后将棉签置入装有1 ml DMEM的试管中,用非洲绿猴肾细胞的细胞培养检测擦拭液中有无病毒存在;并于接种后第3天及1周时,在裂隙灯显微镜下检查角膜情况。除外无树枝状、地图状角膜炎或棉签擦拭液中未检测出病毒的鼠,余鼠继续养育6周,使急性上皮性角膜炎愈合并使病毒在三叉神经节或角膜内建立潜伏感染。7周后于裂隙灯下检查角膜情况,除外角膜有病变的鼠(角膜有病变难以判断病毒处于何期并且角膜病变影响下一步实验的观察)。100只鼠中,90只鼠的角膜光滑透明,被确定为继续实验的对象。
, 百拇医药
3.单克隆抗体的制备和鼠的注射:(1) 单克隆抗体的制备:杂交瘤细胞GK1.5和H-35在含有5 %胎牛血清的DMEM中分别分泌鼠的特异性抗T淋巴细胞亚群的单克隆抗体GK1.5(抗CD+4)和H-35(抗CD+8);用硫酸胺沉淀法将抗体从杂交瘤细胞培养液中提纯;分光光度计法检测GK1.5和H-35单克隆抗体,GK1.5及H-35的浓度分别为24.5 g/L和19.8 g/L。(2)动物的分组:随机将90只处于病毒潜伏期的鼠分为3组,每组30只。第1、2组为实验组,分别注射单克隆抗体GK1.5和H-35,因此称为抗-CD4组和抗-CD8组;第3组为对照组,注射鼠的非特异性免疫球蛋白(RatIgG,购自美国Jackson Immunoresearch公司),称为抗体的对照组。注射时间及剂量:3组均于紫外线照射角膜的前1日、当天及照射后的第2、4、7、14、21及28天,于鼠的腹腔内注射相应的抗体或免疫球蛋白各0.5 mg。另外,30只未感染过HSV-1的NIH鼠作为紫外线B光照射角膜的对照组,称为空白对照组。
, 百拇医药
4.紫外线B光照射鼠角膜病毒的激活及SK的复发:紫外线 B光光源为TW20 Chromato-Vu transilluminator(美国UVP公司产品)。其光波波长为302 nm。每只鼠的右眼接受170 mJ/cm2光的照射。于紫外线B光照射角膜的当天及照射后的第7天内,每天用蘸有DMEM的棉签擦拭右角膜1次,并将擦拭液用非洲绿猴肾细胞的细胞培养。检测鼠角膜擦拭液中单纯疱疹病毒,并判定其病毒是否被激活及SK复发。
二、流式细胞仪和T淋巴细胞亚群的排除量
于紫外线B光照射角膜后的第7天,即腹腔内第5次注射抗体时,取鼠的左眼眼眶血0.2 ml做荧光抗体染色、流式细胞仪分析,判断单克隆抗体排除T淋巴细胞亚群的有效性。选择美国PharMingen公司生产的藻红蛋白联结的大鼠抗小鼠CD+ 4、CD+ 8 T淋巴细胞抗体[R-phycoerythrin-conjugated rat anti-mouse CD4(L3T4)和R-phycoerythrin-conjugated rat anti-mouse CD8(ly-2)]作为标准荧光抗体。采用美国FACS 440型流式细胞仪检测正常鼠及注射单克隆抗体的实验鼠的外周血中CD+4或CD+8T淋巴细胞占细胞总数的百分比。流式细胞仪显示的荧光素-2直方图中,以荧光强度为横坐标,以细胞数为纵坐标,曲线下面的面积即为收集的细胞数量,同时,流式细胞仪以数据显示荧光标记细胞(CD+4或CD+8 T 淋巴细胞)占收集细胞总数的百分比。
, 百拇医药
三、临床观察
分别于紫外线B光照射角膜后的1、2、3、4及5周时,用裂隙灯显微镜检查角膜改变。(1)角膜基质混浊的判分标准:0分,角膜基质清晰透明;1分,角膜基质稍混浊;2分,角膜基质中度混浊,可透见后部虹膜特征;3分,角膜基质重度混浊,但仍可判断瞳孔缘的位置;4分,角膜基质完全混浊,失去了后部特征。(2)角膜新生血管的判分标准:0分,无新生血管长入角膜;1分,新生血管向心性生长,但未达到瞳孔中央或未超过角膜半径;2分,新生血管达到瞳孔中央或超过角膜半径。
四、迟发型超敏反应(DTH)
于紫外线B光照射后第14天行DTH反应检测。方法:将鼠麻醉后,先用游标卡尺测量鼠的左、右脚掌后部的厚度,然后将右脚掌后部真皮内注射3 μl含有1×106 PFU HSV-1 Mckrae strain(已被紫外线B光灭活)的DMEM;左脚掌同一部位注射相同剂量的不含有病毒的DMEM。24 h后再次测量左、右脚掌厚度。DTH的值为注射24 h后的右、左脚掌测量值的差值减去注射前的右、左脚掌测量值的差值。
, 百拇医药
五、组织学观察
于紫外线B光照射角膜后第38天,取鼠的右眼球,用10%甲醛液固定,石蜡包埋,常规HE染色。
六、统计学处理
本文数据采用χ2、t及t′检验。其中,SK复发率的比较采用χ2检验;复发性SK的平均角膜混浊程度及平均角膜新生血管化程度的比较采用t检验;DTH值的比较采用t′检验。
结果
一、CD+ 4及CD+ 8T淋巴细胞的排除结果
单克隆抗体GK1.5、H-35排除T淋巴细胞亚群有效性的判断:于紫外线B光照射角膜后的第7天,实验组及空白对照组鼠中,正常鼠的外周血中CD+ 4 T淋巴细胞占细胞总数的29.9%,注射单克隆抗体GK1.5鼠的外周血中CD+4 T淋巴细胞占细胞总数的1.9%,因此可知93.6%的CD+ 4 T淋巴细胞被单克隆抗体GK1.5排除。正常鼠的外周血中CD+ 8 T淋巴细胞占细胞总数的7.0%;注射单克隆抗体H-35鼠的外周血中CD+ 8 T淋巴细胞占细胞总数的0.1%,因此可知98.5%的CD+8 T淋巴细胞被单克隆抗体H-35排除。
, 百拇医药
二、CD+ 4及CD+ 8T淋巴细胞的排除对SK复发率的影响
实验组与对照组在接受相同剂量的紫外线B光照射后,空白对照组的SK复发率为0;抗体的对照组的SK的复发率为76.7%;抗-CD4组的SK的复发率为16.7%;抗-CD8组SK的复发率为70.0%。结果表明:CD+ 4 T淋巴细胞的排除显著地降低了SK复发率,抗-CD4组与抗体的对照组比较,差异有非常显著性(χ2=21.75,P<0.001);而CD8 T淋巴细胞的排除对SK的复发率则无明显影响,抗-CD8组与抗体的对照组比较,差异无显著性(χ2=0.34,P>0.05)。
三、CD+4及CD+8 T淋巴细胞的排除对复发性SK程度的影响
, 百拇医药
1. 紫外线B光照射角膜后的不同时间的平均角膜混浊程度:见图1。
图1 紫外线B光照射角膜后的不同时间的平均角膜混浊程度
2.紫外线B光照射角膜后的不同时间的平均角膜新生血管化的程度:见图2。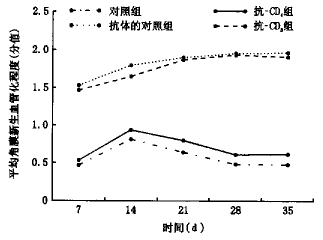
图2 紫外线B光照射角膜后的不同时间的平均角膜新生血管化程度
从图1、2中可见:CD+4 T淋巴细胞的排除明显地减轻了复发性SK的角膜混浊程度及角膜新生血管化程度,在各个时间点上,抗-CD4组与抗体的对照组比较P值均<0.01,与空白对照组比较P值均>0.05;CD8 T淋巴细胞的排除对复发性SK的角膜混浊程度和角膜新生血管化程度无影响,在各个时间点上,抗-CD8组与抗体的对照组比较P值均>0.05,与空白对照组比较P值均<0.01。
, http://www.100md.com
四、CD+4和CD+8 T淋巴细胞的排除对DTH反应的影响
于紫外线B光照射后第14天实验组及对照组鼠DTH反应的检测,空白对照组的DTH值为(0.009 8±0.006 2)mm;抗体的对照组的DTH值为(0.650 2±0.025 0)mm;抗-CD4组的DTH值为(0.103 4±0.009 4)mm,抗-CD8组的DTH值为(0.597 5±0.014 9)mm。结果表明:CD4 T淋巴细胞的排除显著地损伤了鼠对HSV-1抗原所产生的DTH反应的能力,即抗-CD4组与抗体的对照组比较,差异有显著性(t′=20.41,P<0.01);CD+ 8T淋巴细胞的排除对鼠的DTH反应能力无明显损伤,即抗-CD8组与抗体的对照组比较,差异无显著性(t′=1.81,P>0.05)。
, 百拇医药
五、CD+ 4及CD+ 8 T 淋巴细胞的排除对SK的角膜病理改变的影响
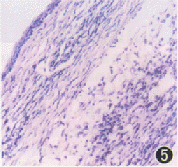
取实验终止时,各实验组及对照组鼠右眼球行病理检查结果显示:空白对照组鼠的角膜基本正常(图3);抗-CD4组鼠角膜上皮层完整,基质层轻度水肿、增厚,约为正常角膜的1.5倍,胶原纤维走行规则,偶见淋巴细胞及小血管(图4);抗体的对照组鼠角膜上皮层完整,基质层高度水肿、增厚,约为正常角膜的3倍,胶原纤维排列紊乱,纤维细胞和小血管增生明显,可见大量的淋巴细胞和一些中性粒细胞浸润,此种炎性反应以深基质层处最明显(图5);抗-CD8组鼠类似于抗体的对照组的角膜改变(图6)。


, 百拇医药
图3 空白对照组鼠角膜正常HE×200
图4 抗-CD4组鼠角膜上皮完整,基质水肿增厚,胶纤维走行规则,偶见淋巴细胞及小血管HE×200
图5 抗体的对照组鼠角膜上皮完整,基质高度水肿、增厚,胶原纤维排列紊乱,血管增生明显,可见大量淋巴细胞及中性粒细胞浸润HE×200
图6 抗-CD8组鼠的角膜类似图5的改变HE×200
讨论
一、复发性SK NIH鼠的实验模型的制备
在制备复发性SK的实验动物模型前,首先需要建立起HSV-1潜伏感染的模型,然后用特定的条件或因素来诱导复发。我们选用NIH鼠,经角膜接种HSV-1造成原发性角膜感染。急性感染发生于病毒接种的1周内,然后将鼠继续养育,使病毒进入潜伏感染期。目前公认的潜伏感染期约发生在病毒接种后第12~14天[7,8],而梁凤歧等[9]报道最晚可发生于角膜原发感染完全消失后的第45天。因此,我们将急性感染期的鼠继续养育6周,使病毒有充分的时间建立潜伏感染。病毒接种后第7周,用紫外线B光照射处于病毒潜伏期且角膜恢复光滑透明鼠的角膜诱导其SK的复发。本研究结果显示,紫外线B光诱导SK复发的成功率为76.7%,这与Laycock等[10]报道SK复发率为60%~80%相同。我们制备的复发性SK的NIH鼠的模型具有人类此种疾病的临床特征:灶状角膜基质混浊、局部角膜新生血管化、盘状角膜内皮炎及短暂的树枝状角膜上皮炎[11]。
, 百拇医药
二、CD+4 T淋巴细胞是介导复发性SK免疫病理反应的主要因子
本研究结果显示,在鼠的复发性SK的模型中,于鼠的腹腔内注射单克隆抗体GK1.5可排除鼠体内90%以上的CD+ 4 T淋巴细胞 ,CD+ 4 T淋巴细胞的排除大大降低了SK的复发率,显著地减轻了SK的疾病程度,严重地损伤了鼠对HSV-1抗原产生的DTH反应的能力。因此,我们认为CD+ 4 T淋巴细胞是介导复发性SK免疫病理反应的主要因子。
三、CD+4 T淋巴细胞介导复发性SK免疫病理反应的机制
我们认为,单纯疱疹病毒性基质性角膜炎是一种迟发型超敏反应。CD+4 T淋巴细胞作为抗原特异性细胞与HSV-1抗原结合致敏,释放一些淋巴因子,这些淋巴因子反过来趋化、激活非抗原特异性的细胞,引起局部组织损伤。此观点通过本实验的角膜病理检查结果间接得到证实:接受非特异性免疫球蛋白注射的鼠(抗体的对照组)的角膜基质层内可见大量的淋巴细胞和一些中性粒细胞浸润,伴随着组织的损伤——基质层高度水肿、增厚,胶原纤维排列紊乱、纤维细胞和小血管增生;而排除了CD+4 T淋巴细胞的鼠角膜基质层内仅见个别的淋巴细胞浸润及轻微的角膜水肿。同时,值得强调的是,这些角膜病理改变很轻微的鼠,对HSV-1抗原所产生的DTH反应也非常微弱。因此,我们认为CD+4 T淋巴细胞是通过DTH反应来介导复发性SK的免疫病理反应的。
, http://www.100md.com
四、CD+8 T淋巴细胞不是介导复发性SK免疫病理反应的主要因子
关于CD+8 T淋巴细胞在SK中的作用,Hendricks等[3]认为CD+8 T淋巴细胞是通过细胞毒性作用而介导SK的免疫病理反应,与本研究结果不同。本研究结果显示,在鼠的复发性SK的实验模型中,于鼠的腹腔内注射单克隆抗体H-35将鼠体内95%以上CD+8 T淋巴细胞排除后,未影响SK的复发率,亦未影响SK的疾病程度,更未影响鼠的DTH反应能力。所以,CD+8 T淋巴细胞不是介导复发性SK免疫反应的主要因子。
志谢 美国华盛顿大学的Jay S.Pepose及P.Michael Stuart 博士对本研究的帮助和支持
, 百拇医药
参考文献
1 Metcalf JF, Hamilton DS, Reichert RW. Herpetic keratitis in athmic (nude) mice. Infect Immun, 1979,26:1164-1171.
2 Russell RG, Nasisse MP, Larsen HS,et al. Role of T-lymphocytes in the pathogenesis of herpetic stromal keratitis. Invest Ophthalmol Vis Sci, 1984,25:938-944.
3 Hendricks RL,Tao MS,Glorioso JC.Alterations in the antigenic structure of two major HSV-1 glycoproteins, gC and gB,influence immune regulation and susceptibility to murine herpes keratitis. J Immunol, 1989,142:263-269.
, 百拇医药
4 Rinne JR, Abghari SZ, Stulting RD. The severity of herpes simplex viral keratitis in mice does not reflect the severity of disease in humans. Invest Ophthalmol Vis Sci, 1992,33:268-272.
5 Shimeld C, Hill T, Blyth B,et al. An improved model of recurrent herpetic eye disease in mice.Curr Eye Res, 1989,8:1193-1205.
6 Shimeld C, Hill TJ, Blyth WA,et al. Reactivation of latent infection and induction of recurrent herpetic eye disease in mice. J Gen Virol, 1990,71:397-404.
, http://www.100md.com
7 Lycke E, Kristensson K, Svennerholm B, et al. Uptake and transport of herpes simplex virus in neurites of rat dorsal root ganglia cells in culture. J Gen Virol, 1984,65: 55-64.
8 Cook ML, Bastone VB, Stevens JG. Evidence that neurons harbor latent herpes simplex virus. Infect Immun, 1974,9:946-951.
9 梁凤歧,董晓光,谢立信. 单纯疱疹病毒I型潜伏感染的研究. 眼科研究,1991,9:134-137.
10 Laycock KA, Lee SF, Brady RH, et al. Characterization of a murine model of recurrent herpes simplex viral keratitis induced by ultraviolet B radiation. Invest Ophthalmol Vis Sci, 1991,32:2741-2746.
11 Miller JK, Laycock KA,Umphress JA,et al. A comparison of recurrent and primary herpes simplex keratitis in NIH inbred mice. Cornea, 1996, 15:497-504.
(收稿日期:1999-08-02), 百拇医药
单位:夏丽坤(沈阳,中国医科大学附属第二医院眼科 110003);高殿文(沈阳,中国医科大学附属第二医院眼科 110003);舒红(病理科)
关键词:眼感染;病毒性;T淋巴细胞
中华眼科杂志000108 【摘要】 目的 研究T淋巴细胞亚群在复发性单纯疱疹病毒性基质性角膜炎(stromal keratitis,SK)中的作用。方法 采用复发性单纯疱疹病毒性SK的NIH鼠模型,应用单克隆抗体GK 1.5、H-35选择性地排除鼠体内的CD+ 4 、CD+ 8 T淋巴细胞后,观察鼠的SK的复发率、临床特征、角膜病理切片及鼠的迟发型超敏反应(delayed-hypersensitivity,DTH)的能力。结果 90%以上的CD+ 4 T淋巴细胞及95%以上的CD+ 8 T淋巴细胞被排除。CD+ 4 T淋巴细胞的排除降低了SK的复发率,减轻了SK的疾病程度,损伤了鼠的DTH反应能力。而CD+ 8 T淋巴细胞的排除对此却无明显影响。SK的角膜病理显示:排除了CD+ 8 T淋巴细胞的鼠的角膜基质层内可见大量的淋巴细胞和中性粒细胞浸润(类似于对照组角膜病理改变),而排除了CD+ 4 T淋巴细胞的鼠的角膜基质层内偶见淋巴细胞浸润。结论 CD+ 4 T淋巴细胞是介导复发性单纯疱疹病毒性SK免疫病理反应的主要因子。
, 百拇医药
An experimental study of immune mediating action of T-lymphocyte subsets on recurrent herpetic stromal keratitis
XIA Likun, SHU Hong, GAO Dianwen.
(Department of Ophthalmology, The Second Affiliated Hospital, China Medical University, Shenyang 110003,China )
【Abstract】 Objective To investigate the role of T-lymphocyte subsets in the recurrent herpetic stromal keratitis (SK). Methods In a recurrent SK NIH mouse model, rat monoclonal antibodies were used to selectively deplete in vivo the CD+4 and CD+8 T-lymphocytes in mice, and the effects of the subsets on recurrent herpetic SK were evaluated. Results As measured by flow cytometry, in the mice treated with GK1.5, >90% of CD+4 T cells were depleted; and in the mice treated with H-35, >95% of CD+8 T cells were depleted. Depletion of CD+4 T cells could halt the recurrence of SK, reduce the severity of recurrent SK and impair the delayed type hypersensitivity. In contrast, depletion of CD+8 T cells had no effect on the outcome of the disease. Histopathologic examination of the recurrent SK demonstrated that the stromal inflammation in CD+8 T-cell depleted and control mice was characterized by extensive lymphocyte and polymorphonuclear leukocyte infiltration, but only occasional lymphocytes were observed in CD+4 T-cell depleted mice. Conclusion The results provide evidence that recurrent herpetic SK represents an immunopathologic process mediated by CD+4 T cells.
, 百拇医药
【Key words】 Eye infections, viral; T-lymphocytes
单纯疱疹病毒1型(herpes simplex virus type 1,HSV-1)引起的基质性角膜炎(stromal keratitis,SK)是人类主要的致盲性眼病之一,其主要原因在于HSV-1的潜伏感染和反复激活,引起SK的反复发作、角膜基质混浊的反复加重,最终造成角膜白斑而致盲。SK的发病机制尚不清楚。以往的研究表明,复发性单纯疱疹病毒性SK是一种由HSV-1抗原引起的由T淋巴细胞介导的免疫病理性疾病[1-3]。但是,这些研究均采用的是原发性病毒性角膜炎的动物模型,这种动物模型缺少人类复发性SK的许多特征[4]。 因此,我们改进了由Shimeld等[5,6]建立的鼠的复发性SK的模型,并应用单克隆抗体选择性地排除了鼠的CD+ 4、CD+ 8T淋巴细胞,以期观察CD+ 4、CD+8T 淋巴细胞的排除对SK的复发率及疾病程度的影响,同时对其发病机制进行探讨。
, 百拇医药
材料与方法
一、动物模型的制备
1.病毒和细胞:病毒为隔离的人的高神经毒力的HSV-1 Mckrae毒株(美国华盛顿大学眼科中心提供),使用前滴度为2.2×109空斑单位(plague forming unit,PFU)/ml。生产和检测病毒的细胞为非洲绿猴肾细胞。培养非洲绿猴肾细胞的营养液为含5%胎牛血清、青霉素(1×105 U/L)及链霉素(0.1 g/L)改进的最小基础培养基(dulbecco′s modified eagle medium,DMEM,美国Gibco Grand Island公司提供)。
2.鼠和角膜感染的程序:(1) 动物:选用4~6周,体重为18~22g的雌性NIH鼠(英国Harlan Olac Ltd公司提供)130只作为实验对象。其中100只鼠的角膜接种HSV-1,另30只为空白对照。(2)方法:实验鼠麻醉后置于显微镜下,用25号刀片交叉划伤鼠右眼角膜上皮层呈“≡”字形;将5 μl含有1×106 PFU病毒的DMEM滴于右眼角膜表面,同时向鼠的腹腔内注射人的抗病毒血清1 ml(美国Chemicon公司提供,该血清中和HSV-1的半数有效剂量为1/640),使病毒潜伏于三叉神经节或角膜内而角膜恢复透明,限制病毒感染外周组织使鼠100%存活;3 d后,用蘸有DMEM的湿棉签擦拭右眼角膜,然后将棉签置入装有1 ml DMEM的试管中,用非洲绿猴肾细胞的细胞培养检测擦拭液中有无病毒存在;并于接种后第3天及1周时,在裂隙灯显微镜下检查角膜情况。除外无树枝状、地图状角膜炎或棉签擦拭液中未检测出病毒的鼠,余鼠继续养育6周,使急性上皮性角膜炎愈合并使病毒在三叉神经节或角膜内建立潜伏感染。7周后于裂隙灯下检查角膜情况,除外角膜有病变的鼠(角膜有病变难以判断病毒处于何期并且角膜病变影响下一步实验的观察)。100只鼠中,90只鼠的角膜光滑透明,被确定为继续实验的对象。
, 百拇医药
3.单克隆抗体的制备和鼠的注射:(1) 单克隆抗体的制备:杂交瘤细胞GK1.5和H-35在含有5 %胎牛血清的DMEM中分别分泌鼠的特异性抗T淋巴细胞亚群的单克隆抗体GK1.5(抗CD+4)和H-35(抗CD+8);用硫酸胺沉淀法将抗体从杂交瘤细胞培养液中提纯;分光光度计法检测GK1.5和H-35单克隆抗体,GK1.5及H-35的浓度分别为24.5 g/L和19.8 g/L。(2)动物的分组:随机将90只处于病毒潜伏期的鼠分为3组,每组30只。第1、2组为实验组,分别注射单克隆抗体GK1.5和H-35,因此称为抗-CD4组和抗-CD8组;第3组为对照组,注射鼠的非特异性免疫球蛋白(RatIgG,购自美国Jackson Immunoresearch公司),称为抗体的对照组。注射时间及剂量:3组均于紫外线照射角膜的前1日、当天及照射后的第2、4、7、14、21及28天,于鼠的腹腔内注射相应的抗体或免疫球蛋白各0.5 mg。另外,30只未感染过HSV-1的NIH鼠作为紫外线B光照射角膜的对照组,称为空白对照组。
, 百拇医药
4.紫外线B光照射鼠角膜病毒的激活及SK的复发:紫外线 B光光源为TW20 Chromato-Vu transilluminator(美国UVP公司产品)。其光波波长为302 nm。每只鼠的右眼接受170 mJ/cm2光的照射。于紫外线B光照射角膜的当天及照射后的第7天内,每天用蘸有DMEM的棉签擦拭右角膜1次,并将擦拭液用非洲绿猴肾细胞的细胞培养。检测鼠角膜擦拭液中单纯疱疹病毒,并判定其病毒是否被激活及SK复发。
二、流式细胞仪和T淋巴细胞亚群的排除量
于紫外线B光照射角膜后的第7天,即腹腔内第5次注射抗体时,取鼠的左眼眼眶血0.2 ml做荧光抗体染色、流式细胞仪分析,判断单克隆抗体排除T淋巴细胞亚群的有效性。选择美国PharMingen公司生产的藻红蛋白联结的大鼠抗小鼠CD+ 4、CD+ 8 T淋巴细胞抗体[R-phycoerythrin-conjugated rat anti-mouse CD4(L3T4)和R-phycoerythrin-conjugated rat anti-mouse CD8(ly-2)]作为标准荧光抗体。采用美国FACS 440型流式细胞仪检测正常鼠及注射单克隆抗体的实验鼠的外周血中CD+4或CD+8T淋巴细胞占细胞总数的百分比。流式细胞仪显示的荧光素-2直方图中,以荧光强度为横坐标,以细胞数为纵坐标,曲线下面的面积即为收集的细胞数量,同时,流式细胞仪以数据显示荧光标记细胞(CD+4或CD+8 T 淋巴细胞)占收集细胞总数的百分比。
, 百拇医药
三、临床观察
分别于紫外线B光照射角膜后的1、2、3、4及5周时,用裂隙灯显微镜检查角膜改变。(1)角膜基质混浊的判分标准:0分,角膜基质清晰透明;1分,角膜基质稍混浊;2分,角膜基质中度混浊,可透见后部虹膜特征;3分,角膜基质重度混浊,但仍可判断瞳孔缘的位置;4分,角膜基质完全混浊,失去了后部特征。(2)角膜新生血管的判分标准:0分,无新生血管长入角膜;1分,新生血管向心性生长,但未达到瞳孔中央或未超过角膜半径;2分,新生血管达到瞳孔中央或超过角膜半径。
四、迟发型超敏反应(DTH)
于紫外线B光照射后第14天行DTH反应检测。方法:将鼠麻醉后,先用游标卡尺测量鼠的左、右脚掌后部的厚度,然后将右脚掌后部真皮内注射3 μl含有1×106 PFU HSV-1 Mckrae strain(已被紫外线B光灭活)的DMEM;左脚掌同一部位注射相同剂量的不含有病毒的DMEM。24 h后再次测量左、右脚掌厚度。DTH的值为注射24 h后的右、左脚掌测量值的差值减去注射前的右、左脚掌测量值的差值。
, 百拇医药
五、组织学观察
于紫外线B光照射角膜后第38天,取鼠的右眼球,用10%甲醛液固定,石蜡包埋,常规HE染色。
六、统计学处理
本文数据采用χ2、t及t′检验。其中,SK复发率的比较采用χ2检验;复发性SK的平均角膜混浊程度及平均角膜新生血管化程度的比较采用t检验;DTH值的比较采用t′检验。
结果
一、CD+ 4及CD+ 8T淋巴细胞的排除结果
单克隆抗体GK1.5、H-35排除T淋巴细胞亚群有效性的判断:于紫外线B光照射角膜后的第7天,实验组及空白对照组鼠中,正常鼠的外周血中CD+ 4 T淋巴细胞占细胞总数的29.9%,注射单克隆抗体GK1.5鼠的外周血中CD+4 T淋巴细胞占细胞总数的1.9%,因此可知93.6%的CD+ 4 T淋巴细胞被单克隆抗体GK1.5排除。正常鼠的外周血中CD+ 8 T淋巴细胞占细胞总数的7.0%;注射单克隆抗体H-35鼠的外周血中CD+ 8 T淋巴细胞占细胞总数的0.1%,因此可知98.5%的CD+8 T淋巴细胞被单克隆抗体H-35排除。
, 百拇医药
二、CD+ 4及CD+ 8T淋巴细胞的排除对SK复发率的影响
实验组与对照组在接受相同剂量的紫外线B光照射后,空白对照组的SK复发率为0;抗体的对照组的SK的复发率为76.7%;抗-CD4组的SK的复发率为16.7%;抗-CD8组SK的复发率为70.0%。结果表明:CD+ 4 T淋巴细胞的排除显著地降低了SK复发率,抗-CD4组与抗体的对照组比较,差异有非常显著性(χ2=21.75,P<0.001);而CD8 T淋巴细胞的排除对SK的复发率则无明显影响,抗-CD8组与抗体的对照组比较,差异无显著性(χ2=0.34,P>0.05)。
三、CD+4及CD+8 T淋巴细胞的排除对复发性SK程度的影响
, 百拇医药
1. 紫外线B光照射角膜后的不同时间的平均角膜混浊程度:见图1。

图1 紫外线B光照射角膜后的不同时间的平均角膜混浊程度
2.紫外线B光照射角膜后的不同时间的平均角膜新生血管化的程度:见图2。

图2 紫外线B光照射角膜后的不同时间的平均角膜新生血管化程度
从图1、2中可见:CD+4 T淋巴细胞的排除明显地减轻了复发性SK的角膜混浊程度及角膜新生血管化程度,在各个时间点上,抗-CD4组与抗体的对照组比较P值均<0.01,与空白对照组比较P值均>0.05;CD8 T淋巴细胞的排除对复发性SK的角膜混浊程度和角膜新生血管化程度无影响,在各个时间点上,抗-CD8组与抗体的对照组比较P值均>0.05,与空白对照组比较P值均<0.01。
, http://www.100md.com
四、CD+4和CD+8 T淋巴细胞的排除对DTH反应的影响
于紫外线B光照射后第14天实验组及对照组鼠DTH反应的检测,空白对照组的DTH值为(0.009 8±0.006 2)mm;抗体的对照组的DTH值为(0.650 2±0.025 0)mm;抗-CD4组的DTH值为(0.103 4±0.009 4)mm,抗-CD8组的DTH值为(0.597 5±0.014 9)mm。结果表明:CD4 T淋巴细胞的排除显著地损伤了鼠对HSV-1抗原所产生的DTH反应的能力,即抗-CD4组与抗体的对照组比较,差异有显著性(t′=20.41,P<0.01);CD+ 8T淋巴细胞的排除对鼠的DTH反应能力无明显损伤,即抗-CD8组与抗体的对照组比较,差异无显著性(t′=1.81,P>0.05)。
, 百拇医药
五、CD+ 4及CD+ 8 T 淋巴细胞的排除对SK的角膜病理改变的影响
取实验终止时,各实验组及对照组鼠右眼球行病理检查结果显示:空白对照组鼠的角膜基本正常(图3);抗-CD4组鼠角膜上皮层完整,基质层轻度水肿、增厚,约为正常角膜的1.5倍,胶原纤维走行规则,偶见淋巴细胞及小血管(图4);抗体的对照组鼠角膜上皮层完整,基质层高度水肿、增厚,约为正常角膜的3倍,胶原纤维排列紊乱,纤维细胞和小血管增生明显,可见大量的淋巴细胞和一些中性粒细胞浸润,此种炎性反应以深基质层处最明显(图5);抗-CD8组鼠类似于抗体的对照组的角膜改变(图6)。




, 百拇医药
图3 空白对照组鼠角膜正常HE×200
图4 抗-CD4组鼠角膜上皮完整,基质水肿增厚,胶纤维走行规则,偶见淋巴细胞及小血管HE×200
图5 抗体的对照组鼠角膜上皮完整,基质高度水肿、增厚,胶原纤维排列紊乱,血管增生明显,可见大量淋巴细胞及中性粒细胞浸润HE×200
图6 抗-CD8组鼠的角膜类似图5的改变HE×200
讨论
一、复发性SK NIH鼠的实验模型的制备
在制备复发性SK的实验动物模型前,首先需要建立起HSV-1潜伏感染的模型,然后用特定的条件或因素来诱导复发。我们选用NIH鼠,经角膜接种HSV-1造成原发性角膜感染。急性感染发生于病毒接种的1周内,然后将鼠继续养育,使病毒进入潜伏感染期。目前公认的潜伏感染期约发生在病毒接种后第12~14天[7,8],而梁凤歧等[9]报道最晚可发生于角膜原发感染完全消失后的第45天。因此,我们将急性感染期的鼠继续养育6周,使病毒有充分的时间建立潜伏感染。病毒接种后第7周,用紫外线B光照射处于病毒潜伏期且角膜恢复光滑透明鼠的角膜诱导其SK的复发。本研究结果显示,紫外线B光诱导SK复发的成功率为76.7%,这与Laycock等[10]报道SK复发率为60%~80%相同。我们制备的复发性SK的NIH鼠的模型具有人类此种疾病的临床特征:灶状角膜基质混浊、局部角膜新生血管化、盘状角膜内皮炎及短暂的树枝状角膜上皮炎[11]。
, 百拇医药
二、CD+4 T淋巴细胞是介导复发性SK免疫病理反应的主要因子
本研究结果显示,在鼠的复发性SK的模型中,于鼠的腹腔内注射单克隆抗体GK1.5可排除鼠体内90%以上的CD+ 4 T淋巴细胞 ,CD+ 4 T淋巴细胞的排除大大降低了SK的复发率,显著地减轻了SK的疾病程度,严重地损伤了鼠对HSV-1抗原产生的DTH反应的能力。因此,我们认为CD+ 4 T淋巴细胞是介导复发性SK免疫病理反应的主要因子。
三、CD+4 T淋巴细胞介导复发性SK免疫病理反应的机制
我们认为,单纯疱疹病毒性基质性角膜炎是一种迟发型超敏反应。CD+4 T淋巴细胞作为抗原特异性细胞与HSV-1抗原结合致敏,释放一些淋巴因子,这些淋巴因子反过来趋化、激活非抗原特异性的细胞,引起局部组织损伤。此观点通过本实验的角膜病理检查结果间接得到证实:接受非特异性免疫球蛋白注射的鼠(抗体的对照组)的角膜基质层内可见大量的淋巴细胞和一些中性粒细胞浸润,伴随着组织的损伤——基质层高度水肿、增厚,胶原纤维排列紊乱、纤维细胞和小血管增生;而排除了CD+4 T淋巴细胞的鼠角膜基质层内仅见个别的淋巴细胞浸润及轻微的角膜水肿。同时,值得强调的是,这些角膜病理改变很轻微的鼠,对HSV-1抗原所产生的DTH反应也非常微弱。因此,我们认为CD+4 T淋巴细胞是通过DTH反应来介导复发性SK的免疫病理反应的。
, http://www.100md.com
四、CD+8 T淋巴细胞不是介导复发性SK免疫病理反应的主要因子
关于CD+8 T淋巴细胞在SK中的作用,Hendricks等[3]认为CD+8 T淋巴细胞是通过细胞毒性作用而介导SK的免疫病理反应,与本研究结果不同。本研究结果显示,在鼠的复发性SK的实验模型中,于鼠的腹腔内注射单克隆抗体H-35将鼠体内95%以上CD+8 T淋巴细胞排除后,未影响SK的复发率,亦未影响SK的疾病程度,更未影响鼠的DTH反应能力。所以,CD+8 T淋巴细胞不是介导复发性SK免疫反应的主要因子。
志谢 美国华盛顿大学的Jay S.Pepose及P.Michael Stuart 博士对本研究的帮助和支持
, 百拇医药
参考文献
1 Metcalf JF, Hamilton DS, Reichert RW. Herpetic keratitis in athmic (nude) mice. Infect Immun, 1979,26:1164-1171.
2 Russell RG, Nasisse MP, Larsen HS,et al. Role of T-lymphocytes in the pathogenesis of herpetic stromal keratitis. Invest Ophthalmol Vis Sci, 1984,25:938-944.
3 Hendricks RL,Tao MS,Glorioso JC.Alterations in the antigenic structure of two major HSV-1 glycoproteins, gC and gB,influence immune regulation and susceptibility to murine herpes keratitis. J Immunol, 1989,142:263-269.
, 百拇医药
4 Rinne JR, Abghari SZ, Stulting RD. The severity of herpes simplex viral keratitis in mice does not reflect the severity of disease in humans. Invest Ophthalmol Vis Sci, 1992,33:268-272.
5 Shimeld C, Hill T, Blyth B,et al. An improved model of recurrent herpetic eye disease in mice.Curr Eye Res, 1989,8:1193-1205.
6 Shimeld C, Hill TJ, Blyth WA,et al. Reactivation of latent infection and induction of recurrent herpetic eye disease in mice. J Gen Virol, 1990,71:397-404.
, http://www.100md.com
7 Lycke E, Kristensson K, Svennerholm B, et al. Uptake and transport of herpes simplex virus in neurites of rat dorsal root ganglia cells in culture. J Gen Virol, 1984,65: 55-64.
8 Cook ML, Bastone VB, Stevens JG. Evidence that neurons harbor latent herpes simplex virus. Infect Immun, 1974,9:946-951.
9 梁凤歧,董晓光,谢立信. 单纯疱疹病毒I型潜伏感染的研究. 眼科研究,1991,9:134-137.
10 Laycock KA, Lee SF, Brady RH, et al. Characterization of a murine model of recurrent herpes simplex viral keratitis induced by ultraviolet B radiation. Invest Ophthalmol Vis Sci, 1991,32:2741-2746.
11 Miller JK, Laycock KA,Umphress JA,et al. A comparison of recurrent and primary herpes simplex keratitis in NIH inbred mice. Cornea, 1996, 15:497-504.
(收稿日期:1999-08-02), 百拇医药