实验性肌炎动物模型制作的研究
http://www.100md.com
37c医学网
作者:赵红东 陈祖舜 沈鸣九
单位:南京医科大学附属 南京第一医院神经内科 210006
关键词:多发性肌炎;动物模型;免疫
临床神经病学杂志000506 【摘要】 目的 研究制作实验性肌炎动物模型的方法。方法 利用家兔骨骼肌匀浆加佛氏佐剂多次免疫豚鼠制成实验性肌炎模型,观察其在肌酶 、肌电图(EMG)、病理的改变。并与人类多发性肌炎(PM)作比较。结果 发现其与人类多发性肌炎(PM)在肌酶、肌电图(EMG)、病理上的改变有相似之处。结论 提示其可作为研究人类PM的一个重要手段,为人类肌炎的发病机理及治 疗提供理论依据。
Study on the establishment of an animal model of experimental myositis
, 百拇医药
Zhao Hongdong Chen Zushun Shen Mingjiu
(Department of Neurology, First Affilia ted Hospital of Nanji ng Medical University, Nanjing 210006)
【Abstract】 Objective To study the way on the establishment of an animal model of experimental myosit is.Methods An animal model of experimental myositis was produced in guinea-pigs by rabbit skeletal muscle homogenates with Freund's complete adjuvant(FCA).The observation was made on serum muscle enzymes,Electromyography(EMG) and muscle biopsy to fin d out their features as compared with human polymyositis(PM).Results [ WTBZ There were similarities in serum muscle enzymes,EMG and muscle biopsy betw een experimental myositis and human polymyositis.Conclusion The result suggested an animal model of experimental myositis might serve as an important means for studying polymyositis in human,and offered the theory basis for its etiopathology and therapy.
, 百拇医药
【Key words】 Polymyositis Animal model Immunity
多发性肌炎(PM)为神经肌肉疾病中常见的一种疾病,是一种与自身免疫有关的特发性 骨骼肌炎症。我们应用改良方法用家兔骨骼肌匀浆加佛氏佐剂多次免疫豚鼠,使其体内发生 特异性免疫反应,产生肌肉抗体,从而制成实验性肌炎模型。观察其在肌酶(LDH、CK、A ST)、肌电图及肌肉病理上的改变,并进行初步分析和探讨。
1 材料与方法
1.1 实验动物 22只英国短毛豚鼠(南京医科大学实验动物中心提供),体重300~400 g, 平均350 g。均行动活跃,食欲佳,处于健康状态。分成2组:实验组:14只,对照组:8只 。
1.2 方法
1.2.1 动物模型制作 肌匀浆的制备:取新鲜的家兔骨骼肌,在冰台上剔除其神经、血管 、筋膜。纯骨骼肌肉予以切碎后加pH 7.2磷酸缓冲液(20%W/V),冰水浴中用刀式匀浆机 以1700 rpm匀浆3次,一次5秒,间隔30秒。然后用4层纱布过滤,溶液再用磨式匀浆机以300 0 rpm匀浆3次,一次5秒,间隔30秒,加去垢剂Triton-X-100(上海华美生物制品厂), 两者比例100:1,混合后2500 g×10分钟(4℃)离心。取上清予考马斯亮兰蛋白定量法定 量后,分装置-20℃冰箱备用。用时再与完全佛氏佐剂2:1混合。肌匀浆蛋白浓度测 定:采用Bradford方法[1]。免疫方法:每周于豚鼠项背部依次皮下注射1次,实 验组给予肌匀浆0.2 ml+FCA 0.1 ml,共8次,对照组予生理盐水0.2 ml+FCA 0.1 ml。
, http://www.100md.com
1.2.2 动物肌炎检测方法
1.2.2.1 肌酶谱测定 免疫前及免疫后2、4、6、8周分别心脏穿刺采血2~3 ml/只/次。取 新鲜血清应用Au800型生化自动分析仪通过速率法检测,试剂由Sularo公司提供。
1.2.2.2 肌电图检测 实验前及免疫注射后8周检查豚鼠的后肢及前肢,左右随机进行同心 针电极肌电图检查,肌电图仪为国产JD-Ⅱ型肌电图仪,室温15~20℃。
1.2.2.3 病理检查 实验组分别于免疫注射后2周、4周、6周于肌酶升高者中分别抽检2~3 只,于免疫8周后实验及对照两组均予心脏注射空气栓子致死,每只于四肢肌肉多部位取材( 同时取心、肺等组织,分别予10%甲醛及5%戊二醛固定),送光镜及电镜检查。
2 结 果
2.1 动物肌炎临床表现 对照组动物注射后局部有直径0.2~0.5 cm硬节,渐变小,2~3周 有2只结节破溃,后自愈;饮食、活动无异常,体重渐至600 g左右。实验组动物注射后1~2 天注射局部有0.5~1 cm的硬节、红肿,1周后结节变软、有波动感、破溃,部 分体温升高,2周时最明显,4周开始创口愈合,肿块逐渐变小,至8周时呈硬块。4~6周后 出现不同程度的活动减少,体重减轻(50 g~150 g),毛色暗淡无光。
, 百拇医药
2.2 肌酶谱测定结果 实验组和对照组豚鼠实验前后血肌酶谱检测结果见表1。由表可见肌 酶于免疫注射后4周开始上升,于6~8周达最高峰,其中以CK最为敏感。
2.3 肌电图改变 实验组和对照组豚鼠实验前后EMG检测结果见表2。实验组运动单位时限 明显缩短,波幅降低,多相波增多。两组均予重频电刺激,均未见波幅衰减现象。
表1 实验组和对照组实验前后血肌酶谱改变( ±s,Iu/L)
±s,Iu/L)
CK
LDH
AST
实验组
实验前
, 百拇医药
133.55±47.88
107.68±46.70
37.98±7.89
实验后 2周
154.66±45.03
126.87±26.11
37.05±3.64
实验后 4周
392.06±131.67**
170.48±27.89*
74.95±27.98△
, http://www.100md.com
实验后 6周
585.90±261.88**△△
269.72±110.30**△△
104.5±37.27**△△
实验后 8周
797.91±218.30**△△
261.10±37.74**△△
137.33±42.62**△△
对照组
, http://www.100md.com 实验前
140.58±45.73
120.97±38.93
37.63±7.78
实验后
141.32±40.26
123.67±25.08
37.86±4.05
与对照组比较*P<0.05,**P<0.01;与实验后2周比较△P<0.05, △△P<0.01 表2 实验组及对照组实验前后EMG改变( ±s,n=8)
±s,n=8)
, http://www.100md.com
时限(ms)
波幅(mv)
多相波(%)
前肢
后肢
前肢
后肢
前肢
后肢
实验前
实验组
2.73±0.24
3.13±0.07
, http://www.100md.com
350.42±60.00
390.39±72.00
-
3.80
对照组
2.92±0.18
3.27±0.08
353.27±70.53
407.53±65.00
-
4.68
实验后
, http://www.100md.com
实验组
1.70±0.19*
1.94±0.13*
200.18±58.12*
208.07±60.04*
62.5
71.2
对照组
2.89±0.23
3.18±0.12
338.31±41.48
, 百拇医药
366.91±40.82
-
4.23
与对照组比较*P<0.05
2.4 病理改变 实验组免疫2周内抽检2只豚鼠行病理检查未见异常。免疫4、6、8周时各检查3只,均发现肌 肉组织病理改变,病变以骨骼肌多发性炎症为特点。镜下见横纹肌呈灶性分布的肌细胞变性 、坏死和炎细胞浸润,间质小血管壁增厚,周围有炎细胞浸润(见图1、2)。电镜检查示: 肌原纤维明暗带消失,肌原纤维肿胀、断裂、出现空泡化,线粒体凝聚、空泡化、肌束间隙 增宽,示有肌萎缩(见图3、4)。对照组动物肌肉病理检查未见异常。
3 讨 论
本实验以家兔骨骼肌匀浆加佛氏佐剂多次免疫豚鼠,使其体内发生特异性免疫反应,产生肌 肉抗体,兔骨骼肌与豚鼠骨骼肌具有抗原交叉性,从而制成实验性肌炎模型。本实验14只豚 鼠经免疫后均出现了肌炎的临床、生化、病理的改变。本实验参照Kalden[2]、Daw kin等[3]抗原的制备方法,并将侯熙德[4]的制作方法加以改进。在匀 浆中加入去垢剂Triton-X-100,其具有破膜作用,可破坏一切生物膜,使细胞内的成分充分释放出来,并 具有乳化、分散 、增溶作用,宜于蛋白质的提取,其后予2 500 g×10分钟离心,利用差速离心法弃除细胞 核 ,完整的细胞及组织碎片,较以前的方法抗原制备有所纯化,减少了实验中的非特异反应。 在本实验中抗原定量采用考马斯亮兰蛋白定量法,较干重法更科学、精确。Kalden[2 ]在利用实验性肌炎模型进行免疫研究时,免疫反应中出现的差异原因其总结为肌匀浆干 重相同而实际蛋白量不同。
, 百拇医药
人类PM为一种骨骼肌特发性炎症,其血清肌酶水平升高,肌电图呈肌原性损害,病理组织学 特征为肌纤维变性、坏死及炎细胞浸润,本实验中实验组豚鼠肌酶升高及病理组织学改变发 生于免疫4周后,与人类PM亚急性起病的特点相符,且肌酶、肌电图及病理上的改变特征与 人类肌炎相似。用肌匀浆免疫豚鼠可以获得类似于人类多发性肌炎的病变,提示人类多发性 肌炎为自身免疫性疾病。
肌炎时肌细胞变性坏死,细胞内的酶释放入血,导致血中肌酶升高,其可全面的反映肌肉病 变程度。肌酶的改变与病理改变相平行。肌酶监测法简便、易行,无创伤,可重复。与其相 比,病理检查虽是最后的确诊标准,但因其创伤大,不宜重复检查,且受活检部位局限性影 响可出现假阴性,因而不宜作动态观察指标。在判断模型是否成立时,单靠病理检查是不够全面的。肌电图表现为肌原性损害征象,重频电刺激未见运动电位波幅减少,可 排除神经肌肉终板进入豚鼠体内造成重症肌无力的可能。肌电图及病理的改变见于上下肢提 示本病为多发性而非局限性。肌酶、肌电图、病理3个指标相辅相成,为确定肌炎模型成功 的指标。还可以作为判断病情、疗效的指标。
, http://www.100md.com
实验性肌炎模型在肌酶、肌电图、病理的改变说明其建立是成功的,且与人类肌炎有相似之 处,提示其可作为研究人类肌炎的一个重要工具,为研究人类肌炎的发病机理及治疗提供理 论依据。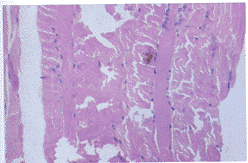
图1 肌纤维变性,胞浆明显深染。HE×100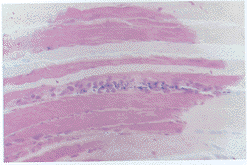
图2 肌纤维间炎症细胞浸润。HE×100
图3肌原纤维明暗带消失,部分线粒体嵴排列紊乱甚至消失,基质中出现空泡化,另有 一部分线粒体完全空泡化。×30 000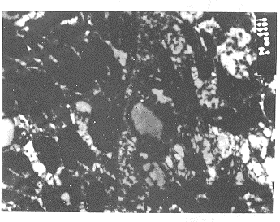
, 百拇医药
图4 肌纤维排列紊乱,肌束间出现无定型的空泡化。×30 000
参 考 文 献
1,Bradford MM. A rapid and sensitive method for the quantitative of microgram quan tities of protein utilizing the principle of protein dye binding.Ann Biochem,197 6,72:248
2,Kalden WG. Experimental myasthenia gravis, myositis and myocarditis in gu inea-pigs immunized with subcellular fractions of calf thymus or calf skeletal muscle in Freund's complete adjuvant.Clin Exp Immuni,1973,13:79
3,Dawkins RL. Experimental myositis associated with hypersensitivity to muscle.J P ath Bact,1996,90:619
4,侯熙德.多发性肌炎动物模型的研究.中国实验临床免疫学杂志,1993,5:3
收稿1999-08-16
修回2000-06-27, 百拇医药
单位:南京医科大学附属 南京第一医院神经内科 210006
关键词:多发性肌炎;动物模型;免疫
临床神经病学杂志000506 【摘要】 目的 研究制作实验性肌炎动物模型的方法。方法 利用家兔骨骼肌匀浆加佛氏佐剂多次免疫豚鼠制成实验性肌炎模型,观察其在肌酶 、肌电图(EMG)、病理的改变。并与人类多发性肌炎(PM)作比较。结果 发现其与人类多发性肌炎(PM)在肌酶、肌电图(EMG)、病理上的改变有相似之处。结论 提示其可作为研究人类PM的一个重要手段,为人类肌炎的发病机理及治 疗提供理论依据。
Study on the establishment of an animal model of experimental myositis
, 百拇医药
Zhao Hongdong Chen Zushun Shen Mingjiu
(Department of Neurology, First Affilia ted Hospital of Nanji ng Medical University, Nanjing 210006)
【Abstract】 Objective To study the way on the establishment of an animal model of experimental myosit is.Methods An animal model of experimental myositis was produced in guinea-pigs by rabbit skeletal muscle homogenates with Freund's complete adjuvant(FCA).The observation was made on serum muscle enzymes,Electromyography(EMG) and muscle biopsy to fin d out their features as compared with human polymyositis(PM).Results [ WTBZ There were similarities in serum muscle enzymes,EMG and muscle biopsy betw een experimental myositis and human polymyositis.Conclusion The result suggested an animal model of experimental myositis might serve as an important means for studying polymyositis in human,and offered the theory basis for its etiopathology and therapy.
, 百拇医药
【Key words】 Polymyositis Animal model Immunity
多发性肌炎(PM)为神经肌肉疾病中常见的一种疾病,是一种与自身免疫有关的特发性 骨骼肌炎症。我们应用改良方法用家兔骨骼肌匀浆加佛氏佐剂多次免疫豚鼠,使其体内发生 特异性免疫反应,产生肌肉抗体,从而制成实验性肌炎模型。观察其在肌酶(LDH、CK、A ST)、肌电图及肌肉病理上的改变,并进行初步分析和探讨。
1 材料与方法
1.1 实验动物 22只英国短毛豚鼠(南京医科大学实验动物中心提供),体重300~400 g, 平均350 g。均行动活跃,食欲佳,处于健康状态。分成2组:实验组:14只,对照组:8只 。
1.2 方法
1.2.1 动物模型制作 肌匀浆的制备:取新鲜的家兔骨骼肌,在冰台上剔除其神经、血管 、筋膜。纯骨骼肌肉予以切碎后加pH 7.2磷酸缓冲液(20%W/V),冰水浴中用刀式匀浆机 以1700 rpm匀浆3次,一次5秒,间隔30秒。然后用4层纱布过滤,溶液再用磨式匀浆机以300 0 rpm匀浆3次,一次5秒,间隔30秒,加去垢剂Triton-X-100(上海华美生物制品厂), 两者比例100:1,混合后2500 g×10分钟(4℃)离心。取上清予考马斯亮兰蛋白定量法定 量后,分装置-20℃冰箱备用。用时再与完全佛氏佐剂2:1混合。肌匀浆蛋白浓度测 定:采用Bradford方法[1]。免疫方法:每周于豚鼠项背部依次皮下注射1次,实 验组给予肌匀浆0.2 ml+FCA 0.1 ml,共8次,对照组予生理盐水0.2 ml+FCA 0.1 ml。
, http://www.100md.com
1.2.2 动物肌炎检测方法
1.2.2.1 肌酶谱测定 免疫前及免疫后2、4、6、8周分别心脏穿刺采血2~3 ml/只/次。取 新鲜血清应用Au800型生化自动分析仪通过速率法检测,试剂由Sularo公司提供。
1.2.2.2 肌电图检测 实验前及免疫注射后8周检查豚鼠的后肢及前肢,左右随机进行同心 针电极肌电图检查,肌电图仪为国产JD-Ⅱ型肌电图仪,室温15~20℃。
1.2.2.3 病理检查 实验组分别于免疫注射后2周、4周、6周于肌酶升高者中分别抽检2~3 只,于免疫8周后实验及对照两组均予心脏注射空气栓子致死,每只于四肢肌肉多部位取材( 同时取心、肺等组织,分别予10%甲醛及5%戊二醛固定),送光镜及电镜检查。
2 结 果
2.1 动物肌炎临床表现 对照组动物注射后局部有直径0.2~0.5 cm硬节,渐变小,2~3周 有2只结节破溃,后自愈;饮食、活动无异常,体重渐至600 g左右。实验组动物注射后1~2 天注射局部有0.5~1 cm的硬节、红肿,1周后结节变软、有波动感、破溃,部 分体温升高,2周时最明显,4周开始创口愈合,肿块逐渐变小,至8周时呈硬块。4~6周后 出现不同程度的活动减少,体重减轻(50 g~150 g),毛色暗淡无光。
, 百拇医药
2.2 肌酶谱测定结果 实验组和对照组豚鼠实验前后血肌酶谱检测结果见表1。由表可见肌 酶于免疫注射后4周开始上升,于6~8周达最高峰,其中以CK最为敏感。
2.3 肌电图改变 实验组和对照组豚鼠实验前后EMG检测结果见表2。实验组运动单位时限 明显缩短,波幅降低,多相波增多。两组均予重频电刺激,均未见波幅衰减现象。
表1 实验组和对照组实验前后血肌酶谱改变(
 ±s,Iu/L)
±s,Iu/L)CK
LDH
AST
实验组
实验前
, 百拇医药
133.55±47.88
107.68±46.70
37.98±7.89
实验后 2周
154.66±45.03
126.87±26.11
37.05±3.64
实验后 4周
392.06±131.67**
170.48±27.89*
74.95±27.98△
, http://www.100md.com
实验后 6周
585.90±261.88**△△
269.72±110.30**△△
104.5±37.27**△△
实验后 8周
797.91±218.30**△△
261.10±37.74**△△
137.33±42.62**△△
对照组
, http://www.100md.com 实验前
140.58±45.73
120.97±38.93
37.63±7.78
实验后
141.32±40.26
123.67±25.08
37.86±4.05
与对照组比较*P<0.05,**P<0.01;与实验后2周比较△P<0.05, △△P<0.01 表2 实验组及对照组实验前后EMG改变(
 ±s,n=8)
±s,n=8), http://www.100md.com
时限(ms)
波幅(mv)
多相波(%)
前肢
后肢
前肢
后肢
前肢
后肢
实验前
实验组
2.73±0.24
3.13±0.07
, http://www.100md.com
350.42±60.00
390.39±72.00
-
3.80
对照组
2.92±0.18
3.27±0.08
353.27±70.53
407.53±65.00
-
4.68
实验后
, http://www.100md.com
实验组
1.70±0.19*
1.94±0.13*
200.18±58.12*
208.07±60.04*
62.5
71.2
对照组
2.89±0.23
3.18±0.12
338.31±41.48
, 百拇医药
366.91±40.82
-
4.23
与对照组比较*P<0.05
2.4 病理改变 实验组免疫2周内抽检2只豚鼠行病理检查未见异常。免疫4、6、8周时各检查3只,均发现肌 肉组织病理改变,病变以骨骼肌多发性炎症为特点。镜下见横纹肌呈灶性分布的肌细胞变性 、坏死和炎细胞浸润,间质小血管壁增厚,周围有炎细胞浸润(见图1、2)。电镜检查示: 肌原纤维明暗带消失,肌原纤维肿胀、断裂、出现空泡化,线粒体凝聚、空泡化、肌束间隙 增宽,示有肌萎缩(见图3、4)。对照组动物肌肉病理检查未见异常。
3 讨 论
本实验以家兔骨骼肌匀浆加佛氏佐剂多次免疫豚鼠,使其体内发生特异性免疫反应,产生肌 肉抗体,兔骨骼肌与豚鼠骨骼肌具有抗原交叉性,从而制成实验性肌炎模型。本实验14只豚 鼠经免疫后均出现了肌炎的临床、生化、病理的改变。本实验参照Kalden[2]、Daw kin等[3]抗原的制备方法,并将侯熙德[4]的制作方法加以改进。在匀 浆中加入去垢剂Triton-X-100,其具有破膜作用,可破坏一切生物膜,使细胞内的成分充分释放出来,并 具有乳化、分散 、增溶作用,宜于蛋白质的提取,其后予2 500 g×10分钟离心,利用差速离心法弃除细胞 核 ,完整的细胞及组织碎片,较以前的方法抗原制备有所纯化,减少了实验中的非特异反应。 在本实验中抗原定量采用考马斯亮兰蛋白定量法,较干重法更科学、精确。Kalden[2 ]在利用实验性肌炎模型进行免疫研究时,免疫反应中出现的差异原因其总结为肌匀浆干 重相同而实际蛋白量不同。
, 百拇医药
人类PM为一种骨骼肌特发性炎症,其血清肌酶水平升高,肌电图呈肌原性损害,病理组织学 特征为肌纤维变性、坏死及炎细胞浸润,本实验中实验组豚鼠肌酶升高及病理组织学改变发 生于免疫4周后,与人类PM亚急性起病的特点相符,且肌酶、肌电图及病理上的改变特征与 人类肌炎相似。用肌匀浆免疫豚鼠可以获得类似于人类多发性肌炎的病变,提示人类多发性 肌炎为自身免疫性疾病。
肌炎时肌细胞变性坏死,细胞内的酶释放入血,导致血中肌酶升高,其可全面的反映肌肉病 变程度。肌酶的改变与病理改变相平行。肌酶监测法简便、易行,无创伤,可重复。与其相 比,病理检查虽是最后的确诊标准,但因其创伤大,不宜重复检查,且受活检部位局限性影 响可出现假阴性,因而不宜作动态观察指标。在判断模型是否成立时,单靠病理检查是不够全面的。肌电图表现为肌原性损害征象,重频电刺激未见运动电位波幅减少,可 排除神经肌肉终板进入豚鼠体内造成重症肌无力的可能。肌电图及病理的改变见于上下肢提 示本病为多发性而非局限性。肌酶、肌电图、病理3个指标相辅相成,为确定肌炎模型成功 的指标。还可以作为判断病情、疗效的指标。
, http://www.100md.com
实验性肌炎模型在肌酶、肌电图、病理的改变说明其建立是成功的,且与人类肌炎有相似之 处,提示其可作为研究人类肌炎的一个重要工具,为研究人类肌炎的发病机理及治疗提供理 论依据。

图1 肌纤维变性,胞浆明显深染。HE×100

图2 肌纤维间炎症细胞浸润。HE×100

图3肌原纤维明暗带消失,部分线粒体嵴排列紊乱甚至消失,基质中出现空泡化,另有 一部分线粒体完全空泡化。×30 000

, 百拇医药
图4 肌纤维排列紊乱,肌束间出现无定型的空泡化。×30 000
参 考 文 献
1,Bradford MM. A rapid and sensitive method for the quantitative of microgram quan tities of protein utilizing the principle of protein dye binding.Ann Biochem,197 6,72:248
2,Kalden WG. Experimental myasthenia gravis, myositis and myocarditis in gu inea-pigs immunized with subcellular fractions of calf thymus or calf skeletal muscle in Freund's complete adjuvant.Clin Exp Immuni,1973,13:79
3,Dawkins RL. Experimental myositis associated with hypersensitivity to muscle.J P ath Bact,1996,90:619
4,侯熙德.多发性肌炎动物模型的研究.中国实验临床免疫学杂志,1993,5:3
收稿1999-08-16
修回2000-06-27, 百拇医药
参见:首页 > 医疗版 > 疾病专题 > 神经内科 > 肌病 > 多发性肌炎