血管性血友病因子Ala737→Glu突变体的构建和表达
http://www.100md.com
37c医学网
作者:王迎春 张敬宇 万海英 张威 阮长耿
单位:215006 苏州医学院附属第一医院、江苏省血液研究所
关键词:von;Willebrand病因子;突变;体外定点诱变;基因表达
中华血液学杂志000509 【摘要】 目的 研究血管性血友病因子(vWF)Ala737→Glu突变对vWF功能的影响,分析vWF Ala737→Glu突变致2A型血管性血友病(vWD)的分子病理机制。方法 用聚合酶链反应(PCR)的方法对野生型的vWF全长表达质粒(pSVvWF)进行体外定点诱变,在COS-7细胞中进行表达。分析其表达上清和细胞裂解液中的vWF∶Ag和上清的vWF的多聚物,观察患者血小板中的vWF多聚物及患者对DDAVP(糜凝)的治疗反应。结果 vWF Ala737→Glu的突变体上清vWF∶Ag是野生型的76.4%,裂解液中vWF∶Ag是野生型的98.8%。vWF突变体的多聚物形态和野生型相似,患者血小板中的vWF多聚物存在全部分子量的形式,糜凝治疗后vWF∶Ag明显升高。结论 vWF Ala737→Glu的突变没有影响vWF的分泌和转运,vWF Ala737→Glu突变致第Ⅱ类2A型vWD。
, http://www.100md.com
Construction and transient expression of an Ala 737→Glu mutant of vWF
WANG Yingchun, ZHANG Jingyu, WAN Haiying, et al.
(Thrombosis and Hemostasis Research Unit, The First Affiliated Hospital, Suzhou Medical College, Jiangsu Institute of Hematology, Suzhou 215006, China)
【Abstract】 Objective To study the functional change of an Ala737→Glu substitution mutant of vWF and the molecular pathological mechanism of this mutant in the type 2A vWD. Methods The expression plasmid pSVvWF containing full-length cDNA of vWF was used to site direct mutagenesis by polymerase chain reaction(PCR) and transitorily expressed in the COS-7 cells, vWF:Ag in the supernatant and the cell lysate between wild type and pSVAla737Glu vWF were measured. vWF polymers of the platelet of the patient with the mutation and response to DDAVP treatment of the patient were observed. Results vWF:Ag level of pSVAla 737Glu vWF was 76.4% and 98.8% of the wild types in the supernatant and cell lysate, respectively. The polymer pattern of extracellular pSVAla737Glu vWF was indistinguishable from that of the wild type, containing all kinds of molecular weight. Increased vWF antigen levels was observed in the patients after DDAVP treatment. Conclusion This mutant did not change the assembly and secretion of vWF. The mutant of vWF Ala737→Glu resulted in Group Ⅱ type 2A vWD.
, 百拇医药
【Key words】 von Willebrand factor; Mutation; Site direct mutagenesis; Gene expression
血管性血友病因子(vWF)在初期止血过程中起重要作用,它与血管内皮下基质及胶原相结合,同时与血小板上的受体GpⅠb、GpⅡb/Ⅲa相结合,导致血小板的粘附和聚集。在vWF上有与胶原、GpⅠb、GpⅡb/Ⅲa等结合的特定结构域。vWF功能存在着精细的调控,其蛋白不同区域的氨基酸置换会导致不同类型的血管性血友病。vWF Ala737Glu是一新的基因突变[1],为进一步了解Ala737Glu氨基酸改变对vWF功能的影响,我们构建了Ala737Glu vWF的突变体,在COS-7细胞中进行了表达,对其抗原表达量和蛋白质特性进行了研究。
材料和方法
1 聚合酶链反应(PCR)产物的克隆和测序 以含vWF全长cDNA的野生型表达质粒pSVvWF(Sadler JE教授惠赠)为模板。
, 百拇医药
引物: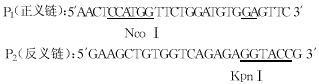
扩增含有突变体的PCR产物。PCR反应体系为50μl,包括200μmol/L dNTPs,10mmol/L Tris-HCl,50mmol/L KCl, 1.5mmol/L MgCl2,正反向引物各20pmol,DNA模板50ng,Taq DNA聚合酶1.5U。退火温度60℃,35个循环,以20g/L的琼脂糖凝胶电泳检查PCR产物。
PCR产物通过补平、磷酸化、纯化后与SmaⅠ酶切的载体pUC18相连接、转化后,提取质粒用BamHⅠ,HindⅢ双酶切进行克隆鉴定,克隆的全长PCR产物用双脱氧末端终止法进行序列测定。
2 利用突变基因最近的酶切位点NcoⅠ和KpnⅠ把带有突变体的片段克隆进表达载体,操作过程中为了避免重复的酶切位点,采取了一系列的中间载体的置换,最终获得含Ala737Glu突变体的全长vWF表达质粒pSVAla737Glu vWF。
, 百拇医药
3 pSVvWF和pSVAla737Glu vWF的转染和表达 处于对数生长期的COS-7细胞,以2×105个细胞接种在直径为35mm的组织培养皿上,用DMEM完全培养液,于37℃含CO2的培养箱中培养12~16h,使细胞达50%~80%的融合。用无血清培养基和Opti-MEM培养基洗涤待转染的细胞,Opti-MEM培养基孵育30min备用。每份转染细胞用100μl Opti-MEM培养基稀释lipofectamine(购自GIBCO/BRL公司)10μl和已纯化的质粒2μg室温孵育30min。脂质体和DNA的混合物加0.9ml的Opti-MEM培养基打匀滴加在待转染的细胞上,于37℃含CO2的培养箱中培养5h,弃转染混合物,每皿加完全培养基2ml,48h后收获上清,收获的上清中加40μl的混合蛋白酶抑制剂。培养的细胞用PBS洗涤2次,用细胞裂解液2ml(150mmol/L NaCl,50mmol/L Tris-HCl,pH 7.5, 5g/L SDS,10g/L NP40,5mmol/L EDTA, 2mmol/L 碘乙酸,2mmol/L N-乙基顺丁烯二酰亚胺和2mmol/L PMSF)进行细胞裂解。
, 百拇医药
4 转染的内对照 pSVβ-Gal质粒以同上方法进行转染,与完全培养基孵育48h后弃上清,PBS洗涤细胞3次,用Promega公司提供的方法进行染色,显微镜下观察转染效率。
5 ELISA法检测 野生型和突变体转染COS-7细胞的表达上清和细胞裂解液,参照文献[2]进行vWF∶Ag检测。
6 表达上清的多聚物分析 COS-7细胞的表达上清经过超滤后以ELISA法定量,每孔含vWF∶Ag 30ng进行血浆多聚物分析。
7 血小板多聚物分析 参照文献[3]取先证者的父亲静脉血5ml,用EDTA抗凝,800r/min离心5min,分离富含血小板的血浆(PRP),PRP与等量的溶液Ⅰ(0.013mol/L柠檬酸、0.028mol/L 葡萄糖、0.123mol/L NaCl,0.005mol/L EDTA-Na2,0.001mol/L亮抑制肽,pH 6.5)混合,2000r/min离心20min,弃上清用溶液Ⅰ洗涤2次,然后将血小板重悬在溶液Ⅱ(0.01mol/L Tris, 0.14mol/L NaCl,0.005mol/L EDTA-Na2,0.001mol/L 亮抑制肽)-70℃冻融5次。最后1次融化以10000r/min离心5min,上清以15g/L的SDS-琼脂糖凝胶进行电泳。
, 百拇医药
8 DDAVP(糜凝)的治疗 患者用药前检测vWF∶Ag的含量,按0.3μg/kg的用量,生理盐水稀释后静脉注射,30min推注完毕。在30min和1h再次检测vWF∶Ag的含量,比较用药前后的变化。
结果
1 pSVAla737Glu vWF突变体的构建 全长vWF的cDNA用EcoRⅤ和HindⅢ酶切置换到pET20b,获得中间载体pET20b vWF1。然后,利用pET20bvWF1中的单一酶切位点BamHⅠ和KpnⅠ,使获得的片段置换进pUC18,获得中间载体pUC18F2。引物P1和P2扩增含有NcoⅠ,KpnⅠ和4499位核苷酸C→A突变的256bp的PCR产物F3′,以平端克隆进pUC18,测序结果表明,PCR产物除4499位核苷酸存在C→A突变外,其余序列与野生型相同。
测序正确的PCR产物F3′通过NcoⅠ,KpnⅠ位点,替换pUC18F2中的F3′,获得pUC18F2′,再经过中间载体pET20bvWF1′,最后获得带有突变体的表达质粒pSVAla737Glu vWF。最终表达质粒酶切鉴定结果见图1。 图1 pSVvWF和pSVAla737Glu vWF的酶切鉴定
图1 pSVvWF和pSVAla737Glu vWF的酶切鉴定
, 百拇医药
2 β-Gal转染效率的观察 β-Gal基因与pSVvWF共转染COS-7细胞,经X-gal染色呈蓝色,计算转染效率为38.6%。
3 ELISA法检测vWF∶Ag表达水平 pSVvWF的表达上清vWF∶Ag的平均含量为170μg/L, pSVAla737GluvWF表达上清vWF∶Ag的平均含量为129.9μg/L,突变体的表达上清vWF∶Ag的含量是野生型的76.4%。突变体细胞裂解液中的vWF∶Ag表达量是野生型的98.8%,两者差异无显著性。
4 浓缩后的表达 以上清vWF∶Ag各30μg进行多聚物分析,表达上清中所形成的多聚物存在大中分子量的卫星条带,野生型和突变体的差异无显著性(见图2)。
5 血小板中多聚体分析 患者血小板裂解液中存在大中分子量的多聚物,与突变体在体外COS-7细胞中的表达一致(见图3)。
, 百拇医药
1:转染pSVvWF质粒的细胞表达上清;2:转染pSVAla737Glu vWF质粒的细胞表达上清;3:2A型vWD患者血浆
图2 表达上清的多聚物分析
图3 Ala 737GluvWF患者和正常人血小板vWF多聚物分析
6 DDAVP治疗前,患者vWF∶Ag含量为10.37%,按0.3μg/kg的用量,30min后检测vWF∶Ag含量为178.45%,1h后再次检测vWF∶Ag的含量为176.12%。用药后30min vWF∶Ag的含量是用药前的17.2倍。
讨论
2A型vWD基因的点突变是2A型vWD的主要病因,其基因突变主要丛集在28号外显子的3′端,vWF的A2功能域。该区域包括842Tyr和843Met的水解位点。2A型vWD存在高度的异质性,迄今已发现超过20种的基因突变(http://mmg2.im.med.umich.edu/vWF)。其中Arg834Trp的突变最常见,占已发现突变的1/3。对已发现的基因突变,有10种进行了体外定点诱变和表达[4,5]。vWD的分子病理机制至少分为两个亚型。Ⅰ类包括G742R、S743L、L777P、V844D,该类突变影响了多聚物的形成和运输,vWF储存在内质网中,体外表达证明,表达上清中vWF∶Ag含量明显减少,细胞裂解液中vWF∶Ag含量明显增加,表达上清中无大中分子量的多聚物。Ⅱ类包括R834W、R834Q 、G742E、 L865I、 E875K ,vWF∶Ag的表达量和多聚物的形态与野生型vWF差异无显著性,突变导致vWF空间构型的改变,对血浆蛋白酶异常敏感,使分泌和转运正常的vWF在血浆中被降解,大中分子量的多聚物消失。
, http://www.100md.com
我们对vWF737位氨基酸,谷氨酸→丙氨酸的突变进行了体外定点诱变和表达。用PCR方法扩增了突变位点最近的两个酶切位点NcoⅠ和KpnⅠ之间的全部序列,通过PCR方法带入C→A突变,对扩增的PCR全长序列进行了测序,除突变位点外其余序列都与野生型的序列相同。通过酶切置换最终获得了带有单个核苷酸改变的表达质粒pSVAla 737Glu vWF。同时,采用了带有SV40强启动子的真核表达载体pSV7D,野生型表达质粒pSVvWF含有vWF基因全长的cDNA,是研究vWD体外表达的最常用的表达质粒之一[6],适合在COS-7细胞中进行表达。COS-7真核细胞表达系统具有高表达效率,在转染48h后可获得分泌型蛋白质可供研究,同时对翻译后的蛋白进行加工,更能模拟体内蛋白质的合成。
vWF合成后在内质网中形成二聚体后,转运至高尔基体进一步加工形成多聚物,多聚物的相对分子质量达(5×105)~(10×106),vWF多聚物合成后储存在血小板的α颗粒和内皮细胞的Weibel-Plalade小体中,血小板中的多聚物反映了vWF合成、装配和运输的全过程,患者血小板中存在vWF多聚物的所有形态,与突变体的表达上清中多聚物的结构相同。说明基因的突变没有影响vWF合成、装配和运输,患者血浆中缺乏大中分子量的多聚物,推测结构异常的vWF对血浆中的某种蛋白酶异常敏感,导致大中分子量的降解。vWF基因C→A的突变致Ala737Glu的替换,其分子致病类型属于Ⅱ类亚型。目前,已有证据直接证明R834Q突变体的vWF对血浆中的金属蛋白酶异常敏感,表达上清中大中分子量的多聚物被降解的过程[7]。
, http://www.100md.com
患者用糜凝治疗后,vWF∶Ag的含量较治疗前升高17.2倍,与其他Ⅱ类患者对糜凝的反应相似。通过对血小板多聚物的分析对2A型vWD进行再分类,可指导临床用药,值得进一步研究。
基金项目:国家自然科学基金资助项目(39670331)
参考文献
1,王迎春,张敬宇,万海英,等. 2A型血管性血友病vWF基因Ala737(GCG)→Glu(GAG)的突变. 中华血液学杂志,1999,20:117-119.
2,奚晓东,阮长耿,李佩霞,等. 抗血管性假血友病因子单克隆抗体ELISA的建立及其临床应用. 中华医学检验杂志,1988,11:272-275.
3,Ruggeri ZM,Zimmerman TS. The complex multimeric composition of factor Ⅷ/von Willebrand factor. Blood,1981,57:1140-1143.
, 百拇医药
4,Ginsburg D, Bowie EJW. Molecular genetics of von Willebrand disease. Blood ,1992,79:2507-2519.
5,Lyons SE, Baruck ME, Bowie EJW, et al. Impaired intercellular transport produced by a subset of type Ⅱ A von Willebrand disease mutations. J Biol Chem, 1992,267:4424-4430.
6,Englender T, Lattuada A, Mannucci PM,et al. Analysis of Arg834 Gln and Val902Glu type 2A von Willebrand disease mutations:studies with recombinant von Willebrand factor and correlation with patient characteristics.Blood,1996,87: 2788-2794.
7,Tsai HM, Sussman II, Ginsburg D, et al. Proteolytic cleavage of recombinant type 2A von Willebrand factor mutants R834W and R834Q:inhibition by doxycline and by monoclonal antibody VP-1.Blood,1997,89:1954-1962.
(收稿日期:1999-08-16), 百拇医药
单位:215006 苏州医学院附属第一医院、江苏省血液研究所
关键词:von;Willebrand病因子;突变;体外定点诱变;基因表达
中华血液学杂志000509 【摘要】 目的 研究血管性血友病因子(vWF)Ala737→Glu突变对vWF功能的影响,分析vWF Ala737→Glu突变致2A型血管性血友病(vWD)的分子病理机制。方法 用聚合酶链反应(PCR)的方法对野生型的vWF全长表达质粒(pSVvWF)进行体外定点诱变,在COS-7细胞中进行表达。分析其表达上清和细胞裂解液中的vWF∶Ag和上清的vWF的多聚物,观察患者血小板中的vWF多聚物及患者对DDAVP(糜凝)的治疗反应。结果 vWF Ala737→Glu的突变体上清vWF∶Ag是野生型的76.4%,裂解液中vWF∶Ag是野生型的98.8%。vWF突变体的多聚物形态和野生型相似,患者血小板中的vWF多聚物存在全部分子量的形式,糜凝治疗后vWF∶Ag明显升高。结论 vWF Ala737→Glu的突变没有影响vWF的分泌和转运,vWF Ala737→Glu突变致第Ⅱ类2A型vWD。
, http://www.100md.com
Construction and transient expression of an Ala 737→Glu mutant of vWF
WANG Yingchun, ZHANG Jingyu, WAN Haiying, et al.
(Thrombosis and Hemostasis Research Unit, The First Affiliated Hospital, Suzhou Medical College, Jiangsu Institute of Hematology, Suzhou 215006, China)
【Abstract】 Objective To study the functional change of an Ala737→Glu substitution mutant of vWF and the molecular pathological mechanism of this mutant in the type 2A vWD. Methods The expression plasmid pSVvWF containing full-length cDNA of vWF was used to site direct mutagenesis by polymerase chain reaction(PCR) and transitorily expressed in the COS-7 cells, vWF:Ag in the supernatant and the cell lysate between wild type and pSVAla737Glu vWF were measured. vWF polymers of the platelet of the patient with the mutation and response to DDAVP treatment of the patient were observed. Results vWF:Ag level of pSVAla 737Glu vWF was 76.4% and 98.8% of the wild types in the supernatant and cell lysate, respectively. The polymer pattern of extracellular pSVAla737Glu vWF was indistinguishable from that of the wild type, containing all kinds of molecular weight. Increased vWF antigen levels was observed in the patients after DDAVP treatment. Conclusion This mutant did not change the assembly and secretion of vWF. The mutant of vWF Ala737→Glu resulted in Group Ⅱ type 2A vWD.
, 百拇医药
【Key words】 von Willebrand factor; Mutation; Site direct mutagenesis; Gene expression
血管性血友病因子(vWF)在初期止血过程中起重要作用,它与血管内皮下基质及胶原相结合,同时与血小板上的受体GpⅠb、GpⅡb/Ⅲa相结合,导致血小板的粘附和聚集。在vWF上有与胶原、GpⅠb、GpⅡb/Ⅲa等结合的特定结构域。vWF功能存在着精细的调控,其蛋白不同区域的氨基酸置换会导致不同类型的血管性血友病。vWF Ala737Glu是一新的基因突变[1],为进一步了解Ala737Glu氨基酸改变对vWF功能的影响,我们构建了Ala737Glu vWF的突变体,在COS-7细胞中进行了表达,对其抗原表达量和蛋白质特性进行了研究。
材料和方法
1 聚合酶链反应(PCR)产物的克隆和测序 以含vWF全长cDNA的野生型表达质粒pSVvWF(Sadler JE教授惠赠)为模板。
, 百拇医药
引物:
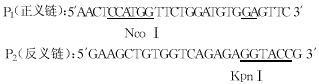
扩增含有突变体的PCR产物。PCR反应体系为50μl,包括200μmol/L dNTPs,10mmol/L Tris-HCl,50mmol/L KCl, 1.5mmol/L MgCl2,正反向引物各20pmol,DNA模板50ng,Taq DNA聚合酶1.5U。退火温度60℃,35个循环,以20g/L的琼脂糖凝胶电泳检查PCR产物。
PCR产物通过补平、磷酸化、纯化后与SmaⅠ酶切的载体pUC18相连接、转化后,提取质粒用BamHⅠ,HindⅢ双酶切进行克隆鉴定,克隆的全长PCR产物用双脱氧末端终止法进行序列测定。
2 利用突变基因最近的酶切位点NcoⅠ和KpnⅠ把带有突变体的片段克隆进表达载体,操作过程中为了避免重复的酶切位点,采取了一系列的中间载体的置换,最终获得含Ala737Glu突变体的全长vWF表达质粒pSVAla737Glu vWF。
, 百拇医药
3 pSVvWF和pSVAla737Glu vWF的转染和表达 处于对数生长期的COS-7细胞,以2×105个细胞接种在直径为35mm的组织培养皿上,用DMEM完全培养液,于37℃含CO2的培养箱中培养12~16h,使细胞达50%~80%的融合。用无血清培养基和Opti-MEM培养基洗涤待转染的细胞,Opti-MEM培养基孵育30min备用。每份转染细胞用100μl Opti-MEM培养基稀释lipofectamine(购自GIBCO/BRL公司)10μl和已纯化的质粒2μg室温孵育30min。脂质体和DNA的混合物加0.9ml的Opti-MEM培养基打匀滴加在待转染的细胞上,于37℃含CO2的培养箱中培养5h,弃转染混合物,每皿加完全培养基2ml,48h后收获上清,收获的上清中加40μl的混合蛋白酶抑制剂。培养的细胞用PBS洗涤2次,用细胞裂解液2ml(150mmol/L NaCl,50mmol/L Tris-HCl,pH 7.5, 5g/L SDS,10g/L NP40,5mmol/L EDTA, 2mmol/L 碘乙酸,2mmol/L N-乙基顺丁烯二酰亚胺和2mmol/L PMSF)进行细胞裂解。
, 百拇医药
4 转染的内对照 pSVβ-Gal质粒以同上方法进行转染,与完全培养基孵育48h后弃上清,PBS洗涤细胞3次,用Promega公司提供的方法进行染色,显微镜下观察转染效率。
5 ELISA法检测 野生型和突变体转染COS-7细胞的表达上清和细胞裂解液,参照文献[2]进行vWF∶Ag检测。
6 表达上清的多聚物分析 COS-7细胞的表达上清经过超滤后以ELISA法定量,每孔含vWF∶Ag 30ng进行血浆多聚物分析。
7 血小板多聚物分析 参照文献[3]取先证者的父亲静脉血5ml,用EDTA抗凝,800r/min离心5min,分离富含血小板的血浆(PRP),PRP与等量的溶液Ⅰ(0.013mol/L柠檬酸、0.028mol/L 葡萄糖、0.123mol/L NaCl,0.005mol/L EDTA-Na2,0.001mol/L亮抑制肽,pH 6.5)混合,2000r/min离心20min,弃上清用溶液Ⅰ洗涤2次,然后将血小板重悬在溶液Ⅱ(0.01mol/L Tris, 0.14mol/L NaCl,0.005mol/L EDTA-Na2,0.001mol/L 亮抑制肽)-70℃冻融5次。最后1次融化以10000r/min离心5min,上清以15g/L的SDS-琼脂糖凝胶进行电泳。
, 百拇医药
8 DDAVP(糜凝)的治疗 患者用药前检测vWF∶Ag的含量,按0.3μg/kg的用量,生理盐水稀释后静脉注射,30min推注完毕。在30min和1h再次检测vWF∶Ag的含量,比较用药前后的变化。
结果
1 pSVAla737Glu vWF突变体的构建 全长vWF的cDNA用EcoRⅤ和HindⅢ酶切置换到pET20b,获得中间载体pET20b vWF1。然后,利用pET20bvWF1中的单一酶切位点BamHⅠ和KpnⅠ,使获得的片段置换进pUC18,获得中间载体pUC18F2。引物P1和P2扩增含有NcoⅠ,KpnⅠ和4499位核苷酸C→A突变的256bp的PCR产物F3′,以平端克隆进pUC18,测序结果表明,PCR产物除4499位核苷酸存在C→A突变外,其余序列与野生型相同。
测序正确的PCR产物F3′通过NcoⅠ,KpnⅠ位点,替换pUC18F2中的F3′,获得pUC18F2′,再经过中间载体pET20bvWF1′,最后获得带有突变体的表达质粒pSVAla737Glu vWF。最终表达质粒酶切鉴定结果见图1。
 图1 pSVvWF和pSVAla737Glu vWF的酶切鉴定
图1 pSVvWF和pSVAla737Glu vWF的酶切鉴定, 百拇医药
2 β-Gal转染效率的观察 β-Gal基因与pSVvWF共转染COS-7细胞,经X-gal染色呈蓝色,计算转染效率为38.6%。
3 ELISA法检测vWF∶Ag表达水平 pSVvWF的表达上清vWF∶Ag的平均含量为170μg/L, pSVAla737GluvWF表达上清vWF∶Ag的平均含量为129.9μg/L,突变体的表达上清vWF∶Ag的含量是野生型的76.4%。突变体细胞裂解液中的vWF∶Ag表达量是野生型的98.8%,两者差异无显著性。
4 浓缩后的表达 以上清vWF∶Ag各30μg进行多聚物分析,表达上清中所形成的多聚物存在大中分子量的卫星条带,野生型和突变体的差异无显著性(见图2)。
5 血小板中多聚体分析 患者血小板裂解液中存在大中分子量的多聚物,与突变体在体外COS-7细胞中的表达一致(见图3)。

, 百拇医药
1:转染pSVvWF质粒的细胞表达上清;2:转染pSVAla737Glu vWF质粒的细胞表达上清;3:2A型vWD患者血浆
图2 表达上清的多聚物分析

图3 Ala 737GluvWF患者和正常人血小板vWF多聚物分析
6 DDAVP治疗前,患者vWF∶Ag含量为10.37%,按0.3μg/kg的用量,30min后检测vWF∶Ag含量为178.45%,1h后再次检测vWF∶Ag的含量为176.12%。用药后30min vWF∶Ag的含量是用药前的17.2倍。
讨论
2A型vWD基因的点突变是2A型vWD的主要病因,其基因突变主要丛集在28号外显子的3′端,vWF的A2功能域。该区域包括842Tyr和843Met的水解位点。2A型vWD存在高度的异质性,迄今已发现超过20种的基因突变(http://mmg2.im.med.umich.edu/vWF)。其中Arg834Trp的突变最常见,占已发现突变的1/3。对已发现的基因突变,有10种进行了体外定点诱变和表达[4,5]。vWD的分子病理机制至少分为两个亚型。Ⅰ类包括G742R、S743L、L777P、V844D,该类突变影响了多聚物的形成和运输,vWF储存在内质网中,体外表达证明,表达上清中vWF∶Ag含量明显减少,细胞裂解液中vWF∶Ag含量明显增加,表达上清中无大中分子量的多聚物。Ⅱ类包括R834W、R834Q 、G742E、 L865I、 E875K ,vWF∶Ag的表达量和多聚物的形态与野生型vWF差异无显著性,突变导致vWF空间构型的改变,对血浆蛋白酶异常敏感,使分泌和转运正常的vWF在血浆中被降解,大中分子量的多聚物消失。
, http://www.100md.com
我们对vWF737位氨基酸,谷氨酸→丙氨酸的突变进行了体外定点诱变和表达。用PCR方法扩增了突变位点最近的两个酶切位点NcoⅠ和KpnⅠ之间的全部序列,通过PCR方法带入C→A突变,对扩增的PCR全长序列进行了测序,除突变位点外其余序列都与野生型的序列相同。通过酶切置换最终获得了带有单个核苷酸改变的表达质粒pSVAla 737Glu vWF。同时,采用了带有SV40强启动子的真核表达载体pSV7D,野生型表达质粒pSVvWF含有vWF基因全长的cDNA,是研究vWD体外表达的最常用的表达质粒之一[6],适合在COS-7细胞中进行表达。COS-7真核细胞表达系统具有高表达效率,在转染48h后可获得分泌型蛋白质可供研究,同时对翻译后的蛋白进行加工,更能模拟体内蛋白质的合成。
vWF合成后在内质网中形成二聚体后,转运至高尔基体进一步加工形成多聚物,多聚物的相对分子质量达(5×105)~(10×106),vWF多聚物合成后储存在血小板的α颗粒和内皮细胞的Weibel-Plalade小体中,血小板中的多聚物反映了vWF合成、装配和运输的全过程,患者血小板中存在vWF多聚物的所有形态,与突变体的表达上清中多聚物的结构相同。说明基因的突变没有影响vWF合成、装配和运输,患者血浆中缺乏大中分子量的多聚物,推测结构异常的vWF对血浆中的某种蛋白酶异常敏感,导致大中分子量的降解。vWF基因C→A的突变致Ala737Glu的替换,其分子致病类型属于Ⅱ类亚型。目前,已有证据直接证明R834Q突变体的vWF对血浆中的金属蛋白酶异常敏感,表达上清中大中分子量的多聚物被降解的过程[7]。
, http://www.100md.com
患者用糜凝治疗后,vWF∶Ag的含量较治疗前升高17.2倍,与其他Ⅱ类患者对糜凝的反应相似。通过对血小板多聚物的分析对2A型vWD进行再分类,可指导临床用药,值得进一步研究。
基金项目:国家自然科学基金资助项目(39670331)
参考文献
1,王迎春,张敬宇,万海英,等. 2A型血管性血友病vWF基因Ala737(GCG)→Glu(GAG)的突变. 中华血液学杂志,1999,20:117-119.
2,奚晓东,阮长耿,李佩霞,等. 抗血管性假血友病因子单克隆抗体ELISA的建立及其临床应用. 中华医学检验杂志,1988,11:272-275.
3,Ruggeri ZM,Zimmerman TS. The complex multimeric composition of factor Ⅷ/von Willebrand factor. Blood,1981,57:1140-1143.
, 百拇医药
4,Ginsburg D, Bowie EJW. Molecular genetics of von Willebrand disease. Blood ,1992,79:2507-2519.
5,Lyons SE, Baruck ME, Bowie EJW, et al. Impaired intercellular transport produced by a subset of type Ⅱ A von Willebrand disease mutations. J Biol Chem, 1992,267:4424-4430.
6,Englender T, Lattuada A, Mannucci PM,et al. Analysis of Arg834 Gln and Val902Glu type 2A von Willebrand disease mutations:studies with recombinant von Willebrand factor and correlation with patient characteristics.Blood,1996,87: 2788-2794.
7,Tsai HM, Sussman II, Ginsburg D, et al. Proteolytic cleavage of recombinant type 2A von Willebrand factor mutants R834W and R834Q:inhibition by doxycline and by monoclonal antibody VP-1.Blood,1997,89:1954-1962.
(收稿日期:1999-08-16), 百拇医药