登革2型病毒NGC株E基因在NIH3T3细胞中的表达及初步鉴定
http://www.100md.com
37c医学网
作者:洪帮兴 江丽芳 张欣 曹艳英 郭辉玉 张世英
单位:洪帮兴 张世英(518033 深圳市福田卫生防疫站);江丽芳 张欣 郭辉玉(中山医科大学微生物学教研室);曹艳英(暨南大学组织和器官移植研究中心)
关键词:登革病毒;E基因;载体;真核表达
中华微生物学和免疫学杂志000533 【 摘要 】 目的 构建登革2型病毒E基因的真核表达载体,实现登革病毒E蛋白的真核表达。 方法 采用逆转录-多聚酶链反应(RT-PCR)扩增登革2型病毒(NGC株)包膜糖蛋白E基因全长片段,克隆入真核表达载体pcDNA3的Pcmv启动子下游,构建重组真核表达质粒pcDNA3-E,用脂质体转染法转染NIH3T3细胞,表达产物以免疫荧光、SDS-PAGE和蛋白质印迹进行分析检测。 结果 成功构建了重组真核表达质粒pcDNA3-E,通过脂质体转染法导入NIH3T3细胞,免疫荧光、SDS-PAGE和蛋白质印迹分析检测表明,E基因在NIH3T3细胞实现了真核表达,产物相对分子质量(Mr)为60×103。 结论 登革病毒E基因真核表达载体的构建及E基因的真核表达为研究登革病毒E蛋白的结构与功能、研制登革病毒诊断试剂及核酸疫苗奠定了基础。
, 百拇医药
The expression of E gene region of Dengue 2 virus in NIH3T3 and its identification
HONG Bangxing, JIANG Lifang, ZHANG Xin, et al.
(Department of Microbiology, Sun Yat-Sen University of Medical Sciences, Guangzhou 510060, P. R. China)
【 Abstract 】 Objective Construction of an eukaryotic expression plasmid of E gene fragment from Dengue 2 virus and eukaryotic expression of E glycosylated protein. Methods The E gene fragment of Dengue 2 virus NGC strain was amplified by RT-PCR and this fragment was cloned into eukaryotic expression vector pcDNA3. The recombinant plasmid pcDNA3-E was thus constructed and identified by sequencing and digestion with restriction enzymes. The recombinant plasmid pcDNA3-E was transfected into NIH3T3 cell by lipofectin. The expressed protein was analyzed by immunofluorescence, SDS-PAGE and Western blotting assay. Results A recombinant eukaryotic expression plasmid pcDNA3-E was successfully constructed. The recombinant plasmid expressed a 60×103 protein of Dengue 2 virus. Conclusions The constructions of eukaryotic expression of E gene fragment from Dengue 2 virus and eukaryotic expression of E glycosylated protein will be helpful to study the structure and functions of the E protein, and to the development of Dengue diagnostic agents as well as Dengue virus nucleic acid vaccine.
, 百拇医药
【 Subject words 】 Dengue virus; E gene; Vector; Eukaryotic expression
登革病毒E基因编码登革病毒最大的结构蛋白——包膜糖蛋白E,相对分子质量(Mr)为(51~60)×103,E蛋白在登革病毒的致病机理(ADE作用〔1〕)及诱发机体的抗感染免疫中发挥重要的作用。于曼、秦鄂德等〔2〕对我国登革2型病毒43株E蛋白的原核表达做了研究。Sugrue等〔3〕在酵母表达系统中表达了不同长度的登革1型病毒E蛋白片段。由于E蛋白是糖蛋白,原核表达对E蛋白的免疫原性及活性有一定程度的影响。本研究将登革2型病毒(NGC株)E基因导入真核表达载体pcDNA3,构建了真核表达质粒pcDNA3-E,并实现了E蛋白在NIH3T3细胞中的表达。
材料和方法
, 百拇医药
工程菌和载体:大肠杆菌E.coli DH5α,真核表达载体pcDNA3(5.4kb,含Pcmv和T7噬菌体启动子)由本室保存。
病毒和细胞:登革2型病毒NGC株、白纹伊蚊C6/36细胞和小鼠成纤维细胞NIH3T3细胞由本室冻存。
试剂:AMV逆转录酶、Taq酶和其它工具酶购自Promega公司;化学试剂均为国产分析纯;登革2型病毒小鼠多克隆腹水、兔抗登革2型病毒多克隆抗体由本室郭辉玉教授提供;FITC-羊抗鼠IgG购自军事医学科学院微生物流行病研究所;HRP-羊抗兔IgG为Sigma公司产品。
引物的设计与合成:根据登革2型病毒基因序列〔4〕和PCR引物设计原则,设计并合成2条引物:E上游:5′GC GGTACC CA ATG ACA ATG CG3′(含KpnⅠ识别序列GGTACC和ATG起始密码);E下游:5′GC TCTAGA ACT TTA GGC CTG CAC CAT AAC3′(含XbaⅠ识别序列TCTAGA和TAA终止密码)。
, 百拇医药
登革2型病毒全长E基因的RT-PCR扩增:以10-2病毒滴度感染24h前新鲜传代的C6/36细胞,当细胞病变达+++~++++时收获3ml病毒培养上清,用异硫氰酸胍沉淀法〔5〕提取其核酸作为逆转录模板,逆转录反应应用Promega公司的逆转录试剂盒(方法详见说明书)。PCR反应条件为94℃ 30s, 55℃ 40s, 72℃ 90s, 25个循环后,72℃延伸10min。
重组表达质粒的构建:用限制性内切酶KpnⅠ/XbaⅠ消化PCR纯化产物,从琼脂糖凝胶中以挖块回收法〔6〕回收E基因酶切产物,与经KpnⅠ/XbaⅠ酶切的线性质粒pcDNA3连接,转化大肠杆菌E. coli DH5α,阳性重组子的筛选、酶切鉴定均按文献〔7〕操作。
核苷酸序列测定:小量提取的重组质粒pcDNA3-E经碱变性后,直接用T7 promoter引物和SP6 promoter引物对E基因片段的5′端和3′端进行序列测定,采用双脱氧末端终止法,用α-32P-dATP标记。
, 百拇医药
转染质粒及转染细胞的准备:取大量提取的重组质粒pcDNA3-E溶于灭菌双蒸水100μl,用Tris*Cl饱和酚、氯仿/异戊醇(24∶1)抽提后经3mol/L NaAc(pH5.2)和无水乙醇沉淀,真空抽干,备用。NIH3T3细胞用含1%谷氨酰胺、0.45% NaHCO3 和10%胎牛血清的DMEM培养液培养于35mm的培养皿中,37℃培养24h至细胞密度达50%~80%的融合。
细胞转染:取重组质粒2μg溶于100μl无血清DMEM液,10μl脂质体稀释于90μl无血清DMEM液。将上述两液轻轻混合,室温放置25min。弃去细胞培养皿中的培养液,将上述混合液滴加至细胞表面,37℃孵育12h。弃去转染液,加入含10%胎牛血清的DMEM培养液,37℃培养3d后,更换含600μg/ml G418的DMEM培养液筛选,3d后将G418浓度降至250μg/ml以维持筛选作用,直至转染细胞克隆的形成,并对克隆细胞株进行扩增培养。
免疫荧光抗体法检测表达蛋白:将扩增培养的克隆细胞转入(35×10)mm的细胞培养皿,待细胞长满后用PBS洗3次,用丙酮固定3min,PBS洗3次,依次滴加登革2型病毒小鼠多克隆腹水(效价1∶300)及FITC-羊抗鼠IgG(效价1∶1000),分别于37℃孵育30min并且用PBS洗去未结合的抗体,用免疫荧光显微镜观察照相。
, 百拇医药
SDS-PAGE检测表达蛋白:分别取适量扩增培养的克隆细胞及未转染的NIH3T3细胞,用冰预冷的细胞裂解液裂解后离心取沉淀,加入等量2×SDS加样缓冲液[100mmol/L Tris*Cl(pH8.0),10% 2-巯基乙醇,4% SDS,0.2%溴酚蓝,20%甘油],煮沸5min,加样进行SDS-PAGE,分离胶浓度为12%(pH8.8),用含0.25%考马斯亮蓝R-250的甲醇-乙酸溶液(10%乙酸,50%甲醇,40%水)染色4h,甲醇-乙酸溶液脱色,观察结果并照相保存。
蛋白质印迹试验(Western blotting):经SDS-PAGE分离细胞蛋白,电转移(0.19A,40V,4h)至硝酸纤维膜上,用封闭液(1%去脂奶粉,0.01% antifoam A,0.02%叠氮钠,溶于PBS中)室温封闭2h,以兔抗登革2型病毒多克隆抗体为第一抗体,HRP-羊抗兔IgG为第二抗体,分别在室温作用2h,用DAB显色。
结果
, 百拇医药
1.PCR扩增产物的鉴定:取PCR产物在1%琼脂糖凝胶上以λDNA/EcoRⅠ+HindⅢ为相对分子质量(Mr)标准进行电泳,结果扩增出约1.5kb的片段(图1)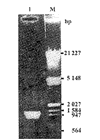
图1 登革病毒2型(NGC株)E基因片段的RT-PCR扩增
Fig 1. The results of RT-PCR for E gene fragment of DV2
M: λDNA/EcoRⅠ+HindⅢ; 1: E gene fragment of DV2 by RT-PCR
2.重组表达质粒的构建和酶切鉴定:目的基因和载体片段经酶切、连接、转化大肠杆菌E.coli DH5α后,挑取白色菌落,小量提取质粒。各取1μg提取的质粒,分别用BamHⅠ/XbaⅠ双酶切及BamHⅠ单酶切2h,1%琼脂糖凝胶电泳分析提取的质粒及酶切产物。重组质粒pcDNA3-E经BamHⅠ/XbaⅠ双酶切得到3个片段:220bp,507bp和6315bp;经BamHⅠ单酶切得到2个片段:507bp和6365bp(图2)。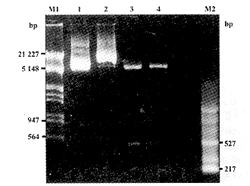
, 百拇医药
图2 pcDNA3-E重组质粒的酶切鉴定
Fig 2. The identification of pcDNA3-E recombinant by digesting using restriction enzymes
M1: λDNA/EcoRⅠ+HindⅢ; M2: pBR322DNA/MSPI; 1: pcDNA3; 2: pcDNA3-E; 3: pcDNA3-E digested by BamHⅠ/XbaⅠ; 4: pcDNA3-E digested by BamHⅠ
3.核苷酸序列测定结果:测序反应使用Phamacia公司测序仪,8%聚丙烯酰胺凝胶(含40%尿素)电泳,放射自显影结果显示,pcDNA3-E重组质粒上E基因片段的5′端和3′端序列与已发表的登革2型病毒(NGC株)基因序列一致。
4.重组表达质粒的转染和筛选:利用脂质体转染法将重组质粒导入NIH3T3细胞,经G418筛选20d后,在细胞培养皿中长出稳定的转化细胞克隆。
, 百拇医药
5.免疫荧光抗体法检测表达蛋白:G418筛选出的克隆细胞株在含10%胎牛血清的DMEM培养液中,37℃ 条件下扩增培养,用登革2型病毒小鼠多克隆腹水和FITC标记的羊抗鼠IgG对克隆细胞做间接免疫荧光染色,在转染细胞的细胞膜上观察到均匀分布的荧光(图3),而NIH3T3细胞对照组则无。
6.SDS-PAGE分析:对扩增培养的克隆细胞株用细胞裂解液裂解后提取蛋白进行SDS-PAGE,结果表明,pcDNA3转染的NIH3T3细胞及未转染NIH3T3细胞在Mr为60×103处未见明显的蛋白条带,而pcDNA3-E转染的NIH3T3细胞在60×103处可见一明显的蛋白条带(图4),其Mr与预计相符,表明E蛋白在NIH3T3细胞中实现了表达。
7.Western blotting检测:SDS-PAGE分离细胞蛋白,电转移至硝酸纤维膜上,经兔抗登革2型病毒多克隆抗体检测,pcDNA3转染的NIH3T3细胞及未转染的NIH3T3细胞未见反应显色带,而经pcDNA3-E转染的NIH3T3细胞在Mr为60×103处显现单一特异性条带(图4),表明为E基因表达产物。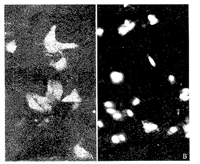
, http://www.100md.com
图3 免疫荧光抗体法检测pcDNA3-E转染NIH3T3细胞表达的E蛋白
Fig 3. Immunofluorescence detection of E protein expressed in NIH3T3 cells transfected by pcDNA3-E plasmid
A: Transfection of pcDNA3-E plasmid; B: Transfection of pcDNA3 plasmid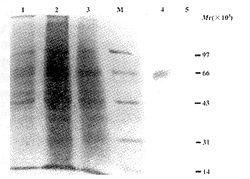
图4 SDS-PAGE和Western blotting检测表达蛋白
Fig 4. Detection of expression protein by SDS-PAGE and Western blotting
, 百拇医药
M: Protein marker; 1: NIH3T3 cells; 2: NIH3T3 cells transfected by pcDNA3-E plasmid; 3: NIH3T3 cells transfected by pcDNA3 plasmid; 4: Western blotting of NIH3T3 cells transfected by pcDNA3-E plasmid; 5: Western blotting of NIH3T3 cells transfected by pcDNA3 plasmid
讨论
登革病毒包膜糖蛋白E结构与功能的研究,一直是登革病毒研究中的热点。E蛋白含有病毒血凝素和中和抗原决定簇,E蛋白还是某些宿主细胞表面受体的配体,它还可能是一种膜融合蛋白,可诱导毒粒包膜与细胞膜融合,促使病毒进入细胞而引起感染。Megret等〔8〕通过合成肽结合的方法分析E蛋白上可能存在的不同抗原表位,发现非中和抗体,其对应的表位呈线性,有群和亚群特异性,而中和作用的抗体对应的表位,其功能的发挥有赖于二硫键的完整,提示不连续的抗原功能区的存在是E蛋白诱导机体产生中和抗体和保护性抗体所必须的。最近,Lin等〔9〕对登革2型病毒E蛋白上的中和抗原表位定位研究中则发现,半胱氨酸残基11和12的突变决定了抗原表位是否对SDS敏感。Kochel等〔10〕构建了登革2型病毒核酸疫苗,把prM基因和92%E基因克隆入不同的表达载体(PKCMV和PVR102),在动物体内取得了很好的免疫效果。表达天然构象的活性E蛋白对登革病毒诊断抗原及登革疫苗的研制都有重要的意义。
, 百拇医药
目的基因的表达有原核表达和真核表达两种,原核表达操作简单,表达量高,但缺乏真核基因表达所必须的表达调控系统,如内含子的切除和基因修饰(如糖基化等),真核表达系统的优点是具有真核基因表达的调控系统,能表达出具有天然构象和活性的蛋白。真核表达载体pcDNA3是一种高效表达系统,含有巨细胞病毒早期即刻启动子(Pcmv)和T7 、SP6启动子,能在HeLa、COS7和NIH3T3等多种哺乳动物表达细胞中复制、转录和表达。本研究将登革病毒E基因克隆入该载体,在NIH3T3细胞中表达时可对表达蛋白进行糖基化及二硫键的修饰,免疫荧光抗体法、SDS-PAGE及蛋白质印迹试验均初步证明了E蛋白的真核表达,为进一步分析表达蛋白的活性、功能及核酸疫苗的研制奠定了基础;本研究表达的登革病毒E蛋白,其抗原性如何、表达产量的高低等问题,有待进一步的分离纯化及进行免疫动物方面的研究以探索其实际应用价值。
洪帮兴 中山医科大学硕士生
参考文献
, 百拇医药
1,Halsted SB, Larshen K, Porterfield JS. Comparison of P388D1 mouse macrophage cell line and human monocytes for assay of dengue-2 infection-enhancing antibodies. AM J Trop Med Hyg, 1983, 32(1):157-163.
2,于曼,秦鄂德,杨佩英,等. 我国登革2型病毒E基因的克隆和表达研究. 中华微生物学和免疫学杂志, 1996, 16(2):125-129.
3,Sugrue RJ, Cui T, Xu Q. The production of recombinant dengue virus E protein using Escherichia coli and Pichia pastoris. J Virol Meth, 1997, 69(1-2):159-169.
, http://www.100md.com
4,Irie K, Mohan PM, Sasaguri Y. Sequence analysis of cloned dengue virus type 2 genome (New Guinea C strain). Gene, 1989, 75:197-211.
5,林万明,主编. 医学微生物学进展. 北京:中国科学技术出版社, 1991, 599-600.
6,卢圣栋,主编. 现代分子生物学实验技术. 北京:高等教育出版社,1993,131.
7,姜泊,主编. 分子生物学常用实验方法. 北京:人民军医出版社,1996,2-22.
8,Megret F, Hugnnot P, Deubel V. Use of recombinant fusion proteins and monoclonal antibodies to define linear and discontinuous antigenic sites on dengue virus envelope glycoprotein. Virology, 1992, 187:480-491.
, 百拇医药
9,Lin B, Parrish R, Wright PJ. Location of a neutralizing epitope on the envelope protein of dengue virus type 2. Virology, 1994, 202:885-890.
10,Kochel T, Wu SJ, Raviprakash K. Inoculation of plasmids expressing the dengue 2 envelope gene elicit neutralizing antibodies in mice. Vaccine, 1997, 15(5):547-552.
(收稿日期:1999-07-19), 百拇医药
单位:洪帮兴 张世英(518033 深圳市福田卫生防疫站);江丽芳 张欣 郭辉玉(中山医科大学微生物学教研室);曹艳英(暨南大学组织和器官移植研究中心)
关键词:登革病毒;E基因;载体;真核表达
中华微生物学和免疫学杂志000533 【 摘要 】 目的 构建登革2型病毒E基因的真核表达载体,实现登革病毒E蛋白的真核表达。 方法 采用逆转录-多聚酶链反应(RT-PCR)扩增登革2型病毒(NGC株)包膜糖蛋白E基因全长片段,克隆入真核表达载体pcDNA3的Pcmv启动子下游,构建重组真核表达质粒pcDNA3-E,用脂质体转染法转染NIH3T3细胞,表达产物以免疫荧光、SDS-PAGE和蛋白质印迹进行分析检测。 结果 成功构建了重组真核表达质粒pcDNA3-E,通过脂质体转染法导入NIH3T3细胞,免疫荧光、SDS-PAGE和蛋白质印迹分析检测表明,E基因在NIH3T3细胞实现了真核表达,产物相对分子质量(Mr)为60×103。 结论 登革病毒E基因真核表达载体的构建及E基因的真核表达为研究登革病毒E蛋白的结构与功能、研制登革病毒诊断试剂及核酸疫苗奠定了基础。
, 百拇医药
The expression of E gene region of Dengue 2 virus in NIH3T3 and its identification
HONG Bangxing, JIANG Lifang, ZHANG Xin, et al.
(Department of Microbiology, Sun Yat-Sen University of Medical Sciences, Guangzhou 510060, P. R. China)
【 Abstract 】 Objective Construction of an eukaryotic expression plasmid of E gene fragment from Dengue 2 virus and eukaryotic expression of E glycosylated protein. Methods The E gene fragment of Dengue 2 virus NGC strain was amplified by RT-PCR and this fragment was cloned into eukaryotic expression vector pcDNA3. The recombinant plasmid pcDNA3-E was thus constructed and identified by sequencing and digestion with restriction enzymes. The recombinant plasmid pcDNA3-E was transfected into NIH3T3 cell by lipofectin. The expressed protein was analyzed by immunofluorescence, SDS-PAGE and Western blotting assay. Results A recombinant eukaryotic expression plasmid pcDNA3-E was successfully constructed. The recombinant plasmid expressed a 60×103 protein of Dengue 2 virus. Conclusions The constructions of eukaryotic expression of E gene fragment from Dengue 2 virus and eukaryotic expression of E glycosylated protein will be helpful to study the structure and functions of the E protein, and to the development of Dengue diagnostic agents as well as Dengue virus nucleic acid vaccine.
, 百拇医药
【 Subject words 】 Dengue virus; E gene; Vector; Eukaryotic expression
登革病毒E基因编码登革病毒最大的结构蛋白——包膜糖蛋白E,相对分子质量(Mr)为(51~60)×103,E蛋白在登革病毒的致病机理(ADE作用〔1〕)及诱发机体的抗感染免疫中发挥重要的作用。于曼、秦鄂德等〔2〕对我国登革2型病毒43株E蛋白的原核表达做了研究。Sugrue等〔3〕在酵母表达系统中表达了不同长度的登革1型病毒E蛋白片段。由于E蛋白是糖蛋白,原核表达对E蛋白的免疫原性及活性有一定程度的影响。本研究将登革2型病毒(NGC株)E基因导入真核表达载体pcDNA3,构建了真核表达质粒pcDNA3-E,并实现了E蛋白在NIH3T3细胞中的表达。
材料和方法
, 百拇医药
工程菌和载体:大肠杆菌E.coli DH5α,真核表达载体pcDNA3(5.4kb,含Pcmv和T7噬菌体启动子)由本室保存。
病毒和细胞:登革2型病毒NGC株、白纹伊蚊C6/36细胞和小鼠成纤维细胞NIH3T3细胞由本室冻存。
试剂:AMV逆转录酶、Taq酶和其它工具酶购自Promega公司;化学试剂均为国产分析纯;登革2型病毒小鼠多克隆腹水、兔抗登革2型病毒多克隆抗体由本室郭辉玉教授提供;FITC-羊抗鼠IgG购自军事医学科学院微生物流行病研究所;HRP-羊抗兔IgG为Sigma公司产品。
引物的设计与合成:根据登革2型病毒基因序列〔4〕和PCR引物设计原则,设计并合成2条引物:E上游:5′GC GGTACC CA ATG ACA ATG CG3′(含KpnⅠ识别序列GGTACC和ATG起始密码);E下游:5′GC TCTAGA ACT TTA GGC CTG CAC CAT AAC3′(含XbaⅠ识别序列TCTAGA和TAA终止密码)。
, 百拇医药
登革2型病毒全长E基因的RT-PCR扩增:以10-2病毒滴度感染24h前新鲜传代的C6/36细胞,当细胞病变达+++~++++时收获3ml病毒培养上清,用异硫氰酸胍沉淀法〔5〕提取其核酸作为逆转录模板,逆转录反应应用Promega公司的逆转录试剂盒(方法详见说明书)。PCR反应条件为94℃ 30s, 55℃ 40s, 72℃ 90s, 25个循环后,72℃延伸10min。
重组表达质粒的构建:用限制性内切酶KpnⅠ/XbaⅠ消化PCR纯化产物,从琼脂糖凝胶中以挖块回收法〔6〕回收E基因酶切产物,与经KpnⅠ/XbaⅠ酶切的线性质粒pcDNA3连接,转化大肠杆菌E. coli DH5α,阳性重组子的筛选、酶切鉴定均按文献〔7〕操作。
核苷酸序列测定:小量提取的重组质粒pcDNA3-E经碱变性后,直接用T7 promoter引物和SP6 promoter引物对E基因片段的5′端和3′端进行序列测定,采用双脱氧末端终止法,用α-32P-dATP标记。
, 百拇医药
转染质粒及转染细胞的准备:取大量提取的重组质粒pcDNA3-E溶于灭菌双蒸水100μl,用Tris*Cl饱和酚、氯仿/异戊醇(24∶1)抽提后经3mol/L NaAc(pH5.2)和无水乙醇沉淀,真空抽干,备用。NIH3T3细胞用含1%谷氨酰胺、0.45% NaHCO3 和10%胎牛血清的DMEM培养液培养于35mm的培养皿中,37℃培养24h至细胞密度达50%~80%的融合。
细胞转染:取重组质粒2μg溶于100μl无血清DMEM液,10μl脂质体稀释于90μl无血清DMEM液。将上述两液轻轻混合,室温放置25min。弃去细胞培养皿中的培养液,将上述混合液滴加至细胞表面,37℃孵育12h。弃去转染液,加入含10%胎牛血清的DMEM培养液,37℃培养3d后,更换含600μg/ml G418的DMEM培养液筛选,3d后将G418浓度降至250μg/ml以维持筛选作用,直至转染细胞克隆的形成,并对克隆细胞株进行扩增培养。
免疫荧光抗体法检测表达蛋白:将扩增培养的克隆细胞转入(35×10)mm的细胞培养皿,待细胞长满后用PBS洗3次,用丙酮固定3min,PBS洗3次,依次滴加登革2型病毒小鼠多克隆腹水(效价1∶300)及FITC-羊抗鼠IgG(效价1∶1000),分别于37℃孵育30min并且用PBS洗去未结合的抗体,用免疫荧光显微镜观察照相。
, 百拇医药
SDS-PAGE检测表达蛋白:分别取适量扩增培养的克隆细胞及未转染的NIH3T3细胞,用冰预冷的细胞裂解液裂解后离心取沉淀,加入等量2×SDS加样缓冲液[100mmol/L Tris*Cl(pH8.0),10% 2-巯基乙醇,4% SDS,0.2%溴酚蓝,20%甘油],煮沸5min,加样进行SDS-PAGE,分离胶浓度为12%(pH8.8),用含0.25%考马斯亮蓝R-250的甲醇-乙酸溶液(10%乙酸,50%甲醇,40%水)染色4h,甲醇-乙酸溶液脱色,观察结果并照相保存。
蛋白质印迹试验(Western blotting):经SDS-PAGE分离细胞蛋白,电转移(0.19A,40V,4h)至硝酸纤维膜上,用封闭液(1%去脂奶粉,0.01% antifoam A,0.02%叠氮钠,溶于PBS中)室温封闭2h,以兔抗登革2型病毒多克隆抗体为第一抗体,HRP-羊抗兔IgG为第二抗体,分别在室温作用2h,用DAB显色。
结果
, 百拇医药
1.PCR扩增产物的鉴定:取PCR产物在1%琼脂糖凝胶上以λDNA/EcoRⅠ+HindⅢ为相对分子质量(Mr)标准进行电泳,结果扩增出约1.5kb的片段(图1)

图1 登革病毒2型(NGC株)E基因片段的RT-PCR扩增
Fig 1. The results of RT-PCR for E gene fragment of DV2
M: λDNA/EcoRⅠ+HindⅢ; 1: E gene fragment of DV2 by RT-PCR
2.重组表达质粒的构建和酶切鉴定:目的基因和载体片段经酶切、连接、转化大肠杆菌E.coli DH5α后,挑取白色菌落,小量提取质粒。各取1μg提取的质粒,分别用BamHⅠ/XbaⅠ双酶切及BamHⅠ单酶切2h,1%琼脂糖凝胶电泳分析提取的质粒及酶切产物。重组质粒pcDNA3-E经BamHⅠ/XbaⅠ双酶切得到3个片段:220bp,507bp和6315bp;经BamHⅠ单酶切得到2个片段:507bp和6365bp(图2)。

, 百拇医药
图2 pcDNA3-E重组质粒的酶切鉴定
Fig 2. The identification of pcDNA3-E recombinant by digesting using restriction enzymes
M1: λDNA/EcoRⅠ+HindⅢ; M2: pBR322DNA/MSPI; 1: pcDNA3; 2: pcDNA3-E; 3: pcDNA3-E digested by BamHⅠ/XbaⅠ; 4: pcDNA3-E digested by BamHⅠ
3.核苷酸序列测定结果:测序反应使用Phamacia公司测序仪,8%聚丙烯酰胺凝胶(含40%尿素)电泳,放射自显影结果显示,pcDNA3-E重组质粒上E基因片段的5′端和3′端序列与已发表的登革2型病毒(NGC株)基因序列一致。
4.重组表达质粒的转染和筛选:利用脂质体转染法将重组质粒导入NIH3T3细胞,经G418筛选20d后,在细胞培养皿中长出稳定的转化细胞克隆。
, 百拇医药
5.免疫荧光抗体法检测表达蛋白:G418筛选出的克隆细胞株在含10%胎牛血清的DMEM培养液中,37℃ 条件下扩增培养,用登革2型病毒小鼠多克隆腹水和FITC标记的羊抗鼠IgG对克隆细胞做间接免疫荧光染色,在转染细胞的细胞膜上观察到均匀分布的荧光(图3),而NIH3T3细胞对照组则无。
6.SDS-PAGE分析:对扩增培养的克隆细胞株用细胞裂解液裂解后提取蛋白进行SDS-PAGE,结果表明,pcDNA3转染的NIH3T3细胞及未转染NIH3T3细胞在Mr为60×103处未见明显的蛋白条带,而pcDNA3-E转染的NIH3T3细胞在60×103处可见一明显的蛋白条带(图4),其Mr与预计相符,表明E蛋白在NIH3T3细胞中实现了表达。
7.Western blotting检测:SDS-PAGE分离细胞蛋白,电转移至硝酸纤维膜上,经兔抗登革2型病毒多克隆抗体检测,pcDNA3转染的NIH3T3细胞及未转染的NIH3T3细胞未见反应显色带,而经pcDNA3-E转染的NIH3T3细胞在Mr为60×103处显现单一特异性条带(图4),表明为E基因表达产物。

, http://www.100md.com
图3 免疫荧光抗体法检测pcDNA3-E转染NIH3T3细胞表达的E蛋白
Fig 3. Immunofluorescence detection of E protein expressed in NIH3T3 cells transfected by pcDNA3-E plasmid
A: Transfection of pcDNA3-E plasmid; B: Transfection of pcDNA3 plasmid

图4 SDS-PAGE和Western blotting检测表达蛋白
Fig 4. Detection of expression protein by SDS-PAGE and Western blotting
, 百拇医药
M: Protein marker; 1: NIH3T3 cells; 2: NIH3T3 cells transfected by pcDNA3-E plasmid; 3: NIH3T3 cells transfected by pcDNA3 plasmid; 4: Western blotting of NIH3T3 cells transfected by pcDNA3-E plasmid; 5: Western blotting of NIH3T3 cells transfected by pcDNA3 plasmid
讨论
登革病毒包膜糖蛋白E结构与功能的研究,一直是登革病毒研究中的热点。E蛋白含有病毒血凝素和中和抗原决定簇,E蛋白还是某些宿主细胞表面受体的配体,它还可能是一种膜融合蛋白,可诱导毒粒包膜与细胞膜融合,促使病毒进入细胞而引起感染。Megret等〔8〕通过合成肽结合的方法分析E蛋白上可能存在的不同抗原表位,发现非中和抗体,其对应的表位呈线性,有群和亚群特异性,而中和作用的抗体对应的表位,其功能的发挥有赖于二硫键的完整,提示不连续的抗原功能区的存在是E蛋白诱导机体产生中和抗体和保护性抗体所必须的。最近,Lin等〔9〕对登革2型病毒E蛋白上的中和抗原表位定位研究中则发现,半胱氨酸残基11和12的突变决定了抗原表位是否对SDS敏感。Kochel等〔10〕构建了登革2型病毒核酸疫苗,把prM基因和92%E基因克隆入不同的表达载体(PKCMV和PVR102),在动物体内取得了很好的免疫效果。表达天然构象的活性E蛋白对登革病毒诊断抗原及登革疫苗的研制都有重要的意义。
, 百拇医药
目的基因的表达有原核表达和真核表达两种,原核表达操作简单,表达量高,但缺乏真核基因表达所必须的表达调控系统,如内含子的切除和基因修饰(如糖基化等),真核表达系统的优点是具有真核基因表达的调控系统,能表达出具有天然构象和活性的蛋白。真核表达载体pcDNA3是一种高效表达系统,含有巨细胞病毒早期即刻启动子(Pcmv)和T7 、SP6启动子,能在HeLa、COS7和NIH3T3等多种哺乳动物表达细胞中复制、转录和表达。本研究将登革病毒E基因克隆入该载体,在NIH3T3细胞中表达时可对表达蛋白进行糖基化及二硫键的修饰,免疫荧光抗体法、SDS-PAGE及蛋白质印迹试验均初步证明了E蛋白的真核表达,为进一步分析表达蛋白的活性、功能及核酸疫苗的研制奠定了基础;本研究表达的登革病毒E蛋白,其抗原性如何、表达产量的高低等问题,有待进一步的分离纯化及进行免疫动物方面的研究以探索其实际应用价值。
洪帮兴 中山医科大学硕士生
参考文献
, 百拇医药
1,Halsted SB, Larshen K, Porterfield JS. Comparison of P388D1 mouse macrophage cell line and human monocytes for assay of dengue-2 infection-enhancing antibodies. AM J Trop Med Hyg, 1983, 32(1):157-163.
2,于曼,秦鄂德,杨佩英,等. 我国登革2型病毒E基因的克隆和表达研究. 中华微生物学和免疫学杂志, 1996, 16(2):125-129.
3,Sugrue RJ, Cui T, Xu Q. The production of recombinant dengue virus E protein using Escherichia coli and Pichia pastoris. J Virol Meth, 1997, 69(1-2):159-169.
, http://www.100md.com
4,Irie K, Mohan PM, Sasaguri Y. Sequence analysis of cloned dengue virus type 2 genome (New Guinea C strain). Gene, 1989, 75:197-211.
5,林万明,主编. 医学微生物学进展. 北京:中国科学技术出版社, 1991, 599-600.
6,卢圣栋,主编. 现代分子生物学实验技术. 北京:高等教育出版社,1993,131.
7,姜泊,主编. 分子生物学常用实验方法. 北京:人民军医出版社,1996,2-22.
8,Megret F, Hugnnot P, Deubel V. Use of recombinant fusion proteins and monoclonal antibodies to define linear and discontinuous antigenic sites on dengue virus envelope glycoprotein. Virology, 1992, 187:480-491.
, 百拇医药
9,Lin B, Parrish R, Wright PJ. Location of a neutralizing epitope on the envelope protein of dengue virus type 2. Virology, 1994, 202:885-890.
10,Kochel T, Wu SJ, Raviprakash K. Inoculation of plasmids expressing the dengue 2 envelope gene elicit neutralizing antibodies in mice. Vaccine, 1997, 15(5):547-552.
(收稿日期:1999-07-19), 百拇医药