体外单核巨噬细胞诱生IFN-α的因素分析
http://www.100md.com
37c医学网
作者:孙路虹 姚 堃 季晓辉 丁如宁 李焕娣
单位:南京医科大学微生物学教研室 南京 210029
关键词:M-CSF;IFN-γ;IFN-α;NDV;单核细胞
免疫学杂志990212摘 要 观察了M-CSF预处理、IFN-γ预处理、长程培养及新城疫病毒(new-castle disease virus,NDV)刺激4个因素对正常人外周血单核细胞体外产生IFN-α水平的影响,采用生物活性法检测IFN-α。结果表明:单独使用M-CSF不能诱生IFN-α;单独使用IFN-γ或单独使用NDV均只诱生较低水平IFN-α,只有M-CSF+IFN-γ+NDV或IFN-γ+NDV联合使用方可诱生较高水平的IFN-α,并且发现Mο、-Mφ长程培养也是向高产发展的一个重要因素。结论:人血Mο、-Mφ在适当体外培养条件下,可以诱发较高水平的IFN-α。
, 百拇医药
中图号 R392
ANALYSIS OF FACTORS AFFECTED IFN-α INDUCTION BY HUMAN BLOOD MONOCYTES IN VITRO
Sun Luhong,Yao Kun,Ji Xiaohui,Ding Runing,Li Huandi
(Department of Microbiology,Nanjing Medical University,Nanjing 210029)
Abstract Mο-Mφ could hardly induce IFN-α in vitro,especially at high level.This paper reported 4 factors affected IFN-α induction from cultured Mο-Mφ.The results showed treatment singly with M-CSF couldnt induce IFN-α.Treatment with IFN-γ alone or stimulation with NDV alone could induce low level of IFN-α.Treatment with M-CSF,IFN-γ and NDV proved to be the best.The age of Mο-Mφ culture was also an important factor.
, 百拇医药
Key words M-CSF,IFN-γ,IFN-α,NDV,Monocyte
IFN-α的体外诱生通常用NDV或仙台病毒作用于B细胞,使之产生IFN-α,用Mο-Mφ(单核-巨噬细胞)诱生IFN-α是相当困难的。本文通过改变Mο-Mφ的培养条件,使之适于诱生IFN-α,观察了4种因素:M-CSF的预处理,IFN-γ的预处理,Mο-Mφ长程培养和NDV刺激对诱生IFN-α的影响。4种因素或单独使用或联合使用,出现许多不同的效应,现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞系和病毒:人羊膜WISH株按常规培养传代,用于滴定IFN-α;水泡性口炎病毒(VSV)本室低温保存,用于滴定IFN-α;NDV来自本室,用于诱生IFN-α。
, 百拇医药
1.1.2 试剂:rhM-CSF由南京大学生物系提供,比活性1.2×106CFU/mg;rhIFN-γ由上海生物制品研究所提供。
1.2 方法
1.2.1 单核细胞的分离[1]:从健康人新鲜静脉血中分离单个核细胞,以1×107/ml细胞浓度加入96孔细胞培养板,每孔200μl;置37°C 5%CO2贴壁培养2h;洗3次去非粘附细胞,贴壁的即为单核细胞,每孔约有贴壁细胞0.3×105~1×105个,经非特异性酯酶染色证实所得细胞95%以上为单核细胞。
1.2.2 IFN-α的诱生:根据参考文献[2]并予改进。诱生IFN-α共用4个可变因素,即NDV(血凝效价1∶1280)20μl/孔,M-CSF(5 000U/ml)100μl/孔,IFN-γ(1 000U/ml)100μl/孔和长程培养时间。培养条件均为37°C 5%CO2。①将含有单核细胞的培养板分别培养1,3,7,12d后,加IFN-γ、M-CSF或NDV分别培养24h,收集上清;或加IFN-γ、M-CSF分别培养24h后再加NDV培养24h,收集上清,详见表1。②在含有单核细胞的培养板孔内加入M-CSF分别预处理1,3,7,12d后,加入IFN-γ、NDV分别培养24h,收集上清;或加IFN-γ培养24h再加DNV培养24h,收集上清,详见表2。所收集培养上清,均经加热56°C 30min处理,以除去IFN-γ,移置-20°C保存,备测IFN-α。
, http://www.100md.com
1.2.3 IFN-α的检测:通过细胞病变抑制试验[3]检测IFN-α活性,以能抑制CPE(++)的最高稀释度为终点。此读数为本室检测IFN-α的工作单位,而非国际标准单位。
2 结果
表1显示:单独M-CSF刺激不产生IFN-α;单独IFN-γ或单独NDV刺激,产生较低水平IFN-α;M-CSF+NDV联合刺激产生IFN-α水平也较低;只有IFN-γ+NDV联合刺激才能产生较高水平的IFN-α。此外,随着单核细胞培养时间延长,M-CSF组、IFN-γ组、NDV组和M-CSF+NDV组诱生IFN-α水平均无明显升高趋势,而IFN-γ+NDV组诱生IFN-α水平则逐渐升高,在1,3,7,12d产生IFN-α量与其它各组比均具显著性差异(P<0.01)
表1 培养不同时间后M-CSF/IFN-γ/NDV单独或联合刺激
, 百拇医药
对单核细胞诱生IFN-α的影响(n=5)
Tab 1 IFN-α production inducing with M-CSF/IFN-γ/NDV singly
or combinedly at different age of monocyte culture(n=5) Different age of
monocyte culture
(days)
IFN-α activity (u/0.1ml)(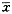 ±s)
±s)
Medium
, 百拇医药
M-CSF
IFN-γ
NDV
M-CSF+NDV
(NDV after 1 day
treatment of M-CSF)
IFN-γ+DNV
(NDV after 1 day
treatment of IFN-γ)
1
<2
, 百拇医药 <3
4.8±1.1
13.6±3.6
15.2±5.2
57.6±8.8
3
<2
<2
6.0±2.5
14.4±6.1
16.0±4.8
102.8±26.7
7
, 百拇医药
<2
<2
7.6±0.9
16.0±5.8
16.8±4.4
115.2±28.6
12
<2
<2
8.8±3.0
20.0±5.7
18.4±5.4
192.0±64.0
, 百拇医药
表2显示,单独用M-CSF预处理,对IFN-α几乎无诱生作用;经过M-CSF预处理再与IFN-γ或NDV联合刺激诱生作用较弱,并且不随M-CSF预处理时间延长而诱生作用增强;经M-CSF预处理再与IFN-γ和NDV联合刺激,诱生作用最强,且随着M-CSF预处理时间延长,M-CSF+IFN-γ+NDV三者联合刺激诱生IFN-α水平均逐渐升高,在1,3,7,12d诱生IFN-α水平的量与其它各组比较均具有显著性差异(P<0.01)。表2 M-CSF预处理不同时间后加刺激剂(IFN-γ/NDV)对单核细胞诱生IFN-α的影响(n=5)
Tab 2 IFN-α produced by monocyte after pretreatment of M-CSF,then stimulated by IFN-γ/NDV(n=5) Duration of M-CSF
pre-treatment
, 百拇医药 (days)
IFN-α activity (u/0.1ml)(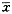 ±s)
±s)
Medium
(with M-CSF)
IFN-γ
NDV
IFN-γ+NDV
(NDV after 1 day treatment of IFN-γ)
1
<2
, http://www.100md.com
6.4±2.0
16.0±5.6
76.8±17.5
3
<2
8.4±2.1
18.4±5.4
121.6±41.7
7
<2
8.8±1.8
20.0±8.0
, http://www.100md.com 128.0±39.1
12
<2
9.6±2.2
25.6±8.7
204.0±28.6
3 讨论
Mο-Mφ系统的发育,是从骨髓中的前单核细胞(6d)继续分化为成熟的单核细胞进入血液(1~3d),经过血循环定居到组织,称巨噬细胞[4](数天~数周)。随着细胞的分化成熟,其粘附能力、吞噬能力、细胞因子产生及细胞表面分子(包括FC受体、CD分子、HLA分子)的表达等都逐渐增强。在体外组织培养中,圆形的单核细胞经3~7d培养后变成椭圆形、多角形或梭形的巨噬细胞,与免疫有关的表面分子渐丰,其合成和分泌细胞因子能力渐强。本文观察到体外培养时间越长,诱生IFN-α的能力越强,细胞培养2周所诱生的IFN-α水平明显高于1周的诱生水平。由此可见,只有成熟的巨噬细胞,才能诱生高水平的IFN-α,这与文献[2]报道一致。
, 百拇医药
M-CSF是由多种细胞产生的一类糖蛋白,能促进骨髓中干细胞增殖分化为单核吞噬细胞,并作用于循环的单核细胞和组织中的巨噬细胞,促进Mο-Mφ的增殖和分化,是M0-Mφ在体外长期生存的重要维持因子[5]。IFN-γ在Mο-Mφ生长和分化中起作用,目前公认IFN-γ是Mο-Mφ系统中最有力的活化因子[6]。本实验中,IFN-γ+NDV二者联合刺激与M-CSF+IFN-γ+NDV三者联合刺激所诱生的IFN-α水平接近,无显著差异(P>0.05)。提示:IFN-γ作为强而快的刺激剂发挥短程作用,M-CSF作为慢而弱的刺激剂发挥长程维持作用。
诱生α、β、γ3种干扰素的常用方法不同,通过病毒刺激外周血B细胞往往获得高效价IFN-α;polyI∶C刺激纤维母细胞获得高效价IFN-β;有丝分裂原如ConA、PHA等刺激外周血T细胞等则产生高价效IFN-γ。一般认为Mο-Mφ是几乎难于产生IFN-α的细胞,但文献[7]报道coxsackievirus B3(CVB3)体外感染人血单核细胞导致杀细胞感染,同时诱生中等水平的IFN-α,这是一个特殊的例外。病毒导致单核细胞的杂细胞感染的例子确实很少,HIV虽能感染人单核细胞,但并不诱生IFN-α。据本实验观察,无论有无M-CSF的预刺激,单独NDV刺激不能导致Mο-Mφ产生高水平的IFN-α,只有经过IFN-γ诱导细胞活化,NDV才能刺激产生较高水平的IFN-α,即二者联合作用效果极为明显。本文通过4种因素联合使用,MO-Mφ(在特定条件下)诱生IFN-α可达相当高的水平,这为研究MO-Mφ诱生IFN-α提供了参考。
, 百拇医药
作者简介 第一作者:女,36岁,硕士,讲师
参考文献
1 Warren MK,Palph R.CSF-1 stimulates monocytes factor production.J Immunol,1986,137:2281
2 Cantell K,Pirhonen J.IFN-γ enhances production of IFN-α in human macrophages but not in monocytes.J Interferon Cytokine Res,1996,16:461
3 黄祯祥.医学病毒学基础及实验技术.北京:科学出版社,1990.266
4 Johnston RB.Monocytes and macrophages.New Engl J Med,1988,318(12):747
, http://www.100md.com
5 Munn PH,Armstrong E.Regulation of monocyte differentiation in vitro.Cancer Res,1993,53:2603
6 Bohbot A,Eischen A,Feden C et al.U937 cell line:Impact of CSFs,IL-6 and IFN-γ on the differentiation and the Leu-CAM proteins expression.Exp Hematol,1993,21:564
7 Henke A,Mohr C,Sprenger H,et al.Coxsackievirus B3-induced production of tumor necrosis factor-α,IL-1β,and IL-6 in human monocytes.J Immunol,1992,148:2270
(1998-03-25收稿;1998-11-24修回), 百拇医药
单位:南京医科大学微生物学教研室 南京 210029
关键词:M-CSF;IFN-γ;IFN-α;NDV;单核细胞
免疫学杂志990212摘 要 观察了M-CSF预处理、IFN-γ预处理、长程培养及新城疫病毒(new-castle disease virus,NDV)刺激4个因素对正常人外周血单核细胞体外产生IFN-α水平的影响,采用生物活性法检测IFN-α。结果表明:单独使用M-CSF不能诱生IFN-α;单独使用IFN-γ或单独使用NDV均只诱生较低水平IFN-α,只有M-CSF+IFN-γ+NDV或IFN-γ+NDV联合使用方可诱生较高水平的IFN-α,并且发现Mο、-Mφ长程培养也是向高产发展的一个重要因素。结论:人血Mο、-Mφ在适当体外培养条件下,可以诱发较高水平的IFN-α。
, 百拇医药
中图号 R392
ANALYSIS OF FACTORS AFFECTED IFN-α INDUCTION BY HUMAN BLOOD MONOCYTES IN VITRO
Sun Luhong,Yao Kun,Ji Xiaohui,Ding Runing,Li Huandi
(Department of Microbiology,Nanjing Medical University,Nanjing 210029)
Abstract Mο-Mφ could hardly induce IFN-α in vitro,especially at high level.This paper reported 4 factors affected IFN-α induction from cultured Mο-Mφ.The results showed treatment singly with M-CSF couldnt induce IFN-α.Treatment with IFN-γ alone or stimulation with NDV alone could induce low level of IFN-α.Treatment with M-CSF,IFN-γ and NDV proved to be the best.The age of Mο-Mφ culture was also an important factor.
, 百拇医药
Key words M-CSF,IFN-γ,IFN-α,NDV,Monocyte
IFN-α的体外诱生通常用NDV或仙台病毒作用于B细胞,使之产生IFN-α,用Mο-Mφ(单核-巨噬细胞)诱生IFN-α是相当困难的。本文通过改变Mο-Mφ的培养条件,使之适于诱生IFN-α,观察了4种因素:M-CSF的预处理,IFN-γ的预处理,Mο-Mφ长程培养和NDV刺激对诱生IFN-α的影响。4种因素或单独使用或联合使用,出现许多不同的效应,现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞系和病毒:人羊膜WISH株按常规培养传代,用于滴定IFN-α;水泡性口炎病毒(VSV)本室低温保存,用于滴定IFN-α;NDV来自本室,用于诱生IFN-α。
, 百拇医药
1.1.2 试剂:rhM-CSF由南京大学生物系提供,比活性1.2×106CFU/mg;rhIFN-γ由上海生物制品研究所提供。
1.2 方法
1.2.1 单核细胞的分离[1]:从健康人新鲜静脉血中分离单个核细胞,以1×107/ml细胞浓度加入96孔细胞培养板,每孔200μl;置37°C 5%CO2贴壁培养2h;洗3次去非粘附细胞,贴壁的即为单核细胞,每孔约有贴壁细胞0.3×105~1×105个,经非特异性酯酶染色证实所得细胞95%以上为单核细胞。
1.2.2 IFN-α的诱生:根据参考文献[2]并予改进。诱生IFN-α共用4个可变因素,即NDV(血凝效价1∶1280)20μl/孔,M-CSF(5 000U/ml)100μl/孔,IFN-γ(1 000U/ml)100μl/孔和长程培养时间。培养条件均为37°C 5%CO2。①将含有单核细胞的培养板分别培养1,3,7,12d后,加IFN-γ、M-CSF或NDV分别培养24h,收集上清;或加IFN-γ、M-CSF分别培养24h后再加NDV培养24h,收集上清,详见表1。②在含有单核细胞的培养板孔内加入M-CSF分别预处理1,3,7,12d后,加入IFN-γ、NDV分别培养24h,收集上清;或加IFN-γ培养24h再加DNV培养24h,收集上清,详见表2。所收集培养上清,均经加热56°C 30min处理,以除去IFN-γ,移置-20°C保存,备测IFN-α。
, http://www.100md.com
1.2.3 IFN-α的检测:通过细胞病变抑制试验[3]检测IFN-α活性,以能抑制CPE(++)的最高稀释度为终点。此读数为本室检测IFN-α的工作单位,而非国际标准单位。
2 结果
表1显示:单独M-CSF刺激不产生IFN-α;单独IFN-γ或单独NDV刺激,产生较低水平IFN-α;M-CSF+NDV联合刺激产生IFN-α水平也较低;只有IFN-γ+NDV联合刺激才能产生较高水平的IFN-α。此外,随着单核细胞培养时间延长,M-CSF组、IFN-γ组、NDV组和M-CSF+NDV组诱生IFN-α水平均无明显升高趋势,而IFN-γ+NDV组诱生IFN-α水平则逐渐升高,在1,3,7,12d产生IFN-α量与其它各组比均具显著性差异(P<0.01)
表1 培养不同时间后M-CSF/IFN-γ/NDV单独或联合刺激
, 百拇医药
对单核细胞诱生IFN-α的影响(n=5)
Tab 1 IFN-α production inducing with M-CSF/IFN-γ/NDV singly
or combinedly at different age of monocyte culture(n=5) Different age of
monocyte culture
(days)
IFN-α activity (u/0.1ml)(
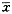 ±s)
±s)Medium
, 百拇医药
M-CSF
IFN-γ
NDV
M-CSF+NDV
(NDV after 1 day
treatment of M-CSF)
IFN-γ+DNV
(NDV after 1 day
treatment of IFN-γ)
1
<2
, 百拇医药 <3
4.8±1.1
13.6±3.6
15.2±5.2
57.6±8.8
3
<2
<2
6.0±2.5
14.4±6.1
16.0±4.8
102.8±26.7
7
, 百拇医药
<2
<2
7.6±0.9
16.0±5.8
16.8±4.4
115.2±28.6
12
<2
<2
8.8±3.0
20.0±5.7
18.4±5.4
192.0±64.0
, 百拇医药
表2显示,单独用M-CSF预处理,对IFN-α几乎无诱生作用;经过M-CSF预处理再与IFN-γ或NDV联合刺激诱生作用较弱,并且不随M-CSF预处理时间延长而诱生作用增强;经M-CSF预处理再与IFN-γ和NDV联合刺激,诱生作用最强,且随着M-CSF预处理时间延长,M-CSF+IFN-γ+NDV三者联合刺激诱生IFN-α水平均逐渐升高,在1,3,7,12d诱生IFN-α水平的量与其它各组比较均具有显著性差异(P<0.01)。表2 M-CSF预处理不同时间后加刺激剂(IFN-γ/NDV)对单核细胞诱生IFN-α的影响(n=5)
Tab 2 IFN-α produced by monocyte after pretreatment of M-CSF,then stimulated by IFN-γ/NDV(n=5) Duration of M-CSF
pre-treatment
, 百拇医药 (days)
IFN-α activity (u/0.1ml)(
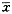 ±s)
±s)Medium
(with M-CSF)
IFN-γ
NDV
IFN-γ+NDV
(NDV after 1 day treatment of IFN-γ)
1
<2
, http://www.100md.com
6.4±2.0
16.0±5.6
76.8±17.5
3
<2
8.4±2.1
18.4±5.4
121.6±41.7
7
<2
8.8±1.8
20.0±8.0
, http://www.100md.com 128.0±39.1
12
<2
9.6±2.2
25.6±8.7
204.0±28.6
3 讨论
Mο-Mφ系统的发育,是从骨髓中的前单核细胞(6d)继续分化为成熟的单核细胞进入血液(1~3d),经过血循环定居到组织,称巨噬细胞[4](数天~数周)。随着细胞的分化成熟,其粘附能力、吞噬能力、细胞因子产生及细胞表面分子(包括FC受体、CD分子、HLA分子)的表达等都逐渐增强。在体外组织培养中,圆形的单核细胞经3~7d培养后变成椭圆形、多角形或梭形的巨噬细胞,与免疫有关的表面分子渐丰,其合成和分泌细胞因子能力渐强。本文观察到体外培养时间越长,诱生IFN-α的能力越强,细胞培养2周所诱生的IFN-α水平明显高于1周的诱生水平。由此可见,只有成熟的巨噬细胞,才能诱生高水平的IFN-α,这与文献[2]报道一致。
, 百拇医药
M-CSF是由多种细胞产生的一类糖蛋白,能促进骨髓中干细胞增殖分化为单核吞噬细胞,并作用于循环的单核细胞和组织中的巨噬细胞,促进Mο-Mφ的增殖和分化,是M0-Mφ在体外长期生存的重要维持因子[5]。IFN-γ在Mο-Mφ生长和分化中起作用,目前公认IFN-γ是Mο-Mφ系统中最有力的活化因子[6]。本实验中,IFN-γ+NDV二者联合刺激与M-CSF+IFN-γ+NDV三者联合刺激所诱生的IFN-α水平接近,无显著差异(P>0.05)。提示:IFN-γ作为强而快的刺激剂发挥短程作用,M-CSF作为慢而弱的刺激剂发挥长程维持作用。
诱生α、β、γ3种干扰素的常用方法不同,通过病毒刺激外周血B细胞往往获得高效价IFN-α;polyI∶C刺激纤维母细胞获得高效价IFN-β;有丝分裂原如ConA、PHA等刺激外周血T细胞等则产生高价效IFN-γ。一般认为Mο-Mφ是几乎难于产生IFN-α的细胞,但文献[7]报道coxsackievirus B3(CVB3)体外感染人血单核细胞导致杀细胞感染,同时诱生中等水平的IFN-α,这是一个特殊的例外。病毒导致单核细胞的杂细胞感染的例子确实很少,HIV虽能感染人单核细胞,但并不诱生IFN-α。据本实验观察,无论有无M-CSF的预刺激,单独NDV刺激不能导致Mο-Mφ产生高水平的IFN-α,只有经过IFN-γ诱导细胞活化,NDV才能刺激产生较高水平的IFN-α,即二者联合作用效果极为明显。本文通过4种因素联合使用,MO-Mφ(在特定条件下)诱生IFN-α可达相当高的水平,这为研究MO-Mφ诱生IFN-α提供了参考。
, 百拇医药
作者简介 第一作者:女,36岁,硕士,讲师
参考文献
1 Warren MK,Palph R.CSF-1 stimulates monocytes factor production.J Immunol,1986,137:2281
2 Cantell K,Pirhonen J.IFN-γ enhances production of IFN-α in human macrophages but not in monocytes.J Interferon Cytokine Res,1996,16:461
3 黄祯祥.医学病毒学基础及实验技术.北京:科学出版社,1990.266
4 Johnston RB.Monocytes and macrophages.New Engl J Med,1988,318(12):747
, http://www.100md.com
5 Munn PH,Armstrong E.Regulation of monocyte differentiation in vitro.Cancer Res,1993,53:2603
6 Bohbot A,Eischen A,Feden C et al.U937 cell line:Impact of CSFs,IL-6 and IFN-γ on the differentiation and the Leu-CAM proteins expression.Exp Hematol,1993,21:564
7 Henke A,Mohr C,Sprenger H,et al.Coxsackievirus B3-induced production of tumor necrosis factor-α,IL-1β,and IL-6 in human monocytes.J Immunol,1992,148:2270
(1998-03-25收稿;1998-11-24修回), 百拇医药