肠毒素性大肠杆菌CS3菌毛呈现载体的构建
http://www.100md.com
37c医学网
作者:高荣凯 张兆山 李淑琴 黄翠芬
单位:高荣凯 张兆山 李淑琴 黄翠芬(军事医学科学院生物工程研究所);高荣凯(海军总医院)
关键词:肠毒素性大肠杆菌;CS3菌毛;抗原表位;表面呈现;口蹄疫病毒
中华微生物学和免疫学杂志000601 【 摘要 】 目的 构建大肠杆菌CS3菌毛呈现载体,实现外源表位在细菌表面的呈现。 方法 通过对CS3亚基蛋白二级结构、抗原表位、亲水性及柔韧性的预测分析,确定外源表位的插入位点,重叠延伸PCR方法进行定点突变,将口蹄疫病毒VP1插入到CS3中以验证表面呈现能力;用重组菌腹腔注射免疫小鼠以探讨其抗原性。 结果 在大肠杆菌CS3的136位氨基酸残基后突变插入BamHⅠ酶切点构建成呈现载体,全细胞ELISA、电镜和免疫电镜观察等均表明外源表位在大肠杆菌表面得到了表达,而且可诱发机体产生针对CS3和外源表位的双重免疫应答。 结论 该大肠杆菌CS3菌毛呈现载体可以实现外源表位的表面呈现,可望成为研制基因工程活菌疫苗的表达载体。
, http://www.100md.com
Construction of a display vector based on the CS3 pili of enterotoxigenic Escherichia coli
GAO Rongkai, ZHANG Zhaoshan, LI Shuqin, et al.
(Institute of Biotechnology, Academy of Military Medical Science, Beijing 100071, P.R.China)
【 Abstract 】 Objective To construct the display vector based on the CS3 pili of enterotoxigenic Escherichia coli. Methods The secondary structure antigen epitopes, hydrophilicity and flexibility of CS3 subunit were predicted with the Goldkey software. Based on the prediction, the site for inserting heterologous epitopes was chosen. Mutation was done using the overlapping extention PCR. The gene fragment coding for the VP1 of foot-mouth disease virus (FMDV) was synthesized and inserted into CS3. The surface expression of hybrid protein was examined using whole-cell ELISA, electron microscopy and immuno-electron microscopy. Mice were immunized by injecting the recombinant bacteria intraperitoneally to evaluate the immunogenicity of the hybrid proteins. Results
, 百拇医药
The VP1 of FMDV was displayed on the surface of the recombinant cells. The fusion proteins were expressed as hybrid pili. Mice produced antibody response against CS3 and the VP1 of FMDV. Conclusion The CS3 pili can be a vector to express the foreign epitopes on the surface of the recombinant cells, and it may probably be an expression vector for the construction of the live gene engineering vaccine.
【 Subject words 】 Enterotoxigenic Escherichia coli; CS3 pili; Epitope; Surface display; Foot-mouth disease virus
, 百拇医药
肠毒素性大肠杆菌(ETEC)是引起婴幼儿和旅游者腹泻的主要病原菌,它的致病性依赖于两类毒性因子,即肠毒素和定居因子抗原(colonization factor antigens, CFAs)。CS3是CFA/Ⅱ阳性菌株的共有抗原,由相对分子质量(Mr)为60×106的大质粒编码〔1〕。我们在克隆了包括CS3菌毛装配调控区在内的整个DNA片段,并于CS3的第82位氨基酸残基后实现CTP3的表面呈现的基础上〔2〕,对CS3基因进一步改造,获得在第136位可实现外源表位表面表达的呈现载体pCSB136,将口蹄疫病毒VP1表位插入后得到了表面表达。用重组菌免疫动物,能诱发机体产生抗CS3和抗口蹄疫病毒VP1的抗体,为构建基因工程疫苗特别是多价疫苗奠定了基础。
材料和方法
菌株和质粒:E.coli DH5α为本室保存。重组质粒pMGD3由本室构建。pUC19由本室保存。
, 百拇医药
工具酶和生化试剂:限制性内切酶HindⅢ、BamHⅠ、HincⅡ、XbaⅠ、KpnⅠ及T4 DNA连接酶等为New England Biolabs公司产品;其它化学试剂均为分析纯试剂。
蛋白的预测分析:使用Goldkey软件对CS3亚基蛋白的二级结构、亲水性、柔韧性及抗原表位进行预测分析。
基因操作:质粒提取、酶切、DNA片段的回收、连接等基因工程操作均参照文献〔3〕进行。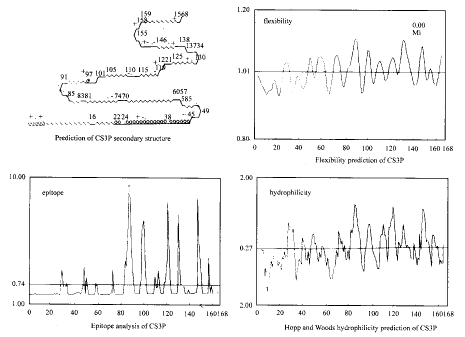
图1 CS3亚基蛋白的计算机预测分析
Fig 1. Prediction of CS3 subunit protein
基因定点突变:采用重叠延伸PCR方法,参照文献〔2〕进行。
, http://www.100md.com
全细胞ELISA:参照文献〔2〕进行。为便于对表达水平的检测,使重组菌悬液吸光度值均为A600=1。
电镜观察:按照文献〔4〕方法进行。
免疫电镜观察:制备铜网样品,用100倍稀释的抗FMDV单抗进行着染;PBS洗3遍;10倍稀释的胶体金标记的羊抗鼠二抗进行着染;同上洗3遍;磷钨酸负染后电镜观察。
动物免疫试验:选用8~10周龄的雌性BALB/c小鼠10只,分为实验和载体对照两组。采用腹腔注射途径进行免疫,于0、7、21 d免疫3次,每次注射0.2ml菌液(107个菌)。于35 d采取血样,ELISA测定抗体滴度。
结果
1.pUCS3的构建:用HindⅢ酶切pMGD3,回收4.7kb的CS3操纵子片段,插入pUC19的HindⅢ位点,酶切鉴定和序列分析筛选到插入正确的重组子,全细胞ELISA证实CS3可以获得表达。
, http://www.100md.com
2.CS3亚基蛋白的预测分析及突变位点的选择:为选择插入位点,利用Goldkey软件对CS3亚基蛋白的亲水性、抗原表位、二级结构以及柔韧性等进行了预测分析(图1)。结果表明在CS3亚基蛋白中有3个高亲水区,即85~92AA、119~124AA和146~158AA,这些区域与抗原表位相重合,二级结构预测结果显示这些区域为卷曲和/或β转角结构,而且其柔韧性也是比较高的,说明这四种性质是密切相关的。根据对CS3亚基蛋白的预测分析,为了便于外源表位的暴露并且尽量避免影响CS3的构像,初步选定136~137AA之间作为插入位点。
3.CS3基因的定点突变:合成突变引物,P1:5′-TGCCAGGATCCACTAATTTACCACTTAAG-3′; P2: 5′-T TAGTGGATCCTGGCAACTGACTCCCATT-3′。为便于操作,合成从CS3的HincⅡ位点处到末端HindⅢ的两端引物,P5: 5′-GTTGTCGACTACATGTAGG-3′;P6:5′-GGGGTACCAAGCTTGACTATTTAATG-3′。以pUCS3为模板进行重叠延伸PCR(图2),P1与P2配对在CS3第136和137AA间引入了BamHⅠ酶切点。将突变后的PCR产物经HincⅡ和KpnⅠ双酶切后取代pUCS3 中相应片段即得到CS3表面呈现载体pCSB136(图3)。转化E.coli DH5α,全细胞ELISA测定CS3的表达情况。结果表明pCSB136能表达CS3。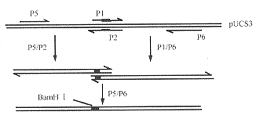
, 百拇医药
图2 重叠延伸PCR示意图
Fig 2. Overlapping extention PCR
图3 质粒pCSB136的图谱
Fig 3. Map of plasmid pCSB136
4.抗原表位的插入:化学合成口蹄疫病毒VP1基因片段及其互补链,在两端加上BamHⅠ酶切点。5′-GATCCTATAAACAGAAAATCATCGCTCCGGCTG-3′; 5′-GATCCAGCCGGAGCGATGATTTTCTGTTTATAG-3′。用水溶解寡核苷酸链,使浓度为1μg/μl,各取10μl混匀,85℃ 5 min,自然冷至室温退火。取退火后的外源表位基因插入到BamHⅠ酶切点处,经PCR方法筛选到正确插入的重组子,命名为pCSB136F。
, http://www.100md.com
5.重组蛋白的表达:将带有外源表位基因的重组质粒转化E.coli DH5α,测定CS3和外源表位的表达情况。全细胞ELISA结果表明(表1),DH5α(pCSB136F)能表达CS3和口蹄疫病毒VP1表位。电镜观察表明DH5α(pCSB136F)能形成菌毛(图4)。免疫电镜结果显示口蹄疫病毒VP1在CS3菌毛上得到了呈现(图5)。
6.免疫应答:为了检测杂合菌毛的免疫原性,用DH5α(pCSB136F)腹腔注射途径免疫BALB/c小鼠,并测定抗CS3和抗口蹄疫病毒VP1的抗体效价。ELISA法初步检测结果表明,抗CS3抗体效价为5 000,抗口蹄疫病毒VP1抗体效价大多为128,最高可达到256。以上结果表明该重组菌可诱发机体抗CS3和抗口蹄疫病毒VP1的双重免疫应答。
表1 杂合蛋白的全菌酶联免疫吸附试验检测结果
Table 1.Results of whole-cell ELISA Strains
, http://www.100md.com
A490
CS3
VP1
DH5α(pUC19)
0.04±0.005
×
DH5α(pCSB136)
0.50±0.015
0.05±0.010
DH5α(pCSB136F)
0.21±0.010
0.14±0.005
, 百拇医药
图4 重组菌DH5α(pCSB136F)的电镜照片
Fig 4. Electron microscopy of the recombinant bacteria E.coli DH5α(pCSB136F) (45 000×)
图5 重组菌的免疫电镜照片
Fig 5. Immuno-electron microscopy of the recombinant bacteria E.coli DH5α(pCSB136F) (28 000×)
讨论
研究细菌表面呈现技术的初衷是构建基因工程疫苗,此外该技术在抗体库和肽库的表面呈现、构建新型生物催化剂和生物吸附剂等方面也得到广泛地应用。载体蛋白种类繁多,包括外膜蛋白、脂蛋白、菌毛蛋白和鞭毛蛋白等都成功用于外源蛋白或表位的表面表达。由于菌毛位于细菌表面,数量众多,每根菌毛又含有多个拷贝(500~1 000)的菌毛蛋白,本身又具有较强的免疫原性,是构建基因工程疫苗的优选载体。CS3是CFA/Ⅱ阳性菌的共有抗原,在临床上具有重要意义,它是一种保护性抗原,临床研究结果表明,以CS3作为疫苗可有效防止由相关细菌导致的腹泻。
, 百拇医药
对于插入位点的确定,最好的方法是通过核磁共振或者X光晶体衍射技术测定其三维结构,找出暴露最充分的位点,以便更好地实现外源表位的表面呈现。再者,可以通过同源性的比较,找出高度可变的区域,在这些区域插入外源表位,一般而言对载体蛋白自身构象影响较小,有可能实现外源表位的表面表达。由于CS3与其它蛋白的同源性很低,不到40%,难以通过同源性比较方法确定插入位点,而三维结构的测定不仅难度大,而且费用也高。本研究是基于二级结构等预测分析的基础上来确定CS3上的插入位点,结果表明136位能实现外源表位的表面表达。与82位相比,136位表达水平与之相当。Yakhchali等〔5〕研究发现在其它两个位点也能实现外源表位的表面呈现。通过对这些位点的分析发现,它们都是在β转角结构或卷曲处。
抗原的免疫提呈是制约免疫应答水平的重要环节。一般认为,细菌表面呈现的抗原更易于为机体的免疫系统所识别。Haddad等〔6〕的研究发现,虽然可溶性表达的抗原量是表面表达抗原量的10~100倍,但它们所诱发的免疫应答水平相当。Stover等〔7〕的研究发现,细菌表面呈现的抗原所诱发的抗体反应比细胞质表达或分泌表达的融合蛋白诱发的抗体反应高100~1 000倍。所有这些均表明,细菌表面呈现的抗原在免疫提呈效率上可能要高于其它类型的抗原。此外,细菌的脂多糖具有较强的免疫原性,是天然的免疫佐剂,而且许多载体蛋白本身都具有很强的免疫原性,所有这些都利于诱发高水平的免疫应答。我们用呈现外源表位的重组菌免疫动物,机体产生了抗CS3和抗外源表位的双重免疫应答反应。虽然外源表位仅为9肽,但也能诱发较高水平的免疫应答。以上结果表明,CS3不仅能作为外源表位的呈现载体,而且还能诱发机体的双重免疫应答反应,为构建基因工程疫苗奠定了基础。
, 百拇医药
志谢:本所王国力博士在蛋白的结构预测等方面给予大力支持和帮助,在此深表感谢!
基金项目:国家自然科学基金资助项目(39570408)
参考文献
1,Jalajakumari MB, Thomas CJ,Manning PA. Genes for biosynthesis and assembly of CS3 pili of CFA/Ⅱ enterotoxigenic Escherichia coli: novel regulation of pilus production by bypassing an amber codon. Mol Microbiol, 1989, 3(12):1685-1695.
2,董自正, 张兆山, 李淑琴, 等. CS3菌毛可以作为异源抗原决定簇的表达载体. 中国科学(C辑), 1998, 28(6):501-507.
, http://www.100md.com
3,J. 萨姆布鲁克, E.F.弗里奇,T. 曼尼阿蒂斯. 分子克隆实验指南. 北京:科学出版社. 1992, pp16-325.
4,Levine MM, Ristaino P, Marley G, et al. Coli surface antigens 1 and 3 of colonization factor antigenⅡ-positive enterotoxigenic Eschreichia coli: morphology, purification and immune response in humans. Infect Immun, 1984, 44: 409-420.
5,Yakhchali B,Manning PA. Epitope analysis of CS3 fimbrial subunit of human enterotoxigenic Escherichia coli and the construction of novel CS3::ST and CS3::LT-B immunogens. Behring Inst Mitt, 1997, 98:124-134.
, 百拇医药
6,Haddad D, Liljequist S, Kumar S, et al. Surface display compared to periplasmic expression of a malarial antigen in Salmonella typhimurium and its implication. FEMS Immunol Med Microbiol, 1995, 12:175-186.
7,Stover CK, Bansal GP, Hanson MS, et al. Protective immunity elicited by recombinant Bacille Calmette-Guerin (BCG) expressing outer surface protein A (OspA) lipoprotein: acandidate lyme disease vaccine. J Exp Med, 1993, 178:197-209.
(收稿日期:1999-10-12), 百拇医药
单位:高荣凯 张兆山 李淑琴 黄翠芬(军事医学科学院生物工程研究所);高荣凯(海军总医院)
关键词:肠毒素性大肠杆菌;CS3菌毛;抗原表位;表面呈现;口蹄疫病毒
中华微生物学和免疫学杂志000601 【 摘要 】 目的 构建大肠杆菌CS3菌毛呈现载体,实现外源表位在细菌表面的呈现。 方法 通过对CS3亚基蛋白二级结构、抗原表位、亲水性及柔韧性的预测分析,确定外源表位的插入位点,重叠延伸PCR方法进行定点突变,将口蹄疫病毒VP1插入到CS3中以验证表面呈现能力;用重组菌腹腔注射免疫小鼠以探讨其抗原性。 结果 在大肠杆菌CS3的136位氨基酸残基后突变插入BamHⅠ酶切点构建成呈现载体,全细胞ELISA、电镜和免疫电镜观察等均表明外源表位在大肠杆菌表面得到了表达,而且可诱发机体产生针对CS3和外源表位的双重免疫应答。 结论 该大肠杆菌CS3菌毛呈现载体可以实现外源表位的表面呈现,可望成为研制基因工程活菌疫苗的表达载体。
, http://www.100md.com
Construction of a display vector based on the CS3 pili of enterotoxigenic Escherichia coli
GAO Rongkai, ZHANG Zhaoshan, LI Shuqin, et al.
(Institute of Biotechnology, Academy of Military Medical Science, Beijing 100071, P.R.China)
【 Abstract 】 Objective To construct the display vector based on the CS3 pili of enterotoxigenic Escherichia coli. Methods The secondary structure antigen epitopes, hydrophilicity and flexibility of CS3 subunit were predicted with the Goldkey software. Based on the prediction, the site for inserting heterologous epitopes was chosen. Mutation was done using the overlapping extention PCR. The gene fragment coding for the VP1 of foot-mouth disease virus (FMDV) was synthesized and inserted into CS3. The surface expression of hybrid protein was examined using whole-cell ELISA, electron microscopy and immuno-electron microscopy. Mice were immunized by injecting the recombinant bacteria intraperitoneally to evaluate the immunogenicity of the hybrid proteins. Results
, 百拇医药
The VP1 of FMDV was displayed on the surface of the recombinant cells. The fusion proteins were expressed as hybrid pili. Mice produced antibody response against CS3 and the VP1 of FMDV. Conclusion The CS3 pili can be a vector to express the foreign epitopes on the surface of the recombinant cells, and it may probably be an expression vector for the construction of the live gene engineering vaccine.
【 Subject words 】 Enterotoxigenic Escherichia coli; CS3 pili; Epitope; Surface display; Foot-mouth disease virus
, 百拇医药
肠毒素性大肠杆菌(ETEC)是引起婴幼儿和旅游者腹泻的主要病原菌,它的致病性依赖于两类毒性因子,即肠毒素和定居因子抗原(colonization factor antigens, CFAs)。CS3是CFA/Ⅱ阳性菌株的共有抗原,由相对分子质量(Mr)为60×106的大质粒编码〔1〕。我们在克隆了包括CS3菌毛装配调控区在内的整个DNA片段,并于CS3的第82位氨基酸残基后实现CTP3的表面呈现的基础上〔2〕,对CS3基因进一步改造,获得在第136位可实现外源表位表面表达的呈现载体pCSB136,将口蹄疫病毒VP1表位插入后得到了表面表达。用重组菌免疫动物,能诱发机体产生抗CS3和抗口蹄疫病毒VP1的抗体,为构建基因工程疫苗特别是多价疫苗奠定了基础。
材料和方法
菌株和质粒:E.coli DH5α为本室保存。重组质粒pMGD3由本室构建。pUC19由本室保存。
, 百拇医药
工具酶和生化试剂:限制性内切酶HindⅢ、BamHⅠ、HincⅡ、XbaⅠ、KpnⅠ及T4 DNA连接酶等为New England Biolabs公司产品;其它化学试剂均为分析纯试剂。
蛋白的预测分析:使用Goldkey软件对CS3亚基蛋白的二级结构、亲水性、柔韧性及抗原表位进行预测分析。
基因操作:质粒提取、酶切、DNA片段的回收、连接等基因工程操作均参照文献〔3〕进行。

图1 CS3亚基蛋白的计算机预测分析
Fig 1. Prediction of CS3 subunit protein
基因定点突变:采用重叠延伸PCR方法,参照文献〔2〕进行。
, http://www.100md.com
全细胞ELISA:参照文献〔2〕进行。为便于对表达水平的检测,使重组菌悬液吸光度值均为A600=1。
电镜观察:按照文献〔4〕方法进行。
免疫电镜观察:制备铜网样品,用100倍稀释的抗FMDV单抗进行着染;PBS洗3遍;10倍稀释的胶体金标记的羊抗鼠二抗进行着染;同上洗3遍;磷钨酸负染后电镜观察。
动物免疫试验:选用8~10周龄的雌性BALB/c小鼠10只,分为实验和载体对照两组。采用腹腔注射途径进行免疫,于0、7、21 d免疫3次,每次注射0.2ml菌液(107个菌)。于35 d采取血样,ELISA测定抗体滴度。
结果
1.pUCS3的构建:用HindⅢ酶切pMGD3,回收4.7kb的CS3操纵子片段,插入pUC19的HindⅢ位点,酶切鉴定和序列分析筛选到插入正确的重组子,全细胞ELISA证实CS3可以获得表达。
, http://www.100md.com
2.CS3亚基蛋白的预测分析及突变位点的选择:为选择插入位点,利用Goldkey软件对CS3亚基蛋白的亲水性、抗原表位、二级结构以及柔韧性等进行了预测分析(图1)。结果表明在CS3亚基蛋白中有3个高亲水区,即85~92AA、119~124AA和146~158AA,这些区域与抗原表位相重合,二级结构预测结果显示这些区域为卷曲和/或β转角结构,而且其柔韧性也是比较高的,说明这四种性质是密切相关的。根据对CS3亚基蛋白的预测分析,为了便于外源表位的暴露并且尽量避免影响CS3的构像,初步选定136~137AA之间作为插入位点。
3.CS3基因的定点突变:合成突变引物,P1:5′-TGCCAGGATCCACTAATTTACCACTTAAG-3′; P2: 5′-T TAGTGGATCCTGGCAACTGACTCCCATT-3′。为便于操作,合成从CS3的HincⅡ位点处到末端HindⅢ的两端引物,P5: 5′-GTTGTCGACTACATGTAGG-3′;P6:5′-GGGGTACCAAGCTTGACTATTTAATG-3′。以pUCS3为模板进行重叠延伸PCR(图2),P1与P2配对在CS3第136和137AA间引入了BamHⅠ酶切点。将突变后的PCR产物经HincⅡ和KpnⅠ双酶切后取代pUCS3 中相应片段即得到CS3表面呈现载体pCSB136(图3)。转化E.coli DH5α,全细胞ELISA测定CS3的表达情况。结果表明pCSB136能表达CS3。

, 百拇医药
图2 重叠延伸PCR示意图
Fig 2. Overlapping extention PCR

图3 质粒pCSB136的图谱
Fig 3. Map of plasmid pCSB136
4.抗原表位的插入:化学合成口蹄疫病毒VP1基因片段及其互补链,在两端加上BamHⅠ酶切点。5′-GATCCTATAAACAGAAAATCATCGCTCCGGCTG-3′; 5′-GATCCAGCCGGAGCGATGATTTTCTGTTTATAG-3′。用水溶解寡核苷酸链,使浓度为1μg/μl,各取10μl混匀,85℃ 5 min,自然冷至室温退火。取退火后的外源表位基因插入到BamHⅠ酶切点处,经PCR方法筛选到正确插入的重组子,命名为pCSB136F。
, http://www.100md.com
5.重组蛋白的表达:将带有外源表位基因的重组质粒转化E.coli DH5α,测定CS3和外源表位的表达情况。全细胞ELISA结果表明(表1),DH5α(pCSB136F)能表达CS3和口蹄疫病毒VP1表位。电镜观察表明DH5α(pCSB136F)能形成菌毛(图4)。免疫电镜结果显示口蹄疫病毒VP1在CS3菌毛上得到了呈现(图5)。
6.免疫应答:为了检测杂合菌毛的免疫原性,用DH5α(pCSB136F)腹腔注射途径免疫BALB/c小鼠,并测定抗CS3和抗口蹄疫病毒VP1的抗体效价。ELISA法初步检测结果表明,抗CS3抗体效价为5 000,抗口蹄疫病毒VP1抗体效价大多为128,最高可达到256。以上结果表明该重组菌可诱发机体抗CS3和抗口蹄疫病毒VP1的双重免疫应答。
表1 杂合蛋白的全菌酶联免疫吸附试验检测结果
Table 1.Results of whole-cell ELISA Strains
, http://www.100md.com
A490
CS3
VP1
DH5α(pUC19)
0.04±0.005
×
DH5α(pCSB136)
0.50±0.015
0.05±0.010
DH5α(pCSB136F)
0.21±0.010
0.14±0.005

, 百拇医药
图4 重组菌DH5α(pCSB136F)的电镜照片
Fig 4. Electron microscopy of the recombinant bacteria E.coli DH5α(pCSB136F) (45 000×)

图5 重组菌的免疫电镜照片
Fig 5. Immuno-electron microscopy of the recombinant bacteria E.coli DH5α(pCSB136F) (28 000×)
讨论
研究细菌表面呈现技术的初衷是构建基因工程疫苗,此外该技术在抗体库和肽库的表面呈现、构建新型生物催化剂和生物吸附剂等方面也得到广泛地应用。载体蛋白种类繁多,包括外膜蛋白、脂蛋白、菌毛蛋白和鞭毛蛋白等都成功用于外源蛋白或表位的表面表达。由于菌毛位于细菌表面,数量众多,每根菌毛又含有多个拷贝(500~1 000)的菌毛蛋白,本身又具有较强的免疫原性,是构建基因工程疫苗的优选载体。CS3是CFA/Ⅱ阳性菌的共有抗原,在临床上具有重要意义,它是一种保护性抗原,临床研究结果表明,以CS3作为疫苗可有效防止由相关细菌导致的腹泻。
, 百拇医药
对于插入位点的确定,最好的方法是通过核磁共振或者X光晶体衍射技术测定其三维结构,找出暴露最充分的位点,以便更好地实现外源表位的表面呈现。再者,可以通过同源性的比较,找出高度可变的区域,在这些区域插入外源表位,一般而言对载体蛋白自身构象影响较小,有可能实现外源表位的表面表达。由于CS3与其它蛋白的同源性很低,不到40%,难以通过同源性比较方法确定插入位点,而三维结构的测定不仅难度大,而且费用也高。本研究是基于二级结构等预测分析的基础上来确定CS3上的插入位点,结果表明136位能实现外源表位的表面表达。与82位相比,136位表达水平与之相当。Yakhchali等〔5〕研究发现在其它两个位点也能实现外源表位的表面呈现。通过对这些位点的分析发现,它们都是在β转角结构或卷曲处。
抗原的免疫提呈是制约免疫应答水平的重要环节。一般认为,细菌表面呈现的抗原更易于为机体的免疫系统所识别。Haddad等〔6〕的研究发现,虽然可溶性表达的抗原量是表面表达抗原量的10~100倍,但它们所诱发的免疫应答水平相当。Stover等〔7〕的研究发现,细菌表面呈现的抗原所诱发的抗体反应比细胞质表达或分泌表达的融合蛋白诱发的抗体反应高100~1 000倍。所有这些均表明,细菌表面呈现的抗原在免疫提呈效率上可能要高于其它类型的抗原。此外,细菌的脂多糖具有较强的免疫原性,是天然的免疫佐剂,而且许多载体蛋白本身都具有很强的免疫原性,所有这些都利于诱发高水平的免疫应答。我们用呈现外源表位的重组菌免疫动物,机体产生了抗CS3和抗外源表位的双重免疫应答反应。虽然外源表位仅为9肽,但也能诱发较高水平的免疫应答。以上结果表明,CS3不仅能作为外源表位的呈现载体,而且还能诱发机体的双重免疫应答反应,为构建基因工程疫苗奠定了基础。
, 百拇医药
志谢:本所王国力博士在蛋白的结构预测等方面给予大力支持和帮助,在此深表感谢!
基金项目:国家自然科学基金资助项目(39570408)
参考文献
1,Jalajakumari MB, Thomas CJ,Manning PA. Genes for biosynthesis and assembly of CS3 pili of CFA/Ⅱ enterotoxigenic Escherichia coli: novel regulation of pilus production by bypassing an amber codon. Mol Microbiol, 1989, 3(12):1685-1695.
2,董自正, 张兆山, 李淑琴, 等. CS3菌毛可以作为异源抗原决定簇的表达载体. 中国科学(C辑), 1998, 28(6):501-507.
, http://www.100md.com
3,J. 萨姆布鲁克, E.F.弗里奇,T. 曼尼阿蒂斯. 分子克隆实验指南. 北京:科学出版社. 1992, pp16-325.
4,Levine MM, Ristaino P, Marley G, et al. Coli surface antigens 1 and 3 of colonization factor antigenⅡ-positive enterotoxigenic Eschreichia coli: morphology, purification and immune response in humans. Infect Immun, 1984, 44: 409-420.
5,Yakhchali B,Manning PA. Epitope analysis of CS3 fimbrial subunit of human enterotoxigenic Escherichia coli and the construction of novel CS3::ST and CS3::LT-B immunogens. Behring Inst Mitt, 1997, 98:124-134.
, 百拇医药
6,Haddad D, Liljequist S, Kumar S, et al. Surface display compared to periplasmic expression of a malarial antigen in Salmonella typhimurium and its implication. FEMS Immunol Med Microbiol, 1995, 12:175-186.
7,Stover CK, Bansal GP, Hanson MS, et al. Protective immunity elicited by recombinant Bacille Calmette-Guerin (BCG) expressing outer surface protein A (OspA) lipoprotein: acandidate lyme disease vaccine. J Exp Med, 1993, 178:197-209.
(收稿日期:1999-10-12), 百拇医药