大肠杆菌O157︰H7实时荧光PCR快速检测方法的建立(2)
 |
 |
 |
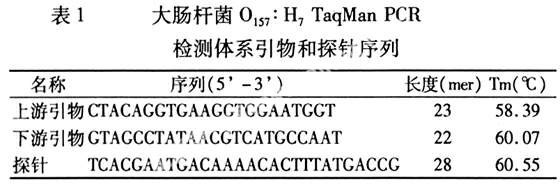 |
1.1.2 菌种大肠杆菌O157:H7由浙江省疾病预防控制中心提供。鸭沙门氏菌、副伤寒沙门氏菌、金黄色葡萄球菌、绿脓杆菌、大肠杆菌EIEC、副溶血性弧菌、奇异变形杆菌、单增李斯特菌、福氏志贺氏菌等菌株由湖州是疾病预防控制中心提供。
1.2方法
1.2.1 引物与TaqMan探针设计合成从GenBank中获取各种不同来源地大肠杆菌O157:H7的rfbE基因序列,应用Primer Express软件分析基因序列,根据文献[5]提供的TaqMan引物和探针设计原则,在这些序列的保守区域筛选一对引物,并在该引物的扩增区域内设计1条荧光探针(表1)。探针5,端标记的荧光报告基团是FAM,3,端标记荧光淬灭基团是TAMRA,委托上海生工生物工程技术服务有限公司合成。
1.2.2 细菌培养及计数将低温保存的菌种置于室温下解冻,接种到增菌培养液内培养复苏,对于常温保存的菌种,直接接种到各自的增菌肉汤种培养复苏,复苏后的菌种分别划线到各自适宜的培养平板上增殖,取增菌分纯后的菌种,用生理盐水制备成菌悬液备用。菌落计数以无菌操作将充分混匀的大肠杆菌O157:H7菌株过夜培养液1 mL按10倍递增稀释至10-1~10-5浓度,并选择10-3、10-4、10-53个稀释度各0.2 mL 涂布于做好的培养皿上,同一稀释度做3个平行,均匀铺板后放入37℃恒温箱中48 h后取出可计数培养皿计数其可见菌落数,即可推算出原液中含的细菌数。
, http://www.100md.com
1.2.3 膜板DNA制备采用热煮沸法,吸取摇匀的培养液或生理盐水菌悬液1000μL 于1.5 mL微量离心管中,置于恒温金属浴中100℃ 15 min,于4℃冰箱过夜,常温下13000r/min离心3 min,取上清液备用。
1.2.4 荧光定量PCR扩增条件的优化反应条件的优化主要包括引物探针浓度比和Mg2+浓度的选择。为防止Real-time PCR反应混合物中由于引物与探针之间的浓度不当引起非特异性竞争抑制,选择引物与探针的最佳浓度配比,获得反应的最低Ct值和最高荧光强度增加值(△Rn),提高反应的扩增效率与敏感度,试验在以相同浓度阳性核酸为模板的反应体系中,选用引物和探针的浓度分别为0.2μmoL/L、 0.4μmoL/L、0.6μmoL/L、0.8μmoL/L、 1.0μmoL/L,采用矩阵法优选引物和探针最佳浓度。另外,Mg2+会直接影响Taq酶活性的关键因素,同时还影响模板与Real-time PCR产物的变性温度、产物的特异性,Mg2+浓度过低,Taq酶活力降低导致PCR产物量少,易造成假阴性,Mg2+ 的浓度过高,会增加引物二聚体的形成。合适的Mg2+ 的浓度还能在反应中得到较低的CT值,较高的荧光信号强度以及良好的曲线峰值。在Real-time PCR反应条件中调整Mg2+终浓度分别为2mM、2.5mM 、3mM 、3.5mM 、4mM、4.5mM、5mM,用相同浓度阳性核酸为模板进行检测,以最低Ct值和最高荧光强度增加值(△Rn)为标准进行筛选,确定Mg2+浓度。
, 百拇医药
1.2.5 荧光定量PCR检测体系评价以无菌操作将上述10-1~10-5稀释度菌液分别提取核酸DNA,用本研究建立的荧光定量PCR检测体系进行检测,对灵敏性进行评价;选择已知10株与O157:H7相关的肠道类细菌分别提取核酸DNA进行Real-Time PCR检测,评价特异性;此外,对4个不同浓度O157:H7菌液作3次重复检测,通过对实验结果Ct值的平均值和变异系数来评价方法的稳定性或可重复性。
1.2.6反应体系与反应参数本研究所采用的Real-Time PCR反应体系为25μL,体系组成:10xbuffer 2.5μL ,dNTP Mixture(各2.5mM) 2μl ,Ex Taq+酶(5U/μL)0.3μL ,Mg2+(25mM)4μL, 20μmoL/L 两个引物各0.6μL,20μmoL/L探针0.8μl, 模板DNA 2μL,补DEPC水至25μL。然后用ABI7300 PCR仪按下列反应参数进行检测:94℃ 变性2min ,以 95℃5s、60℃ 40s 扩增45个循环,在60℃进行单点荧光检测。
, http://www.100md.com
2 结 果
2.1菌落计数
将1 mL按10倍递增稀释至10-1~10-5浓度,选择10-3、10-4、10-5 3个稀释度各0.2 mL均匀铺板48h培养后,可清晰观察到培养皿上生长的菌落。按同一稀释度的3个重复对照的菌落数相差不大且平均菌落数在50个左右为标准,最终确定10-3铺板的3个培养皿生长的平均菌落数34个来计算原菌液的细菌含量,按“平均菌落数*稀释倍数*5”计算得原菌液的细菌浓度为17x104cfu/ mL。
2.2 荧光定量PCR扩增条件的优化
在以相同浓度阳性核酸为模板的反应条件下,优化的Ct值变化范围在21.94~24.70之间。在引物浓度为0.6μmoL/L、 探针浓度为0.8μmoL/L时获得的Ct值最低和荧光强度增加值(△Rn)最高,同时体系的稳定性最好。在Mg2+的浓度优化中发现Mg2+的浓度变化对Ct值的影响不大,但当Mg2+的终浓度为4mM时,荧光强度增加值(△Rn)最高,反应的灵敏度最好(表2)。
, 百拇医药
2.3 方法的灵敏性
图1显示,O157:H7菌株纯培养,TaqMan PCR法的最小检出量为17cfu/ mL。
2.4 方法的特异性
采用以上最佳反应条件TaqMan PCR方法对O157:H7及10种相关肠道细菌进行检测,结果表明:除O157:H7出现很好的阳性结果外,其他细菌检测结果均呈阴性。表明本文建立的TaqMan PCR检测方法对大肠杆菌O157:H7有很好的特异性,与其它相关肠道细菌无交叉反应。
2.5 方法的重复性
对4种不同浓度的O157:H7菌液重复检测3次,得到的Ct值进行汇总(表2),4种浓度菌液检测的结果均能判断为阳性,并且Ct值变异系数在合理范围内(最大为1.90 %,均小于5%)。结果显示,本实验建立的O157:H7 TaqMan PCR检测方法具有较好的稳定性(表3)。
, http://www.100md.com
3 讨 论
大肠杆菌O157:H7感染是一种食源性疾病,已成为世界性的公共卫生问题,严重影响食品安全。发展快速、特异、敏感的检测方法,加强对大肠杆菌O157:H7的检测、鉴定和流行病学调查是确保饮食安全、预防大肠杆菌O157:H7感染的重要手段。传统的大肠杆菌O157:H7检测主要靠分离培养和直接免疫荧光等方法,由于方法学本身的原因,其特异性和敏感性均受不同程度的限制。自1995年美国PE公司提出实时PCR检测方法后,实时PCR以其快速、定量、无需电泳、无交叉污染等突出优点而被迅速推广[6]。Real-Time PCR技术已应用到食品微生物检测,使得食品中病原菌的检测又提高了一个新的水平,无论从敏感性、特异性与速度上都具有优势,当然它对引物和探针也提出了更高的要求[7],因为引物与探针直接影响方法的特异性和灵敏性。为了保证方法的特异性,我们选取了与stxl/2、eaeA、hly等其它毒力基因相比,其特异性更强的编码大肠杆菌O157:H7菌体抗原特异合成酶,并参与O抗原脂多糖的生物合成的基因rfbE作为检测的特异性靶基因,最终确定了一对引物及一条特异性荧光探针,同时测定方法的灵敏度和扩增效率,获得检测最低Ct值和最高荧光强度值(△Rn)。本研究对所建立的TaqMan PCR方法进行了引物、探针浓度和Mg2+的浓度优化,确定了反应体系和反应参数,结果显示当引物和探针的浓度为0.6μmoL/L,0.8μmoL/L,Mg2+浓度为4 mmoL/L时,具有良好的特异性和敏感性。为了验证特异性,我们对大肠杆菌O157:H7菌株和金黄色葡萄球菌等10种相关肠道细菌菌株增菌分纯,血清鉴定的菌种置于恒温金属浴中100℃ 15min,于4℃冰箱过夜,常温下13000r/min离心3min,取上清液为模板进行检测,结果发现它不仅特异性高,而且比传统培养法和常规PCR更敏感、快速,也更简便。通常大肠杆菌O157:H7传统培养法检出限为1×104cfu/ mL,全过程至少需要4~7天。而常规PCR检测,一次反应的敏感度在100cfu/ mL左右,从核酸DNA的提取, PCR扩增与电泳整个过程大约需5~6小时左右,而采用本方法从核酸提取至完成检测最快能在3小时内完成,敏感度可达10cfu/ mL,而且该方法实行完全闭管式操作,避免了常规PCR扩增产物污染和假阳性的问题。, http://www.100md.com(徐德顺 沈月华 程平庆)