硫酸奈替米星滴眼液的制备与质量控制
 |
 |
【摘要】 目的 制备硫酸奈替米星滴眼液并建立其质量控制方法。方法 以注射用水为溶剂,氯化钠为辅料制备硫酸奈替米星滴眼液;用旋光法替代微生物法测定含量。结果 硫酸奈替米星浓度在6~14mg.范围内与旋光度呈良好直线关系(r=0.9998),平均收率100.31%(RSD=1.01%,n=5),精密度实验,重复性良好。硫酸奈替米星滴眼液抗菌范围广,无刺激性,对热不稳定,当温度达到80~100℃时,溶液由无色变为浅棕色,室温条件下贮存稳定。结论 该滴眼剂制备方法简单,性质稳定,旋光法测定简便、快速。结果 准确可靠,与微生物法测定比较误差小,可作为测定该制剂含量的方法。
【关键词】硫酸奈替米星滴眼液 质量控制 旋光法
【中图分类号】R988.1 【文献标识码】A 【文章编号】1005-0019(2008)12-0038-02
硫酸奈替米星是氨基糖苷类抗生素,易溶于水,水溶液较稳定。该药具有高效、低耳、肾毒性。我们将该药试制成滴眼液用于治疗多种病原菌引起的眼部感染,现将制备方法和质量控制方法介绍如下。
1 仪器与药品
WZZ-15数字式自动旋光仪(上海物理光学仪器厂),PHS-3F酸度计(上海电子光学技术研究所),硫酸奈替米星(青岛第三制药厂提供,批号:050801)。
2 处方及制备
2.1 处方 硫酸奈替米星 5.00g,氯化钠 4.20g,注射用水加至500ml。
2.2 制备 取硫酸奈替米星加适量注射用水溶解后,加入氯化钠使其全部溶解,滤过,自滤器上加注射用水至全量,搅匀,除菌,分装即得。
3 质量控制
3.1 性状 本品为无色和几乎无色的澄明液体。
3.2 检查 pH值应在4.5~6.0.
3.3 含量测定
3.3.1 标准曲线的制备 精密称取干燥至恒重的硫酸奈替米星0.6000,0.8000,1.0000,1.2000,1.4000g,分别置100ml容量瓶中,加适量水溶解至刻度,摇匀,于20℃测定旋光度(旋光管2dm),并经计算得回归方程为:C(g)=0.005724α+0.0002229(r=0.9998),线性范围6~14mg,结果表明硫酸奈替米星在此浓度范围内,旋光度与浓度呈线性关系。
3.3.2 精密度试验 分别精密称取约0.8000g硫酸奈替米星干燥品3份,各加水溶解至100ml,混匀,测定其旋光度,每隔5min测定1次,共测定5次,测定结果重复性良好,RSD=1.1%。
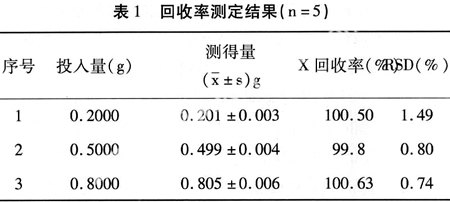
3.3.3 回收率试验 按处方量精密称取硫酸奈替米星及辅料,制成3个不同浓度之溶液,分别测定其旋光度,每个样品连续测定5次,由回归方程计算得回收率,结果见表1。
3.3.4 样品含量测定取硫酸奈替米星滴眼液数支,于旋光仪测定其旋光度,代入回归方程计算含量,3批样品测得结果分别为标示量的100.1%,100.2%,100.2%。
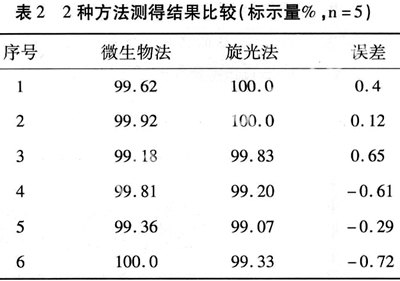
3.3.5 旋光测定法与微生物测定法的比较 取硫酸奈替米星滴眼液数支,按抗生素微生物检定法测定其含量,并与本法比较,两法测得结果分别以百分标示量表示,结果见表2。
3.4 稳定性试验样品室温放置6个月测其含量、pH值及溶液颜色均无改变。样品置水浴80℃、30min则由无色变为淡黄色,并随温度升高至100℃时,又以淡黄色变为浅棕色。其硫酸奈替米星含量由原浓度1.002%降至0.9702%,下降率为3.17%,pH值无明显改变。
3.5 刺激性试验 取成年家兔6只,体重2~3kg,将本品0.1ml滴入左眼结膜内,右眼滴入0.1ml生理盐水作对照,使眼被动闭30s后,分别于30、45、60min及24h后,观察结膜无充血、水肿、溃疡等现象,实验表明本品无刺激症状。
4 讨论
由于本品对热不稳定,故制备过程中应在无菌条件下进行,其他质量标准应符合中国药典2005年版二部附录滴眼剂项下有关规定。本品室温条件下稳定,测定时宜在室温条件下进行,否则影响测定结果。需要在凉暗处,密封保存。药典规定,1000奈替米星单位相当于1mg的奈替米星,实验时应按此规定计算原料药用量。用旋光法测定其含量,具有快速、简便的优点,适用于药厂和医院制剂快速分析。制剂中附加剂氯化钠因无旋光性,故对本法测定无干扰作用。微生物法与旋光法测定结果比较,两者无明显差异,进一步证明采用旋光法测定该制剂含量,结果准确、可靠。
参 考 文 献
1 中国人民解放军总后勤部.医疗制剂规范[S].北京:人民军医出版社,1993:380.
2 中国药典.2000.二部:附录81.
3 罗东,高振国,马文秀,等.盐酸洛美沙星滴眼液的研制[J].中国医院药学杂志,1997,17(1):26., 百拇医药(刘翠竹 李 娜 郑 丽)