对新版中国GMP的几点看法(1)
 |
中图分类号:R951 文献标识码:A 文章编号:1006-1533(2007)09-0389-05
我国新版GMP几经讨论、修订,已趋成熟,从收到的《药品生产质量管理规范通则》及附录(2007年4月修订)已可清楚地看出,起草人想努力打造与现行中国GMP(1998年版)截然不同的全新中国GMP版本。现就新版中国GMP的性质、内容及编写方式提出几点看法。
1 关于新版中国GMP的定位
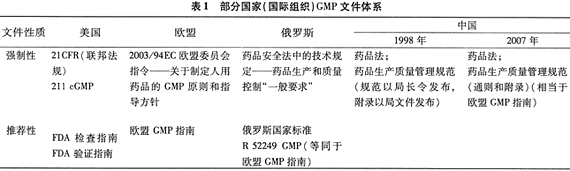
当今世界GMP文件的属性大致有三种:一是技术文件和技术指南性质,国际组织(如WHO、EC、ICH、PIC/S等)的GMP大多采用这种方式;二是以“标准、规定”等文件形式由国家公布,但并不强制执行,多数国家的GMP采用这种方式;三是列入国家法规并要求强制执行,至今只有少数国家(如美国、日本和中国等)的GMP属于这种性质。
由于属性不同,GMP的表述和编写方式有着很大区别。部分国家和国际组织GMP文件体系参见表1。
国际组织GMP的对象是其成员国,以欧盟为例,由欧盟委员会以指令方式发布的法规文件——《关于制定人用药品的GMP原则和指导方针》,对人员、厂房、设备、文件、生产、质量控制、合同、用户投诉、产品收回和自检等内容提出原则和方针,要求成员国执行与该指令一致的法律、法规及行政规定。同时附有技术文件《欧盟GMP指南》以解释、细化GMP原则和指导方针,向成员国推荐。指南文字表述灵活 ......
您现在查看是摘要页,全文长 5600 字符。