《中华人民共和国药典(2015年版)》(四部)中微生物检验相关通则的增、修订情况介绍(1)
 |
摘 要 目的:介绍《中华人民共和国药典(2015年版)》(四部)中微生物检验相关通则的主要增、修订情况。方法:比较本版和前版药典相关内容的主要差异。结果:本版药典中微生物检验相关通则体现了新的检验理念,在检验技术、检验方法、环境设施、培养体系和质量管理等方面均进行了增、修订。结论:本版药典中微生物检验相关通则更趋完善,已与国际全面接轨。
关键词 《中华人民共和国药典(2015年版)》 微生物检验 通则 增、修订
中图分类号:R921.2 文献标识码:C 文章编号:1006-1533(2016)07-0011-05
An introduction to the revision of microbiological test in the general principle of the Pharmacopoeia of the People’s Republic of China (2015 version) volume IV
FENG Zhen*, FAN Yiling, YANG Meicheng**
(Division of Antibiotics, Shanghai Institute for Food and Drug Control, Shanghai 201203, China)
ABSTRACT Objective: To systematically introduce major supplement and revision in the general principle of the Pharmacopoeia of the People’s Republic of China (Chinese Pharmacopoeia) (2015 version) volume IV. Methods: The main differences between Chinese Pharmacopoeia (2010 version) and Chinese Pharmacopoeia (2015 version) were compared. Results: New ideas in microbiological test were established in Chinese Pharmacopoeia (2015 version), and supplement and updating amendment were carried out in testing technology and methods, environmental facilities, culture media and quality management. Conclusion: The general principle related to microbiological test in Chinese Pharmacopoeia (2015 version) is tending to be perfect and has achieved the international pharmaceutical standard.
KEY WORDS Pharmacopoeia of the People’s Republic of China (2015 version); microbiological testing; general principle; revision
微生物污染是影响药品质量和安全性的主要因素之一。《中华人民共和国药典(2015年版)》(以下简称为“2015年版《中国药典》”)已自2015年12月1日起正式实施,其中的微生物检验相关通则实现了全药典的统一,形成了比较完备的药品微生物检验标准体系。2015年版《中国药典》(四部)中的微生物检验相关通则已与国际全面接轨,在多个方面与主要发达国家药典保持了协调一致,对药品中污染菌的控制、杀灭、检出、鉴定以及微生物检验的环境控制、实验室质量管理等均作出了更明确的要求和说明。2015年版《中国药典》(四部)中微生物检验相关通则的增、修订体现了近年来我国药品微生物检验领域的新理念、新方法和新技术,现将此部分的主要增、修订情况介绍如下。
1 微生物检验新理念
2015年版《中国药典》(四部)中微生物检验相关通则的总体要求体现了新的检验理念。由于药品中微生物污染的来源复杂且存在不均匀性,故本版药典规定无菌、微生物限度的检查结果为不符合规定时不得复试,仅在充分证明试验结果无效后方可重试;同时,强调不仅需要关注检验方法本身,还应重视菌种管理、控制菌鉴定、环境设施及性能、培养基质量控制和实验室生物安全性等多个方面,以保证每次检验结果的准确、可靠。因为有限数量的检验样品情况不能代表整批药品的情况,所以无菌、微生物限度等的检验结果并不能完全反映全部药品的实际微生物污染情况。鉴于此,2015年版《中国药典》微生物检验标准体系致力于推动药品微生物检验实验室从简单的终产品检验实验室向微生物风险调查分析型实验室方向发展。
2 微生物检验相关通则的基本情况
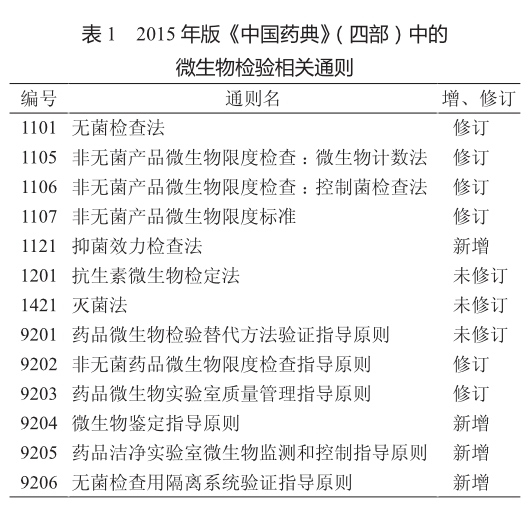
2015年版《中国药典》(四部)中的微生物检验相关通则较前版药典相关附录有较大的变化,其中新增了4则通则、修订了6则,仅3则通则未作修订。增、修订后,微生物检验相关通则总数达13则(表1)。
3 增、修订情况
下面简要介绍本版药典中微生物检验相关通则的增、修订情况,其中对药品检验工作中最为常用的无菌和微生物限度这两个检查项目所涉及的通则进行相对较为详细的论述。, http://www.100md.com(冯震 范一灵 杨美成)