一种简便快速的聚合酶活性实时检测新方法(1)
 |
| 第1页 |
 |
 |
参见附件(501KB,5页)。
摘 要:基于双链DNA结合染料能特异嵌入双链DNA发出荧光的原理,发展了一种实时检测DNA聚合酶活性的简便方法。在检测过程中,聚合酶的聚合反应进程被实时转换为荧光信号,通过监测荧光强度的变化实时检测聚合酶的活性及药物对聚合酶活性的影响。该方法不需要对DNA进行放射性同位素标记和荧光标记。也不需要聚丙烯酰胺凝胶电泳和聚合酶链式反应,是一种简便、快速的聚合酶活性实时检测新方法,为研究抗肿瘤药物对聚合酶活性的影响提供了一种简捷方法,也将为相关疾病诊治和药物筛选提供一种新的思路。
关键词:聚合酶;双链DNA结合染料;实时监测;活性
中图分类号:Q55
文献标识码:A
文章编号:1007-7847(2006)02—0113—05
聚合酶作为一种重要的工具酶,广泛应用于基因测序,载体制备及基因克隆等一系列重要的分子生物学技术之中,而且由于其在核酸的复制、修复、重组等生命过程中的重要作用,聚合酶已成为引人注目的药物靶标,特别是聚合酶活性的检测对肿瘤诊断和治疗疗效观察有重要的价值,有望成为一种有前途的肿瘤标记物。目前研究聚合酶活性的传统方法主要是放射性同位素标记结合凝胶电泳,操作复杂费时,也不能提供实时信息。近来发展了一些不需放射性标记的新方法用于聚合酶活性的研究,如PCR的方法能实时研究耐高温聚合酶,但是对不耐高温的聚合酶则不能有效分析;BrakmannS等和SummererD等发展的标记dNTP的方法和标记寡核苷酸的分子信标方法,需要对聚合酶反应的底物直接进行荧光标记,实验成本较高;另外,Tveit应用染料Picogreen检测DNA聚合酶活性,无须对底物标记,但这种染料是昂贵的,而且采用的是终点测定法研究酶活性,无法提供实时、动态的聚合过程及酶活性信息。
本文发展了一种简便、快速的聚合酶活性实时检测新方法。基于引物延伸反应和双链DNA结合染料实现了聚合酶活性的实时研究,操作简单、快捷、成本低。用此方法我们实时监测了一种广泛应用于生物医学工程领域的Klenow Fragment(exo-)(简称KF-)DNA聚合酶的活性,并研究了3种常用的抗肿瘤药物对其活性的影响。这种简便的聚合酶活性检测方法有望为临床疾病诊治和药物筛选提供一种新的思路和方法。
1 材料与方法
1.1 材料
引物及模板由大连宝生物公司合成,序列见表1,KF-(5U/μL,Fermentas),SYBR Green I(上海开放科技有限公司),dNTP Mixture(Takara),Tris(Sigma),二硫苏糖醇DTY(Bebco),丙烯酰胺(Sigma),甲叉双丙烯酰胺(Sigma),尿素(BBl),其它试剂均为国产分析纯.实验所用水均为过滤除菌的高纯水,实验器皿均经过高温灭菌。
1.2 方法
1.2.1 荧光测定
荧光测定在美国Perkin Elmer LS-55荧光分光光度计上进行,本文选用双链DNA结合染料SYBR Green I,荧光强度的测定用497 nm光激发,在520 nm处检测,仪器的入射狭缝与发射狭缝都设为2.5 nm,美国Amersham恒温水浴控制反应温度均为37.0℃,样品的反应体积均为200μL。
1.2.2 实时监测聚合酶的活性
配制溶液A:50mmol/L Tris-HCl(pH 8.0),5mmol/L MgCI2,1mmol/L DTY,50μmol/L dNTPMixture,1×的SYBR GreenI,100nmol/L的模板N1和100nmol/L引物N2.在荧光分光光度计上待溶液荧光值稳定后,再加入2.5U的KF-,实时监测荧光强度的变化。同时配制了3种对照溶液B、C、D,来验证KF-的活性,溶液B、C、D与溶液A相比,分别未加KF-、MS2+离子和dNTP Mixture,加入2.5U的KF-后,实时监测荧光强度的变化。
1.2.3 变性聚丙烯酰胺凝胶电泳
使用传统电泳方法来验证聚合反应,上述4种反应样品在95℃变性5min,然后在0℃骤冷5s,用含7%尿素的20%变性聚丙烯酰胺凝胶电泳并银染分析,银染步骤参照文献进行。
1.2.4 聚合酶活性定量分析
改变溶液A中加入的KF-的量,使其终浓度分别为25、20、12.5、7.5、5、2.5、1.25U/mL,并实时监测荧光强度的变化,按文献计算反应初速度,得出聚合反应初速度与酶浓度的相关性。
1.2.5 聚合酶延伸特异性实验
将溶液A中的100nmol/L的引物N2片段分别换为等量的3'端单碱基不匹配引物N3、N4、N5,配制溶液E、F、C,分别加入2.5U的KF—后,实时监测荧光强度的变化,并将反应初速度进行归一化处理,研究聚合酶延伸的特异性。
1.2.6 抗肿瘤药物对聚合反应的影响
在溶液A中分别加入不同浓度的博莱霉素、丝裂霉素或顺铂抗肿瘤药物,然后再加入2.5U的聚合酶KF-,实时监测荧光强度的变化,计算它们的反应初速度,并以在相同条件下,不加药物的聚合酶KF-的反应初速度作为对照,探讨药物对聚合酶活性的影响作用。
2 结果与分析
2.1 原理
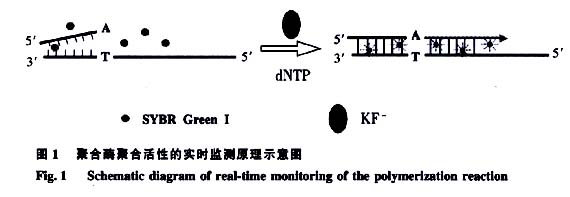
染料对聚合酶活性的实时监测原理如图1所示。DNA聚合酶按模板DNA上的核苷酸顺序,将互补的dNTP逐个加到引物3'-OH末端,并促进3'-OH与dNTP的5'-P04形成磷酸二酯键,从而延伸聚合DNA链。同时双链DNA结合染料(SYBRGreen I),与新生的双链DNA结合,发出荧光。随着聚合反应的进行,嵌人双链的染料增多,荧光信号增强,从而实现聚合酶活性的实时监测。
2.2 实时监测聚合酶的活性
聚合酶KF—活性的实时监测见图2。图中曲线1是在溶液A中加入KF-的荧光强度的时间扫描图,在t0处加入KF-后,发现随着时间的增加,荧光强度逐渐增强。这是由于在聚合酶作用下,dNTP被逐个加到引物的3,末端,形成双链,与此同时,染料SYBR Green I嵌入双链,产生持续增强的荧光,这与上述原理所述一致。在溶液中不存在KF—,Mg2’离子和dNTP Mixture的情况下(溶液B、C、D),在t0处加入KF-后,荧光强度没有明显的变化(曲线2-4),说明在这些溶液中没有聚合反应发生,也说明了KF—聚合酶必须有Mg2+离子,dNTP Mixture的参与才能发挥酶活性。以上结果表明,曲线1中的荧光强度的增强确实是由于模板与互补引物在聚合酶KF-的作用下发生了延伸反应。
在实验中还设计了传统的变性聚丙烯酰胺凝
您现在查看是摘要介绍页,详见PDF附件(501KB,5页)。