小肽基因合成及其串联体表达载体的构建(1)
 |
| 第1页 |
 |
 |
参见附件(547KB,5页)。
摘 要:以人表皮生长因子为研究对象,分3段合成了hegf基因片段,运用套叠PCR技术进行连接,形成全长hegf(159 bp)并克隆到酵母表达载体pGAPZα-A中,利用同裂酶技术构建串联体表达载体,获得了分别含2、3、4拷贝的串联体表达载体pGAPZα-2hegf、pGAPZα-3hegf和pGAPZα-4hegf,为下一步进行基因表达及其生物学活性分析奠定了基础。
关键词:hegf基因合成;串联体;载体构建
中图分类号:Q782
文献标识码:A
文章编号:1007-7847(2007)01-0033-05
表皮生长因子最初由Cohen及其同事从小鼠颌下腺分离得到,后在人尿中分离得到,人表皮生长因子(hEGF)是由53个氨基酸组成的小分子多肽,含有3个链内二硫键,结构稳定,研究表明,hEGF具有多种生物学功能,它通过与细胞膜上hEGF受体结合,促使细胞内部发生一系列复杂的生化级联反应而发挥生理作用,如它可促进细胞分裂,修复皮肤创伤、胃肠溃疡、角膜损伤等;防止皮肤衰老,起到美白嫩肤的作用;靶向性结合含高密度hEGF受体的肿瘤组织,大剂量的EGF还能抑制某些癌细胞的生长,商品化的hEGF具有很高的市场价值,且市场需求量大,提高其表达量及生物学活性可广泛用于临床,满足市场的需要。
利用基因重组技术是大量制备活性多肽的有效方法,通常将少于100个氨基酸的肽称为小分子多肽,由于其相对分子质量较小,在体内易被迅速水解,半衰期短,因此在克隆、表达等都会碰到不少困难,本研究利用套叠PCR技术合成了hegf基因,在构建酵母分泌型表达载体时,采取多拷贝串联构建,并在各拷贝间引入kex2蛋白酶切位点,以便在毕赤氏酵母中表达时能切割形成单个的hEGF分子,本研究探索了基因合成方法和小分子多肽表达载体构建策略,为实现小分子多肽在体外的高效表达提供了参考依据,并为hEGF在酵母中串联表达奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株
菌株E.coli DH5α由本室保存,菌株ToplOF’、载体pGAPZα-A购自Invitrogen公司,pMD18-T vector购自TaKaRa公司。
1.1.2 生化试剂
Taq聚合酶、T4-DNA连接酶、Xho I、Xba I购自TaKaRa公司,AvaⅢ、Pst I购自Fermentas公司,DNA Maker购自Tiangen公司,UNIQ-10柱式DNA胶回收试剂盒购自生工生物工程(上海)有限公司,其他试剂均为国产分析纯。
1.1.3 基因片段与引物
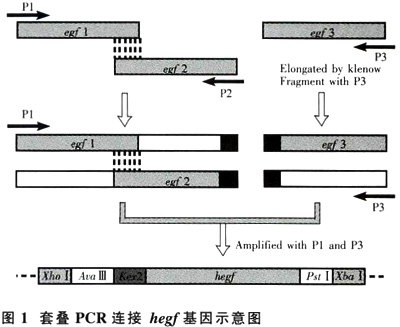
选用毕赤酵母偏爱密码子,根据NCBI上报道的序列(E02089)分3段合成hegf基因:1)hegf基因片段1(hegfl):aac tcc gac tct gaa tgc ccg ctgtcc cac gat ggt tac tgc ctg cac gac ggc gtt tgt atg;2) hegf2:ctg ccg caa aca tac ata tag ctc cgc gac ctg tttata cgc aca ttg aca cat cat ccg atg;3)hegf3:tgt gta gta ggc tac atc ggc gaa cgc tgc cag tac cgt gac ctg aaatgg tgg gaa ctg cgc;4)引物l(P1):g ctcgag atgcataagaga aac tcc gac tct g;5)引物2(P2):t gta gcc tactac aca gtt ac;6)引物3(P3):t tctaga ctgcag gcg cagttc tea cc.hegf2片段划线部分分别与hegf1和hegf3划线部分互补,引物P1和P3分别引入XhoI和Xba I酶切位点,基因片段及引物均由生工生物工程(上海)有限公司合成。
1.2 方法
1.2.1 套叠PCR连接egf1和egf2基因片段
利用egf1和ear2部分互补及引物P1和P2,在同一个PCR反应中,采用不同的退火温度,先使egf1和egf2延伸,再用P1和P2进行扩增,得到egf1-ear2片段,PCR程序如下:94℃5min;94℃30s,41℃30s,72℃30s,10个循环;94℃30s,53℃30s,72℃30s,25个循环;72℃7min;4℃+∞。
1.2.2 egf3互补链的产生
在P3引物存在下,利用Klenow Fragment在37℃延伸3h,使egf3形成互补链。
1.2.3套叠PCR连接egf1-egf2和egf3片段
利用两个片段的互补及引物P1、P3,如1.2.1采用不同的退火温度扩增得到hegf全长,PCR程序如下:94℃5 min;94℃30s,39℃30s,72℃30s,10个循环;94℃30s,53℃30s,72℃30s,25个循环;72℃7min;4℃+∞。
1.2.4 pGAPZα-hegf的获得
先将hegf克隆到pMD18-T vector并转化DH5α,大量提取质粒后,利用Xho I和Xba I将hegf克隆到pGAPZα-A,并转化Top1OF’。
1.2.5 串联表达载体的构建
利用同裂酶AvaⅢ(ATGCA↓T)和Pst I(cTGCA ↓ G)酶切重新连接后形成ATGCA l G而不再被AvaⅢ和Pst I识别的特点,利用Xho I和AvaⅢ酶切pGAPZα-hEGF回收大片段,用Xho I和Pst I酶切pGAPZα-hegf回收小片段,再用T4-DNA连接酶连接大小片段,构建二拷贝载体pGAPZα-2hegf,同样原理,利用Xho I/AvaⅢ和Xho I/Pst I酶切pGAPZα-2hegf,再用连接酶连接可得到pGAPZα-3hegf和pGAPZα-4hegf。
2 结果
2.1 套叠PCR扩增结果
hegf基因片段在引物P1和P2作用下,采用不同的退火温度,得到egf1-egf2片段(如图3,泳道1),回收产物与egf3延伸产物在P1和P3扩增
2.2 克隆载体构建结果
将hegf基因克隆到pMD18-T vector中,并转化大肠杆菌DH5α,经过菌液PCR鉴定和Xho I、Xba I双酶切鉴定(如图4),得到阳性克隆,并选择一个阳性克隆送至宝生物工程(大连)有限公司进行测序分析,结果显示序列与预定序列一致,
2.3 hegr表达载体构建结果
您现在查看是摘要介绍页,详见PDF附件(547KB,5页)。