瘦素对脂肪细胞的直接调节作用(2)
 |
 |
1.1材料:无内分泌及代谢性疾病的成人上腹部皮下脂肪组织,重组人瘦素(Pepro TechUSA),胶原酶IV(Gibco USA),转铁蛋白、生物素、泛酸钙、胰岛素(Sigma USA),脂肪酸和甘油试剂盒(北京普利莱基因技术有限公司)等。
1.2 培养液的配制:①培养液a:DMEM/F12(1∶1)混合培养液(含10%FBS、33μmol/L生物素、17μmol/L泛酸盐、10万IU/L青霉素和100mg/L链霉素);②培养液b:DMEM/F12(1∶1)混合培养液(含33μmol/L生物素、17μmol/L泛酸盐、10万IU/L青霉素和100mg/L链霉素,5mg/L 胰岛素、10mg/L转铁蛋白、10μg/L bFGF)
1.3 人前脂肪细胞培养:常规培养人前脂肪细胞:切取人上腹部皮下脂肪组织,DMEM培养液(含100U/ml青霉素,100mg/ml链霉素)浸泡脂肪组织10min,剔除肉眼可见的血管和筋膜等其他组织;Hank’s液(含100U/ml青霉素,100mg/ml链霉素)冲洗3遍后移入无菌的三角烧瓶,眼科剪剪成直径约1mm的小组织块,加入0.2%胶原酶IV 37℃水浴消化10min,含10%FCS的DMEM培养液终止消化。100目、200目不锈钢筛网先后过滤,取细胞悬液,离心(1 700rpm 10min)后弃上清;加入0.16mol/L NH4Cl作用10min,Hank’s液(含100U/ml青霉素,100mg/ml链霉素)洗涤2次后离心(1 700rpm10min),弃上清。培养液a悬浮细胞,按1×105个/ml浓度接种于12孔板,置37℃、5%CO2培养。每日观察,每2天换液一次。
, http://www.100md.com
1.4 前脂肪细胞向脂肪细胞的诱导
1.4.1脂肪细胞诱导:参考目前常用诱导方法[6-7],待前脂肪细胞生长融合后,PBS洗涤细胞2次,用无血清的培养液b于37℃、5%CO2诱导培养。每天观察,每2天换液一次。诱导培养一周后行下一步实验。
1.4.2 脂肪细胞鉴定:称量1.4g油红O充分溶解于400ml异丙醇,室温静置过夜,过滤后为贮存液,避光保存。工作液按3倍体积贮存液加入2倍体积蒸馏水临时配制。
油红O染色:吸去培养液,PBS漂洗2次,10%甲醛固定30min,滴入2ml油红O工作液浸染15min。弃油红O工作液,PBS漂洗1次,光镜下观察。1.5 脂肪细胞分组:脂肪细胞诱导分化后,培养液a培养于37OC、5%CO2。随机分为四组:正常对照组、低浓度组、中浓度组、高浓度组,接种于12孔板,每组10孔。培养液中瘦素终浓度正常对照组0ng/ml,低浓度组10ng/ml,中浓度组100ng/ml,高浓度组1 000ng/ml。培养4h后取各组培养液按试剂盒说明检测游离脂肪酸和甘油浓度。收集脂肪细胞行油红O染色,拍照后图像分析。
, 百拇医药
1.6培养液中游离脂肪酸浓度检测:按试剂盒步骤检测各组培养液中游离脂肪酸浓度。游离脂肪酸经过有机抽提和铜皂化,进行显色反应,用分光光度计测定546nm OD值,对照标准曲线计算游离脂肪酸浓度。
1.7 测定培养液中甘油浓度:采用GPO Trinder酶学反应,操作按试剂盒说明进行,最后用分光光度计在505nm波长测定各组OD值,绘制标准曲线计算甘油浓度。
1.8 脂肪细胞中脂肪颗粒积分光密度测定:收集各组脂肪细胞行油红O染色,然后沿各孔垂直、水平径在光镜下对染色后的细胞进行拍照,每孔9张。应用Image-pro plus图像分析软件测定脂肪细胞中脂肪颗粒的积分光密度。
1.9 统计学分析:结果以均数±标准差(x±s)表示,应用 SPSS12.0统计软件行单因素方差分析,组间参数两两比较行t检验。
2结果
, 百拇医药
2.1 人前脂肪细胞的培养观察:细胞接种后可见大量漂浮的圆形细胞,24h后大部分细胞贴壁。初期细胞体积小,呈纺锤形或梭形,核浆比例大,仍有少数细胞未帖壁;换液后悬浮细胞渐被弃去,剩下贴壁生长的前脂肪细胞。7天左右细胞生长至融合,核浆比例减小,部分可见核分裂相(图1)。
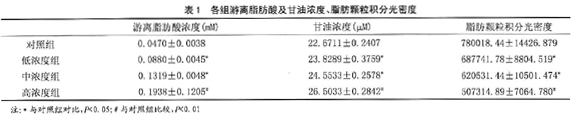
2.2 前脂肪细胞向脂肪细胞诱导分化和鉴定:加入无血清的培养液b后,前脂肪细胞停止增殖,形态由纺锤形或梭形逐渐膨胀,变成椭圆形和圆形,体积增大。48h后细胞内可以观察到圆形颗粒,颗粒每日增多,一周后达到高峰。细胞膜出现皱折,轮廓变淡。此时行油红O染色,可见大小不等的橘红色脂肪颗粒(图2)。
2.3各组游离脂肪酸及甘油浓度、脂肪颗粒积分光密度的检测,见表1。
瘦素作用4h后,各组培养液中游离脂肪酸、甘油浓度及脂肪细胞脂肪颗粒积分光密度检测结果如表1所示。与正常对照组相比,低浓度组、中浓度组、高浓度组游离脂肪酸、甘油浓度均明显增加,差异有统计学意义(P, 百拇医药(巫国辉 赵 锋 袁 铿 李小林)