玻璃化冻存骨髓基质干细胞的实验研究(2)
 |
 |
 |
 |
1.2方法
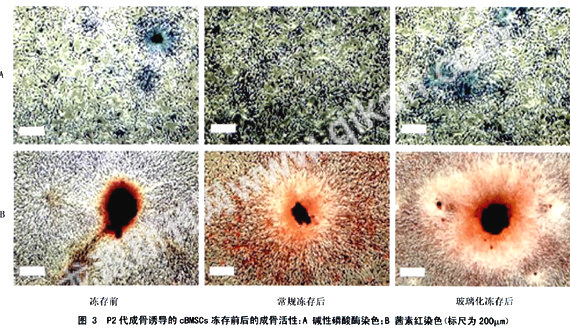
1.2.1 cBMSCs的分离和体外诱导培养:将实验犬以5 %的戊巴比妥钠(0.5ml/Kg)麻醉后,抽取骨髓2.5ml。根据以前报道的方法[2]进行Percoll液的配制和犬骨髓单个核细胞的分离提纯。将原代细胞接种培养48h后开始应用含有地塞米松(10mmol/L)、β-磷酸甘油钠(2.16g/L)和2-磷酸抗坏血酸(37.5mg/L)的成骨条件培养液,置37℃、5% CO2的培养箱内进行成骨诱导培养。细胞培养至第8天,细胞克隆形成单位的中心生长达密集时用0.25 %胰蛋白酶-0.02%EDTA进行第1次传代[3]。以1.6×104/cm2的细胞密度接种,培养至P2代。
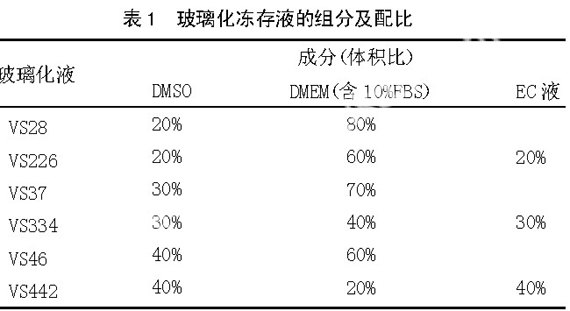
1.2.2 冻存液的制备:常规冻存液由体积比为10%二甲基亚砜(DMSO)、50%胎牛血清(FBS)和40%细胞培养液(DMEM)组成;根据文献[4]制备玻璃化液VS55;其它玻璃化液参见表1(根据文献[4]制备EC液)。
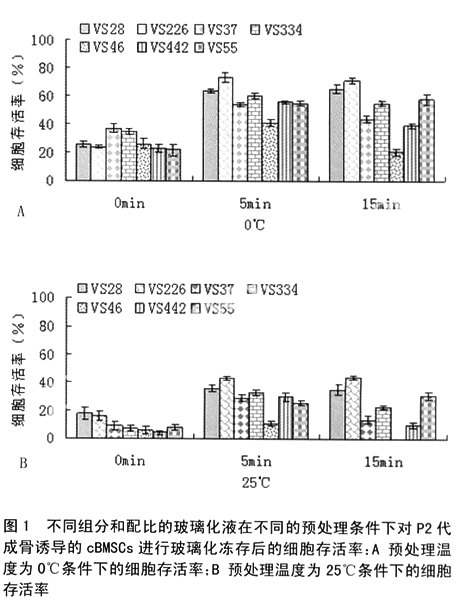
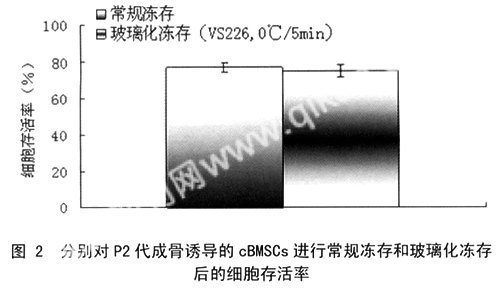
1.2.3细胞的深低温保存方法:①常规冻存:将P2代成骨诱导的cBMSCs消化离心后倒除上清液,用0.5ml常规冻存液重悬并置入2ml冻存管中,先在4℃预冷30min,再置于-20℃ 2h,经过24h的-80℃保存后投入液氮(-196℃);②玻璃化冻存:将同样方法获得的细胞用同体积的玻璃化液重悬于冻存管中,经过不同的预处理方案,包括将冻存管放入冰水混合物(0℃)中或置于室温(25℃)下分别保持5min或15min后再直接投入液氮 ......
您现在查看是摘要页,全文长 5697 字符。