固体脂质纳米粒的研究及应用(1)
 |
 |
摘要:固体脂质纳米粒(SLN)作为新型的脂质药物传输载体而备受关注。现报告本课题组的研究,结合复习文献对SLN的基因传递、蛋白多肽类药物非注射给药、难溶性药物增溶及靶向给药系统的研究和应用作一综述。
关键词:固体脂质纳米粒;基因传递;蛋白多肽类药物;靶向给药系统
中图分类号:R912文献标识码:A文章编号:
1672979X(2009)07005704
固体脂质纳米粒(solidlipidnanoparticles,SLN)又称为固体脂质体,是一种室温下为固态的天然或合成的脂质或类脂。作为新型的亚微粒胶体给药系统,其研究始于20世纪90年代[1],如以卵磷脂、三酰甘油等为基质,将药物包裹于类脂核中制成粒径约50~1000nm的固体脂质粒子给药体系。SLN主要适于包裹难溶性药物,用作静脉注射或局部给药,还可作为靶向定位和控释作用的载体[2]。相对于常见的药物载体,如脂肪乳、脂质体、聚合物纳米微粒等存在的热力学不稳定、毒副作用大和易被单核吞噬细胞系统消除等问题[3],SLN作为药物传递系统载体,具有生物相容性好、可生物降解、载药能力强、物理化学存储稳定、对靶器官有特异趋向性、成本低和利于大规模生产等优点。近年国内外越来越多的研究人员对SLN用作药物载体开展了大量研究。本课题组也对SLN进行了研究。现对SLN应用于大分子药物如基因、多肽等,及小分子药物如抗癌新药托氟啶和抗风湿药物阿克他利的研究作一综述。
, 百拇医药
1SLN用于基因传递
作为生物大分子的载体,SLN可用于口服、注射、肺吸入等多种途径,适合多肽与蛋白质、DNA等各类治疗药物。经口或肺吸入途径用药,改善纳米粒的黏膜黏附性,有助于提高有效性和延长作用时间[4]。用以基因治疗,纳米粒不仅稳定地包合基因,而且能同时包合某些导靶片断及其它辅助成分,提高靶向性、基因细胞穿透性或细胞内吞作用[5]等。
基因治疗中,裸露的外源基因DNA易被机体或细胞降解,难以准确表达,因此基因治疗的成功很大程度上依赖于开发出安全高效的基因载体[6]。研究表明,非病毒载体的安全性优于病毒载体,且具有能包裹较大的核酸分子,可大规模生产和无免疫原性等优点,因而成为重要的研发方向。常用的非病毒载体包括脂质体和阳离子多聚物,但二者的自身毒性和稳定性差,限制了其临床应用。鉴于现有非病毒载体的不足,近年人们逐渐将目光投向了纳米载体系统,SLN凭借其优势成为新一代具有良好发展前景的新型给药系统。基因载体的粒径和带电性质是影响其细胞毒性和转染率的重要因素[7]。本课题组分别构建了阳离子型和阴离子型SLN作为基因载体,控制载体粒径以增强细胞的内吞作用,并调整了其带电性质和带电量以降低细胞毒性,提高最终的转染率。
, 百拇医药
1.1阳离子型SLN
阳离子脂质体是目前较成熟的非病毒型基因载体,已有多种商品化转染试剂上市[8]。阳离子脂质体稳定性相对较差,与质粒DNA的相互作用难以控制,往往导致大量聚集物形成,体内应用时,其转染效果还取决于给药途径。
阳离子SLN具备阳离子脂质体特性,且体内外稳定性更好,易工业化大生产[9]。与其他阳离子型基因载体类似,阳离子SLN能与带负电的DNA通过静电引力结合成SLNsDNA复合物,增加DNA稳定性,易与带负电的细胞膜结合,促进细胞内吞,最终将DNA导入胞内[10]。本课题组首次利用杂合纳米技术向阳离子SLN体系引入毒性小,生物相容性好的Ca2+。Ca2+能诱导阳离子脂质体DNA复合物中部分缩合的DNA分子再缩合,使阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)的用量控制在细胞可耐受范围,解决了阳离子SLN由于自身电正性所引起的细胞毒性问题[11]。体外基因转染实验表明,阳离子SLN能将绿色荧光蛋白基因成功递送到细胞内,虽在24h内的表达率较阳离子脂质体低,但随着时间延长,48h时表达绿色荧光强度增强,与商品化阳离子脂质体24h转染效果相当,证明了阳离子SLN用作基因递送载体的可行性(图1)。
, 百拇医药
A、B为裸DNA24h和48h的转染结果;C、D为Lipofectamine24h和48h的转染结果;E、F为SLNspDNA24h和48h的转染结果[HT5"H]图1不同载体携带pEGFP在COS7细胞中体外转染结果
1.2阴离子型载基因三元复合纳米粒
本课题组构建的阳离子SLNDNA复合物由于正电性限于肺部等局部给药方式,不适合静脉注射给药。因此,我们制备阴离子型SLN,以期克服阳离子载体的上述不足。
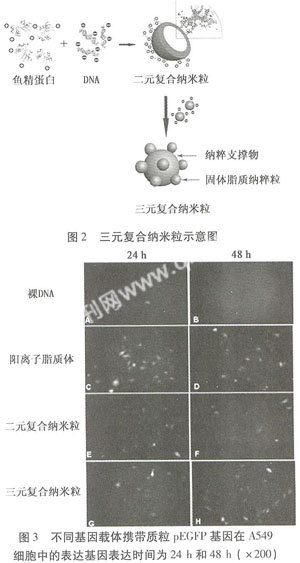
利用FDA已批准可供临床使用的鱼精蛋白(protamine)作为聚阳离子对DNA缩合,不仅能压缩DNA伸展的长链,提高其抗剧烈外力的能力,而且鱼精蛋白可作为核定位信号促进内吞体逃逸,增强基因的体内外转染率[12]。将该复合物包裹于SLN,制得载鱼精蛋白DNA复合物的SLN,包封率高达(86.5±5.28)%,其独特的“核壳”结构以及鱼精蛋白与DNA紧密结合使DNA释放缓慢,具有明显的长效缓释能力[13]。在此基础上,我们以制备阴离子型载基因SLN为目的,设计了三元复合荷DNA纳米粒[14]。
, 百拇医药
选用粒径150~200nm的鱼精蛋白DNA二元复合物作为内核支撑,20nm小粒径阴离子型SLN作为可吸附物,分子自组装制备阴离子型荷基因三元纳米复合物(图2)。体外转染实验结果(图3)显示,48h转染量接近Lipofectamine组,明显高于二元复合物组。本课题组构建的阴离子型载基因三元复合纳米粒是对阴离子型SLN作为基因载体研究的完善和补充。三元复合纳米粒在综合了包封型SLN优点的同时,具有更明显的穿越生理屏障的功能优势,拓展了该类载体在基因转染方面的应用,其相关研究在国内外尚未见报道[14]。
2SLN用于多肽和蛋白质类药物非注射给药系统
2.1口服给药系统
开发多肽和蛋白质类药物的口服给药系统是各国多领域科学家积极研究的方向之一[15]。研究发现,微粒给药系统的组成及结构对多肽的吸收有非常重要的作用。SLN用于口服给药,可以控制药物在胃肠道的释放,并可保护多肽药物免受降解,增加药物的生物利用度[16]。胰岛素作为Ⅰ型糖尿病的一线降糖药物,口服易在胃肠道降解,且难以通过生物膜吸收,通常以注射方式给药。胰岛素的纳米粒化技术给药,旨在提高药物的稳定性,增加非注射给药的生物利用度,实现药物的体内缓释和长效,解决长期连续注射所致患者顺应性差的问题。
本课题组制备包载胰岛素的SLN(InsSLNs),利用可特异性识别细胞膜糖脂或糖蛋白糖链上不同糖基的麦胚凝集素(WGA)作为定位因子,修饰InsSLNs。小鼠和大鼠灌胃给予SLNs,结果表明InsSLNs能促进胰岛素口服吸收,具有一定的降血糖效果。WGA修饰则显著促进了胰岛素的吸收,证实了凝集素的靶向作用和吸收促进作用。但其相对生物利用度仍较低,WGA修饰SLNs作为生物大分子药物口服给药系统尚需进一步研究。, http://www.100md.com(刘春喜 张 娜)