低温时蛙皮素对IL-1β致热大鼠的降温作用及与PGE2的相关性
蛙皮素(bombesin,BN)是由14个氨基酸组成的神经肽,广泛存在于包括人在内的哺乳动物体内。动物研究表明,BN具有强烈的降温作用[1];BN的降温作用与环境温度密切相关,低温下降温作用更加显著[2]。目前对BN的研究主要集中于环境温度对其解热作用的影响,而有关其解热机制尚未做深入研究。
本室在先期研究中已经证实,无论是白细胞介素-1β(IL-1β)性发热的大鼠,还是肿瘤坏死因子 α(TNF-α)性发热的大鼠,BN均可在常温下通过抑制下丘脑中环磷酸腺苷(cAMP)[3-5]和PGE2[6]的升高来降低其发热效应,且低温下的降温效应还与抑制cAMP的合成和释放有关[7]。本实验观察了低温下(4℃)侧脑室注射BN对正常大鼠及IL-1β致热大鼠体温的作用,并检测下丘脑组织、血浆PGE2含量的变化,以进一步探讨低温时BN的降温作用及与PGE2含量的关系,完善BN的降温机制研究。
1 材料与方法
, 百拇医药
1.1 材料
1.1.1 实验动物 SD大鼠,健康♂,体重180~220 g,中国医科大学实验动物中心提供。室温(20±2)℃,湿度(50±2)%,光照6:00~18:00,术后动物单笼饲养,自由进食、水。
1.1.2 药物与试剂 BN(AnaSpec公司);盐酸氯氨酮(上海第一生化药业公司);盐酸甲苯噻嗪(美国FAH公司);IL-1β(北京宝赛公司);PGE2放免测定试剂盒由上海中医药大学同位素室提供。
1.1.3 仪器 SN2202型数字温度计(精确度0.1℃,北京师范大学司南仪器厂);SN-2型立体定位仪(日本东京仪器厂);GAMMA maticⅡ型γ放射免疫记数仪(瑞典Kontron公司);LS-3801型液体闪烁记数仪(美国Beckman公司)。
1.2 实验方法
, 百拇医药
1.2.1 实验动物体温测量 数字温度计探头插入大鼠直肠6 cm,待数字稳定后读数(温度探头导线用胶条标记,避免操作中探头插入深度的误差)。实验前连续7 d给大鼠测温,以使其适应实验者手法。实验前1 h将大鼠放入4℃冰箱,测量体温,以给药前1 h测得的3次体温的平均值作为大鼠给药前基础体温,然后分别在给药后各时间点记录大鼠直肠温。将实验数据输入计算机进行数据处理,获得发热的潜伏时、最大体温反应高度(ΔT)和体温反应指数(TRI3),利用这些数据做发热标准曲线。
1.2.2 侧脑室插管及侧脑室给药 大鼠在盐酸氯氨酮和盐酸甲苯噻嗪的联合麻醉下,参照大鼠脑图谱,用立体定位仪向一侧侧脑室置入一P10~P20组合的脑室插管,用牙科水泥固定,生理盐水检测小管通畅后封闭插管顶端。常规、单笼喂养1周后,开始实验。经插管给药前,先将封闭的插管上端剪开,经侧脑室插管给药时,要注意给药速度保持一致(1 μl/s)。实验结束后,检查插管位置,舍掉插管位置不正确的数据。
1.2.3 实验分组 SD♂大鼠26只,随机分为4组,对照组用人工脑脊液10 μl/只,其余3组均用人工脑脊液配平至10 μl。见表1。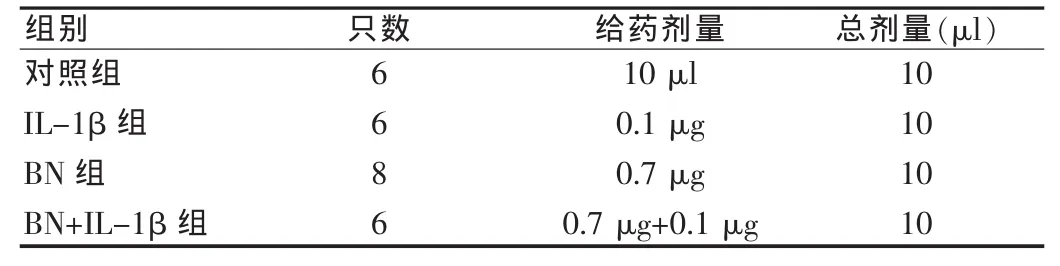
, 百拇医药
表1 实验动物分组Tab.1 The groups of laboratory animals
1.2.4 样品采集及PGE2含量测定 准备一次性空针吸取消炎痛-EDTA液约0.2 ml,根据体温测定描绘的温度曲线,分别在给药后体温峰值时脱臼法处死大鼠,于下腔静脉穿刺取血4 ml,即刻在空针内颠倒数次混匀,离心取上清,置-30℃冰箱中保存。以灰结节和视交叉的中心点为中心取下丘脑部组织即刻置液氮冷冻, 称取 3~5mg置无水乙醇(0.4ml)+生理盐水(1.6 ml)中匀浆(在冰浴中进行)、离心,将上清液吸出,置于-30℃冰箱中保存。PGE2含量的测定按试剂盒说明书进行操作。
1.3 体温反应指标及数据处理
体温反应指标用平均体温反应曲线表示,体温变化情况采用TRI3及ΔT表示,所有数据以均数±标准差(±s)表示,采用两样本均数比较的t检验,P<0.05表示差异有统计学意义。
, 百拇医药
2 结果
2.1 IL-1β体温反应曲线
向 SD♂大鼠侧脑室微量注射 IL-1β(0.1 μg)后,30 min内大鼠体温迅速升高,90 min左右达发热高峰[ΔT:(1.22±0.75)℃],300 min 时出现第 2 个发热高峰[ΔT:(0.95±0.32)℃],发热持续360 min开始下降。见图1。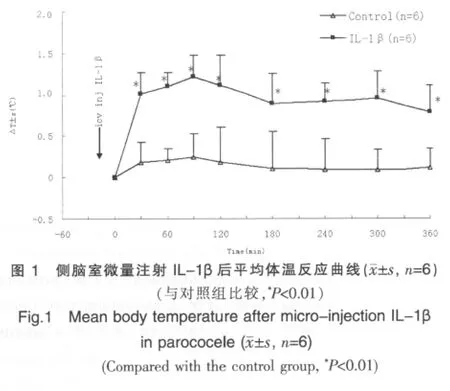
2.2 IL-1β、BN及BN+IL-1β体温反应曲线
侧脑室微量注射 BN(0.7 μg)后,体温迅速下降,30 min时即出现明显降低,45 min 时降至最低[ΔT:(1.93±0.30)℃],然后开始回升。IL-1β的升体温作用被预先给予的BN明显抑制,说明4℃下BN能够显著抑制IL-1β的升体温作用。见图 2、表 2。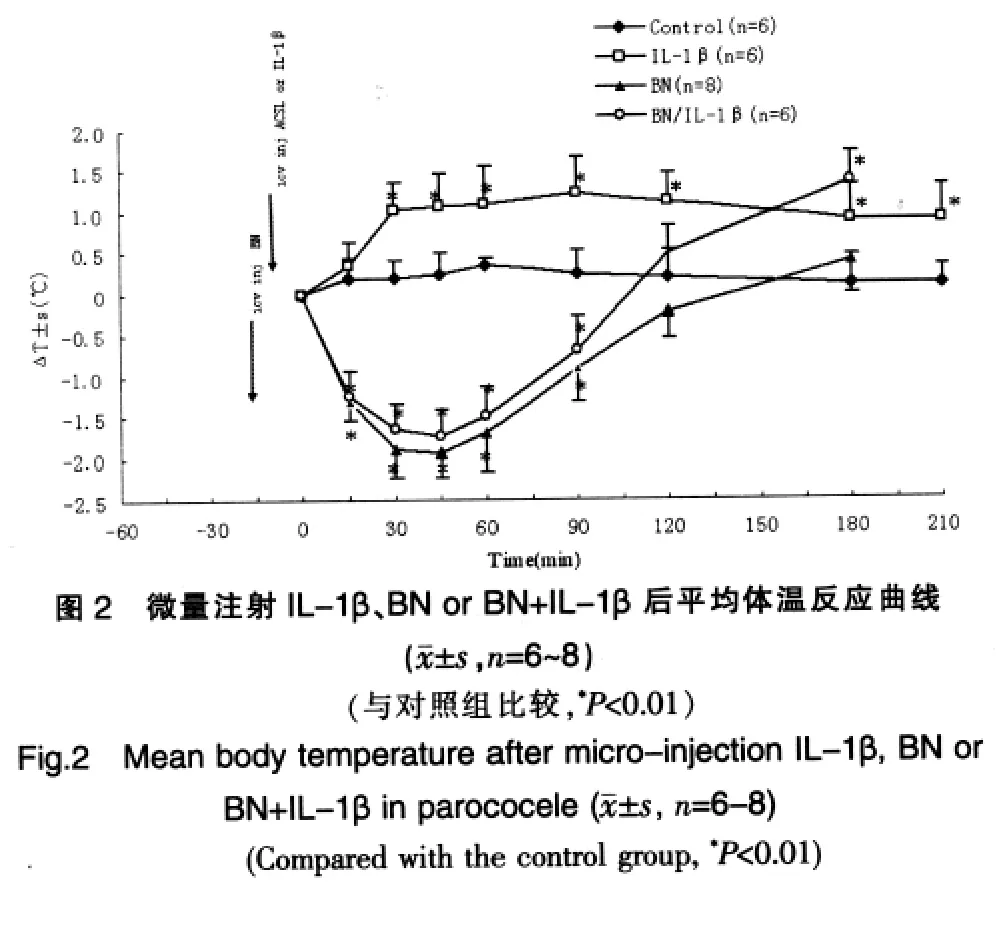
, http://www.100md.com
表2 大鼠微量注射给药后的最大体温变化(ΔT)及体温反应指数(TRI3)( ±s)Tab.2 Maximum body temperature change(ΔT)and TRI3 after micro-injection in rats( ±s)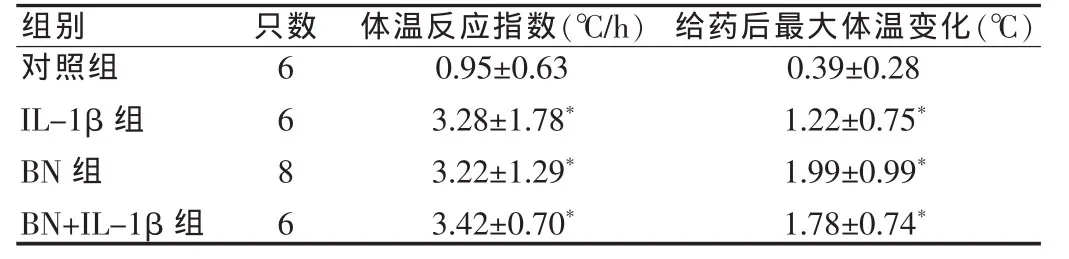
表2 大鼠微量注射给药后的最大体温变化(ΔT)及体温反应指数(TRI3)( ±s)Tab.2 Maximum body temperature change(ΔT)and TRI3 after micro-injection in rats( ±s)
与对照组比较,*P<0.01Compared with the control group,*P<0.01
, http://www.100md.com
组别 只数对照组IL-1β组BN组BN+IL-1β组6686体温反应指数(℃/h) 给药后最大体温变化(℃)0.95±0.63 3.28±1.78*3.22±1.29*3.42±0.70*0.39±0.28 1.22±0.75*1.99±0.99*1.78±0.74*
2.3 下丘脑及血浆PGE2含量
IL-1β组下丘脑和血浆PGE2含量与对照组相比均升高(P<0.01、P<0.01);而 BN 组 PGE2含量则均低于对照组 (P<0.01、P<0.05);在 BN+IL-1β 组 PGE2含量与 IL-1β 组相比均降低(均 P<0.01)。见表 3。
表3 下丘脑和血浆中PGE2含量( ±s)Tab.3 The content of PGE2in hypothalamus and plasma( ±s)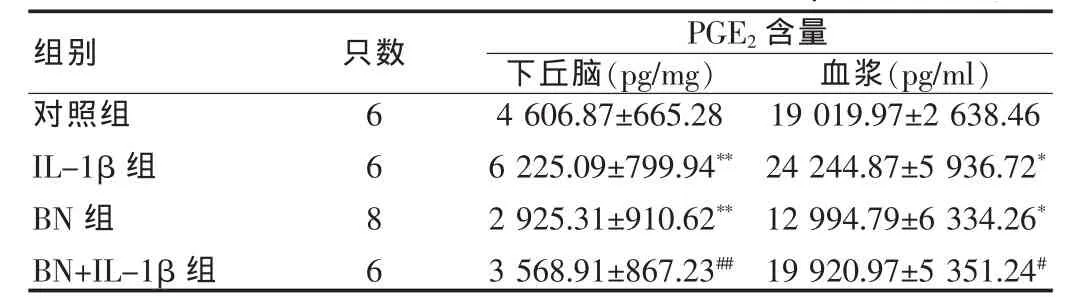
, 百拇医药
表3 下丘脑和血浆中PGE2含量( ±s)Tab.3 The content of PGE2in hypothalamus and plasma( ±s)
与对照组比较,*P<0.05,**P<0.01;与 IL-1β 组比较,#P<0.05,##P<0.01Compared with the control group,*P<0.05,**P<0.01;compared with the IL-1β group,#P<0.05,##P<0.01
组别 只数PGE2含量下丘脑(pg/mg) 血浆(pg/ml)对照组IL-1β组BN组BN+IL-1β组6686 4 606.87±665.28 6 225.09±799.94**2 925.31±910.62**3 568.91±867.23##19 019.97±2 638.46 24 244.87±5 936.72*12 994.79±6 334.26*19 920.97±5 351.24#
, http://www.100md.com
3 讨论
自1948年Beeson等发现内生致热原(EP)以来,40多年来人们对EP进行了系统深入的研究,取得了许多重要的进展[8]。学者们发现,许多外源性致热原如细菌、内毒素(ET)等并非直接作用于脑,而是通过激活产生EP的细胞,使后者产生和释放EP,EP再以某种方式引起发热。其中EP如何引起发热是人们关注的焦点。有学者推断EP可能是作用于PO/AH区,使体温调定点上移,产生发热反应[9]。有资料表明,多种物质可能在中枢参与或影响发热,如单胺类物质、CRH、棕色脂肪组织以及cAMP等[10-11]。近年来,PGE、中枢Ca2+以及阿片类物质的中介作用也受到了人们的关注[12-13]。
PGE2是否是发热的中枢介质在国内外一存在有争议。目前,许多研究者在对PGE2与发热关系的研究中,都试图通过EP或ET致热后中枢PGE2含量增加与否来说明其是否为中枢发热介质。以往的实验表明,在外周EP性发热的同时,脑脊液内PGE2的含量明显增加[12]。支持者认为是因为EP作用于下丘脑体温调节中枢,使其合成、释放PGE2增加而使调定点上移,引起体温升高,但尚无足够的证据证明EP能透过血-脑屏障,而且对IL-1能否自外周血进入脑内的验证取得阴性结果[14]。现在提出了新的假说,认为PGE的释放部位是在下丘脑终板血管区(OVLT)的有孔毛细血管外周的巨噬细胞,被EP激活的巨噬细胞释放PGE,后者作用于OVLT的神经元,或透过室管膜细胞的紧密连接而作用于POAH的神经元;也有一些资料不支持该假说。
, 百拇医药
本实验结果表明,低温下侧脑室注射IL-1β引起大鼠体温升高的同时,其下丘脑及血浆中PGE2的含量也均升高;低温下侧脑室注射BN可明显降低大鼠正常体温的同时,其下丘脑及血浆中PGE2的含量也随之降低;低温下侧脑室注射BN,明显抑制了大鼠IL-1β性发热反应的同时,其下丘脑及血浆中PGE2的含量也均降低。该结果较好地支持了以往争议中有关PGE2作为中枢发热介质的主张;提示低温下BN可能通过抑制PGE2的合成与释放降低大鼠正常体温和抑制IL-1β的致热效果。
目前,国内外对BN的体温调节作用多数停留在降温现象的描述阶段,未对BN的作用机制和新型解热药物的开发做进一步研究。我们通过研究低温下BN降温及翻转IL-1β致热作用与PGE2的关系为BN降温作用机制的阐明积累了资料。BN作用后下丘脑、血浆中PGE2含量显著降低,说明PGE2不仅可通过其含量的增加而在发热过程中起重要作用,也可在致冷原的作用下通过其含量的降低而起到降温作用。这可能是低温下BN降低体温的机制之一。
, http://www.100md.com
[1]鲁伟,陆大祥.蛙皮素与体温调节[J].中国病理生理学杂志,1997,13(4):443-447.
[2]Emel'yanova TG,Sosnovskaya IV,Guzevatych LS,et al.Effect of N-terminal tripeptides of bombesin,litorin,and their analogue on body temperature and vasomotor responses[J].Bull Exp Biol Med,2007,144(2):207-209.
[3]佟雷,张量,赵书芬,等.BN对IL-1β致热的抑制作用及POA和血中cAMP 的影响[J].中国药理学通报,2004,20(11):1239-1241.
[4]秦鑫,曹宇,赵书芬,等.纳络酮对IL-1β致热大鼠体温及下丘脑中cAMP和HSP70含量的影响[J].中国药理学通报,2006,22(10):180-183.
, http://www.100md.com
[5]刘利丹,李妍,赵书芬,等.热应激对大鼠TNF-α性发热及下丘脑中cAMP含量的影响[J].中国药理学通报,2005,21(9):1054-1057.
[6]张量,苏艳阳,赵书芬,等.蛙皮素对发热大鼠的降温作用及与PGE2的相关性[J].中国药理学通报,2008,24(9):1212-1215.
[7]张量,佟雷,赵书芬,等.低温时蛙皮素对IL-1β致热大鼠下丘脑和血浆cAMP含量的影响[J].中国临床药理学与治疗学,2005,10(12):1354-1357.
[8]Zhang YH,Yanase-Fujiwara M,Hosono T,et al.Warm and cold signals from the preoptic area:which contribute more to the control of shivering in rats[J].Physiol,1995,485(Pt 1):195-202.
, 百拇医药
[9]Brown JW,Whitehurst ME,Gordon CJ,et al.The Pre-Optic Anterior Hypothalamus(POAH)partially mediates the hypothermic response to hemorrhage in rats[J].Brain Res,2005,1041(1):1-10.
[10]Ravussin E.The presence and role of brown fat in adult humans[J].Curr Diab Rep,2010,10(2):90-92.
[11]杨惠玲,潘景轩,吴伟康.高级病理生理学[M].2版.北京:科学出版社,2006:102-103.
[12]Leon LR.Invited review:cytokine regulation of fever:studies using gene knockout mice[J].Appl Physiol,2002,92(6):2648-2655.
[13]Cao WH,Madden CJ,Morrison SF.Inhibition of brown adipose tissue thermogenesis by neurons in the ventrolateral medulla and in the nucleus tractus solitarius[J].Physiol Regul Integr Comp Physiol,2010,299(1):277-290.
[14]Dinarello CA.Cytokines as endogenous pyrogens[J].Infect Dis,1999,179(Suppl 2):294-304., http://www.100md.com(张量,孙大宇,江敏)
本室在先期研究中已经证实,无论是白细胞介素-1β(IL-1β)性发热的大鼠,还是肿瘤坏死因子 α(TNF-α)性发热的大鼠,BN均可在常温下通过抑制下丘脑中环磷酸腺苷(cAMP)[3-5]和PGE2[6]的升高来降低其发热效应,且低温下的降温效应还与抑制cAMP的合成和释放有关[7]。本实验观察了低温下(4℃)侧脑室注射BN对正常大鼠及IL-1β致热大鼠体温的作用,并检测下丘脑组织、血浆PGE2含量的变化,以进一步探讨低温时BN的降温作用及与PGE2含量的关系,完善BN的降温机制研究。
1 材料与方法
, 百拇医药
1.1 材料
1.1.1 实验动物 SD大鼠,健康♂,体重180~220 g,中国医科大学实验动物中心提供。室温(20±2)℃,湿度(50±2)%,光照6:00~18:00,术后动物单笼饲养,自由进食、水。
1.1.2 药物与试剂 BN(AnaSpec公司);盐酸氯氨酮(上海第一生化药业公司);盐酸甲苯噻嗪(美国FAH公司);IL-1β(北京宝赛公司);PGE2放免测定试剂盒由上海中医药大学同位素室提供。
1.1.3 仪器 SN2202型数字温度计(精确度0.1℃,北京师范大学司南仪器厂);SN-2型立体定位仪(日本东京仪器厂);GAMMA maticⅡ型γ放射免疫记数仪(瑞典Kontron公司);LS-3801型液体闪烁记数仪(美国Beckman公司)。
1.2 实验方法
, 百拇医药
1.2.1 实验动物体温测量 数字温度计探头插入大鼠直肠6 cm,待数字稳定后读数(温度探头导线用胶条标记,避免操作中探头插入深度的误差)。实验前连续7 d给大鼠测温,以使其适应实验者手法。实验前1 h将大鼠放入4℃冰箱,测量体温,以给药前1 h测得的3次体温的平均值作为大鼠给药前基础体温,然后分别在给药后各时间点记录大鼠直肠温。将实验数据输入计算机进行数据处理,获得发热的潜伏时、最大体温反应高度(ΔT)和体温反应指数(TRI3),利用这些数据做发热标准曲线。
1.2.2 侧脑室插管及侧脑室给药 大鼠在盐酸氯氨酮和盐酸甲苯噻嗪的联合麻醉下,参照大鼠脑图谱,用立体定位仪向一侧侧脑室置入一P10~P20组合的脑室插管,用牙科水泥固定,生理盐水检测小管通畅后封闭插管顶端。常规、单笼喂养1周后,开始实验。经插管给药前,先将封闭的插管上端剪开,经侧脑室插管给药时,要注意给药速度保持一致(1 μl/s)。实验结束后,检查插管位置,舍掉插管位置不正确的数据。
1.2.3 实验分组 SD♂大鼠26只,随机分为4组,对照组用人工脑脊液10 μl/只,其余3组均用人工脑脊液配平至10 μl。见表1。

, 百拇医药
表1 实验动物分组Tab.1 The groups of laboratory animals
1.2.4 样品采集及PGE2含量测定 准备一次性空针吸取消炎痛-EDTA液约0.2 ml,根据体温测定描绘的温度曲线,分别在给药后体温峰值时脱臼法处死大鼠,于下腔静脉穿刺取血4 ml,即刻在空针内颠倒数次混匀,离心取上清,置-30℃冰箱中保存。以灰结节和视交叉的中心点为中心取下丘脑部组织即刻置液氮冷冻, 称取 3~5mg置无水乙醇(0.4ml)+生理盐水(1.6 ml)中匀浆(在冰浴中进行)、离心,将上清液吸出,置于-30℃冰箱中保存。PGE2含量的测定按试剂盒说明书进行操作。
1.3 体温反应指标及数据处理
体温反应指标用平均体温反应曲线表示,体温变化情况采用TRI3及ΔT表示,所有数据以均数±标准差(±s)表示,采用两样本均数比较的t检验,P<0.05表示差异有统计学意义。
, 百拇医药
2 结果
2.1 IL-1β体温反应曲线
向 SD♂大鼠侧脑室微量注射 IL-1β(0.1 μg)后,30 min内大鼠体温迅速升高,90 min左右达发热高峰[ΔT:(1.22±0.75)℃],300 min 时出现第 2 个发热高峰[ΔT:(0.95±0.32)℃],发热持续360 min开始下降。见图1。

2.2 IL-1β、BN及BN+IL-1β体温反应曲线
侧脑室微量注射 BN(0.7 μg)后,体温迅速下降,30 min时即出现明显降低,45 min 时降至最低[ΔT:(1.93±0.30)℃],然后开始回升。IL-1β的升体温作用被预先给予的BN明显抑制,说明4℃下BN能够显著抑制IL-1β的升体温作用。见图 2、表 2。

, http://www.100md.com
表2 大鼠微量注射给药后的最大体温变化(ΔT)及体温反应指数(TRI3)( ±s)Tab.2 Maximum body temperature change(ΔT)and TRI3 after micro-injection in rats( ±s)

表2 大鼠微量注射给药后的最大体温变化(ΔT)及体温反应指数(TRI3)( ±s)Tab.2 Maximum body temperature change(ΔT)and TRI3 after micro-injection in rats( ±s)
与对照组比较,*P<0.01Compared with the control group,*P<0.01
, http://www.100md.com
组别 只数对照组IL-1β组BN组BN+IL-1β组6686体温反应指数(℃/h) 给药后最大体温变化(℃)0.95±0.63 3.28±1.78*3.22±1.29*3.42±0.70*0.39±0.28 1.22±0.75*1.99±0.99*1.78±0.74*
2.3 下丘脑及血浆PGE2含量
IL-1β组下丘脑和血浆PGE2含量与对照组相比均升高(P<0.01、P<0.01);而 BN 组 PGE2含量则均低于对照组 (P<0.01、P<0.05);在 BN+IL-1β 组 PGE2含量与 IL-1β 组相比均降低(均 P<0.01)。见表 3。
表3 下丘脑和血浆中PGE2含量( ±s)Tab.3 The content of PGE2in hypothalamus and plasma( ±s)

, 百拇医药
表3 下丘脑和血浆中PGE2含量( ±s)Tab.3 The content of PGE2in hypothalamus and plasma( ±s)
与对照组比较,*P<0.05,**P<0.01;与 IL-1β 组比较,#P<0.05,##P<0.01Compared with the control group,*P<0.05,**P<0.01;compared with the IL-1β group,#P<0.05,##P<0.01
组别 只数PGE2含量下丘脑(pg/mg) 血浆(pg/ml)对照组IL-1β组BN组BN+IL-1β组6686 4 606.87±665.28 6 225.09±799.94**2 925.31±910.62**3 568.91±867.23##19 019.97±2 638.46 24 244.87±5 936.72*12 994.79±6 334.26*19 920.97±5 351.24#
, http://www.100md.com
3 讨论
自1948年Beeson等发现内生致热原(EP)以来,40多年来人们对EP进行了系统深入的研究,取得了许多重要的进展[8]。学者们发现,许多外源性致热原如细菌、内毒素(ET)等并非直接作用于脑,而是通过激活产生EP的细胞,使后者产生和释放EP,EP再以某种方式引起发热。其中EP如何引起发热是人们关注的焦点。有学者推断EP可能是作用于PO/AH区,使体温调定点上移,产生发热反应[9]。有资料表明,多种物质可能在中枢参与或影响发热,如单胺类物质、CRH、棕色脂肪组织以及cAMP等[10-11]。近年来,PGE、中枢Ca2+以及阿片类物质的中介作用也受到了人们的关注[12-13]。
PGE2是否是发热的中枢介质在国内外一存在有争议。目前,许多研究者在对PGE2与发热关系的研究中,都试图通过EP或ET致热后中枢PGE2含量增加与否来说明其是否为中枢发热介质。以往的实验表明,在外周EP性发热的同时,脑脊液内PGE2的含量明显增加[12]。支持者认为是因为EP作用于下丘脑体温调节中枢,使其合成、释放PGE2增加而使调定点上移,引起体温升高,但尚无足够的证据证明EP能透过血-脑屏障,而且对IL-1能否自外周血进入脑内的验证取得阴性结果[14]。现在提出了新的假说,认为PGE的释放部位是在下丘脑终板血管区(OVLT)的有孔毛细血管外周的巨噬细胞,被EP激活的巨噬细胞释放PGE,后者作用于OVLT的神经元,或透过室管膜细胞的紧密连接而作用于POAH的神经元;也有一些资料不支持该假说。
, 百拇医药
本实验结果表明,低温下侧脑室注射IL-1β引起大鼠体温升高的同时,其下丘脑及血浆中PGE2的含量也均升高;低温下侧脑室注射BN可明显降低大鼠正常体温的同时,其下丘脑及血浆中PGE2的含量也随之降低;低温下侧脑室注射BN,明显抑制了大鼠IL-1β性发热反应的同时,其下丘脑及血浆中PGE2的含量也均降低。该结果较好地支持了以往争议中有关PGE2作为中枢发热介质的主张;提示低温下BN可能通过抑制PGE2的合成与释放降低大鼠正常体温和抑制IL-1β的致热效果。
目前,国内外对BN的体温调节作用多数停留在降温现象的描述阶段,未对BN的作用机制和新型解热药物的开发做进一步研究。我们通过研究低温下BN降温及翻转IL-1β致热作用与PGE2的关系为BN降温作用机制的阐明积累了资料。BN作用后下丘脑、血浆中PGE2含量显著降低,说明PGE2不仅可通过其含量的增加而在发热过程中起重要作用,也可在致冷原的作用下通过其含量的降低而起到降温作用。这可能是低温下BN降低体温的机制之一。
, http://www.100md.com
[1]鲁伟,陆大祥.蛙皮素与体温调节[J].中国病理生理学杂志,1997,13(4):443-447.
[2]Emel'yanova TG,Sosnovskaya IV,Guzevatych LS,et al.Effect of N-terminal tripeptides of bombesin,litorin,and their analogue on body temperature and vasomotor responses[J].Bull Exp Biol Med,2007,144(2):207-209.
[3]佟雷,张量,赵书芬,等.BN对IL-1β致热的抑制作用及POA和血中cAMP 的影响[J].中国药理学通报,2004,20(11):1239-1241.
[4]秦鑫,曹宇,赵书芬,等.纳络酮对IL-1β致热大鼠体温及下丘脑中cAMP和HSP70含量的影响[J].中国药理学通报,2006,22(10):180-183.
, http://www.100md.com
[5]刘利丹,李妍,赵书芬,等.热应激对大鼠TNF-α性发热及下丘脑中cAMP含量的影响[J].中国药理学通报,2005,21(9):1054-1057.
[6]张量,苏艳阳,赵书芬,等.蛙皮素对发热大鼠的降温作用及与PGE2的相关性[J].中国药理学通报,2008,24(9):1212-1215.
[7]张量,佟雷,赵书芬,等.低温时蛙皮素对IL-1β致热大鼠下丘脑和血浆cAMP含量的影响[J].中国临床药理学与治疗学,2005,10(12):1354-1357.
[8]Zhang YH,Yanase-Fujiwara M,Hosono T,et al.Warm and cold signals from the preoptic area:which contribute more to the control of shivering in rats[J].Physiol,1995,485(Pt 1):195-202.
, 百拇医药
[9]Brown JW,Whitehurst ME,Gordon CJ,et al.The Pre-Optic Anterior Hypothalamus(POAH)partially mediates the hypothermic response to hemorrhage in rats[J].Brain Res,2005,1041(1):1-10.
[10]Ravussin E.The presence and role of brown fat in adult humans[J].Curr Diab Rep,2010,10(2):90-92.
[11]杨惠玲,潘景轩,吴伟康.高级病理生理学[M].2版.北京:科学出版社,2006:102-103.
[12]Leon LR.Invited review:cytokine regulation of fever:studies using gene knockout mice[J].Appl Physiol,2002,92(6):2648-2655.
[13]Cao WH,Madden CJ,Morrison SF.Inhibition of brown adipose tissue thermogenesis by neurons in the ventrolateral medulla and in the nucleus tractus solitarius[J].Physiol Regul Integr Comp Physiol,2010,299(1):277-290.
[14]Dinarello CA.Cytokines as endogenous pyrogens[J].Infect Dis,1999,179(Suppl 2):294-304., http://www.100md.com(张量,孙大宇,江敏)