新生儿低血糖与脑损伤关系的研究
阮毅燕 潘新年 王金秋 陈瑜毅 冯军坛 沈开颜
广西壮族自治区妇幼保健院儿科,广西南宁 530000
新生儿低血糖是一种临床常见的糖代谢问题,大 多数低血糖新生儿症状隐匿,且易与新生儿其他疾病相混淆。既往研究资料显示,新生儿低血糖如果未能及时发现和妥善地处理,有可能导致永久性脑损伤,严重者会导致脑性瘫痪、癫痫等[1-2]。本研究选择广西壮族自治区妇幼保健院(以下简称“我院”)新生儿科住院的90例低血糖患儿的临床资料进行分析,寻找导致低血糖性脑损伤的可能危险因素,为新生儿低血糖所致脑损伤的预防及临床治疗提供依据。
1 资料与方法
1.1 一般资料
选择2009年1月~2010年12月在我院新生儿科住院的低血糖新生儿90例,其中男59例,女31例,男女之比 1.9∶1;胎龄 29~40 周,平均(33.70±2.56)周;体重 1.03~3.20 kg,平均(1.80±0.39)kg;糖尿病母亲婴儿14例;妊娠高血压母亲婴儿12例。该研究经我院医学伦理委员会批准,所有入组患儿均由家长签署知情同意书。
, 百拇医药
1.2 观察指标及诊断标准
临床表现可无症状或表现为反应差、吸吮力差、嗜睡、体温低下、发绀、呼吸异常、易激惹、震颤、抽搐、肌张力低等。收集所有入组病例的胎龄、出生体重、Apgar评分、临床表现及母亲围生期资料,动态监测治疗前后患儿血糖值变化及低血糖持续时间。应用微量血糖仪监测,取足跟血检测血糖,同时抽静脉血立刻送化验室检测全血血糖水平作对照,二者检测结果比较差异无统计学意义。所有患儿均常规行头颅MRI检查。低血糖指1次全血或血浆葡萄糖水平≤2.2 mmol/L[3]。低血糖性脑损伤:①符合低血糖诊断标准;②合并低血糖伴随的临床表现或低血糖时和血糖纠正后一段时间表现有神经系统功能障碍;③头颅MRI有明显脑损伤改变;④除外缺氧缺血性脑病、颅内感染、败血症、脑发育异常、严重的颅内出血、内分泌疾病及先天性代谢性疾病所致的脑病。
1.3 治疗方法
, 百拇医药
血糖<1.5 mmol/L或有临床表现的患儿立即静脉推注10%葡萄糖1~2 mg/kg,然后予以葡萄糖6~8 mg/(kg·min)静脉输注维持至正常血糖;凡血糖为1.5~2.2mmol/L 的患儿予以葡萄糖 6~8 mg/(kg·min)静脉输注维持至血糖正常。所有患儿治疗后或每次调整葡萄糖静脉输注速度后均于半小时后监测血糖,如果治疗后血糖恢复正常则每4~6小时监测血糖1次,若连续3次血糖测定均≥2.8 mmol/L,则下调葡萄糖静脉输注速度;如果治疗后血糖仍不能维持正常,则继续每半小时复查血糖并调节葡萄糖静脉输注速度,直至血糖正常。对于持续或反复发作的严重低血糖患儿如治疗后血糖仍不能维持正常,则加用氢化可的松治疗。
1.4 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
, 百拇医药
2 结果
2.1 分娩情况
本组90例低血糖患儿中,早产儿占83.3%(75/90),显著高于足月儿16.7%(15/90),差异有高度统计学意义(χ2=80.000,P < 0.01)。39例发生脑损伤,脑损伤发生率为43.33%(39/90)。其中早产儿脑损伤发生率为45.3%(34/75),较足月儿 33.3%(5/15)增高,但两组间差异无统计学意义(χ2=0.733,P > 0.05)。
2.2 母围生因素与低血糖性脑损伤关系
脑损伤组中,母亲患妊娠期糖尿病者显著高于无脑损伤组,两组间差异有高度统计学意义(P<0.01);母亲患妊娠高血压、剖宫产两组比较差异均无统计学意义(P > 0.05)。 见表 1。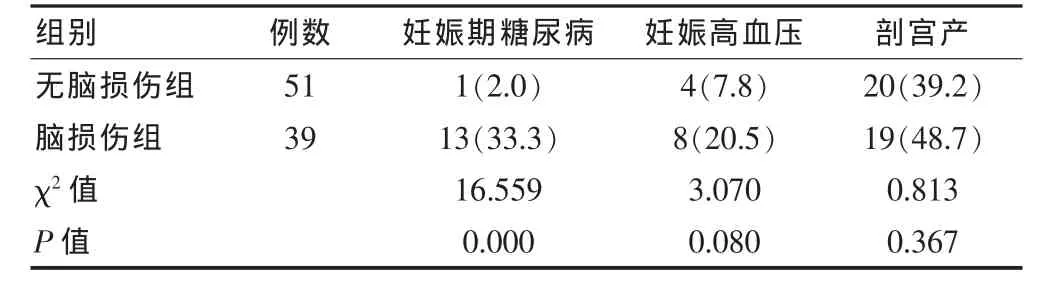
, 百拇医药
表1 母围生因素与脑损伤关系[n(%)]
2.3 婴儿围生因素与脑损伤关系
脑损伤组胎龄、5 min及10 min Apgar评分显著低于无脑损伤组,差异均有高度统计学意义 (P<0.01),出生体重及1 min Apgar评分两组比较差异均无统计学意义(P>0.05)。见表2。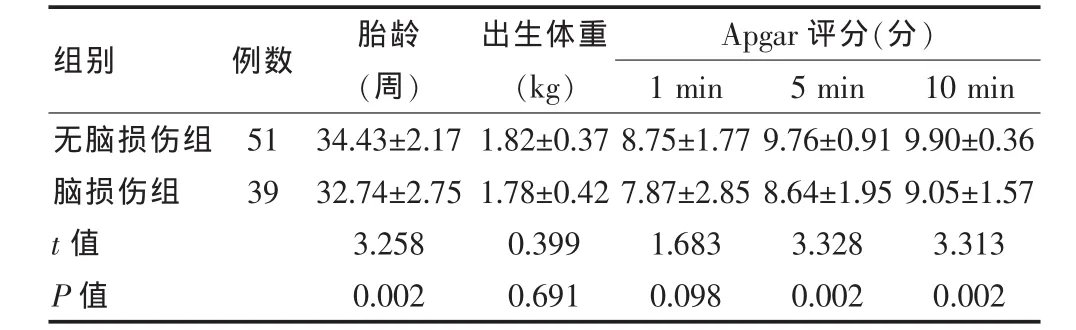
表2 婴儿围生因素与脑损伤关系(x±s)
2.4 临床表现与脑损伤关系
与无脑损伤组比较,脑损伤组出现临床症状者增多,最低血糖值降低,低血糖持续时间长,两组间差异均有高度统计学意义(P<0.01)。见表3。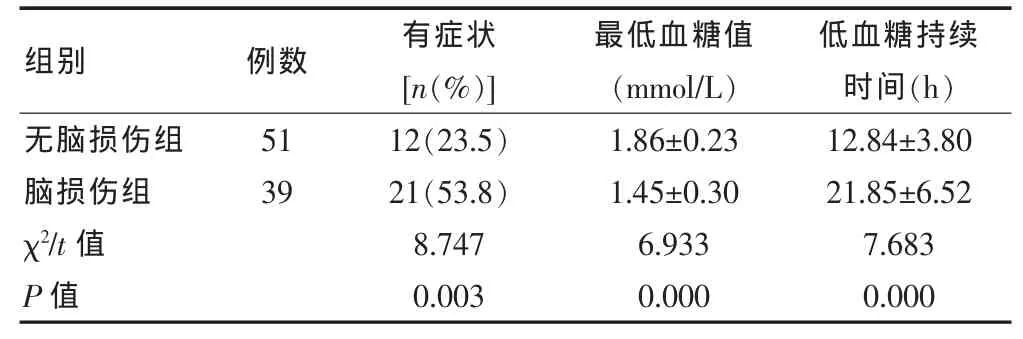
, http://www.100md.com
表3 临床表现与脑损伤关系(x±s)
3 讨论
葡萄糖是脑细胞代谢的主要能量来源,新生儿脑代谢最旺盛,由于脑组织不储备糖原,且不能利用各种戊糖底物作为脑细胞代谢的部分能量,因此有赖于血糖的不断补充和供应。低血糖可使脑细胞失去基本能量来源,如不及时纠正会造成脑损伤。本组资料中,低血糖性脑损伤发生率为43.33%。动物实验已经证实,在低血糖性脑损伤发生过程中,存在细胞内钙离子超载和突触释放过多的谷氨酸,产生细胞毒性损伤的病变过程,也有选择性神经元坏死现象,并且影响到小胶质细胞的免疫防护作用。而早产儿及小于胎龄儿糖原储备更少,脑相对较大,脑细胞代谢需糖量亦大,肝糖原异生酶发育不成熟,糖原分解功能差,皮下脂肪及游离脂肪少,供能底物少,更易发生低血糖[4]。本组90例低血糖患儿中,早产儿占83.3%,显著高于足月儿。虽早产儿脑损伤发生率与足月儿比较差异无统计学意义,但显示出升高的趋势,进一步分析发现,脑损伤组胎龄显著低于无脑损伤组。
, 百拇医药
母亲的慢性高血糖症导致胎儿在母体中同样有慢性高血糖症状,因此引起胎儿胰岛素生成增加发生胎儿高胰岛素血症。当胎儿娩出后,母体的高血糖来源突然中断,患儿本身又存在高胰岛素血症,导致新生儿低血糖发生,故母亲糖尿病是新生儿低血糖性脑损伤的高危因素[5]。本组资料中,脑损伤组母亲患妊娠期糖尿病者显著高于无脑损伤组,与既往研究相符[6]。新生儿窒息的缺氧、缺血病理过程对机体代谢的主要影响之一是糖代谢紊乱[7]。本研究中尽管单独应用Apgar评分定义新生儿窒息有其局限性,但Apgar评分是目前大多数产科应用最多的评估窒息的方法。本组资料中,脑损伤组5 min及10 min Apgar评分均显著低于无脑损伤组,1 min Apgar评分两组间差异无统计学意义,提示长时间窒息未及时复苏者可导致脑损伤发生。缺氧缺血时无氧酵解加速了脑组织内葡萄糖的消耗,低血糖时则抑制了低氧时的脑血管扩张,阻断了通过其他途径改善供氧的代偿机制,新生儿脑缺氧缺血和低血糖两因素叠加加重脑损伤[8]。有文献报道,新生儿缺血缺氧性脑病同时血糖 <2.6 mmol/L,影响24个月龄时神经系统发育[9]。
, 百拇医药
新生儿低血糖发生时多为无症状或者暂时性的,但当新生儿出现嗜睡、惊厥、呼吸暂停等神经功能紊乱症状时,提示此时新生儿已出现脑损伤[10]。本研究中,脑损伤组以症状性低血糖者为多,表明新生儿症状性低血糖对低血糖性脑损伤的提示作用,与既往研究相符[11]。Montassir等[12]随访低血糖患儿神经系统发育情况,发现神经系统发育异常的患儿血糖<15 mg/L(0.74 mmol/L)的发生率明显高于神经系统发育正常的患儿,低血糖持续时间异常组高于正常组,和本组资料结果基本相符,提示低血糖性脑损伤的发生与低血糖水平和低血糖持续时间密切相关,这是由于低血糖过程会造成患儿脑部能量代谢的缺乏,且长时间的低血糖状态会导致脑部神经处于低营养状态下,因此低血糖水平与低血糖持续时间也是脑损伤的重要因素[13-14]。
新生儿低血糖性脑损伤及其后遗症并无有效治疗方法,所以重在预防新生儿低血糖[15]。通过识别母亲妊娠、分娩及新生儿出生时的高危因素,早期筛查血糖十分必要。同时,及时发现低血糖的临床症状并正确治疗,维持正常稳定的血糖浓度,以预防神经系统后遗症的发生。目前,新生儿低血糖的防治已有规范化的处理方案[16]。
, 百拇医药
[1]Okereafor A,Allsop J,Counsell SJ,et al.Patterns of brain injury in neonates exposed to perinatal sentinel events[J].Pediatrics,2008,121(5):906-914.
[2]Udani V,Munot P,Ursekar M,et al.Neonatal hypoglycemic brain-injuryacommoncauseof infantileonsetremotesymptomatic epilepsy[J].Indian Pediatr,2009,46(2):127-132.
[3]Wight N,Marinelli KA,Academy of Breastfeeding Medicine Protocol Committee.ABM clinical protocol#l:guidelines for glucose monitoring and treatment of hypoglycemia in breastfed neonates[J].Breastfeeding Medieine,2006,1(3):178-184.
, http://www.100md.com
[4]Drenekpohl D,McConnell C,Gaffney S,et al.Randomized trail of very low birth weight infants receiving higher rates of infusion of intravenous fat emulsions during the first week of life[J].Pediatrics,2008,122(4):743-751.
[5]Arya VB,Senniappan S,Guemes M,et al.Neonatal hypoglycemia[J].Indian JPediatr,2014,81(1):58-65.
[6]Rozance PJ,Hay W.Hypoglycemia in newborn infants:featuresassociated with adverse outcomes[J].Biol Neonate,2006,90(2):74-86.
, 百拇医药
[7]Chandran S,Rajadurai VS,Abdul Haium AA,et al.Current perspectives on neonatal hypoglycemia,its management,and cerebral injury risk[J].Research and Reports in Neonatology,2015,5:17-30.
[8]Tam EW,Haeusslein LA,Bonifacio SL,et al.Hypoglycemia is associated with increased risk for brain injury and adverse neurodevelopmental outcome in neonates at risk for encephalopathy[J].JPediatr,2012,161(1):88-93.
[9]Nedeem M,Murray DM,Boylan GB,et al.Early blood glucoseprofileand neurodevelopmental outcomeat twoyearsin neonatal hypoxic-ischaemic encephalopathy[J].BMC Pediatr,2011,11:10.
, 百拇医药
[10]Li Y,Xu X,Wu K,et al.Monitoring of lead load and its effect on neonatal behavioral neurological assessment scores in Guiyu[J].JEnviron Monit,2008,10(10):1233-1238.
[11]Vannucci RC,Vannucci SJ.Hypoglycemic brain injury[J].Semin Neonatol,2001,6(2):147-155.
[12]Montassir H,Maegaki Y,Ogura K,et al.Associated factors inneonatal hypoglycemic brain Injury[J].Brain Dev,2009,31(9):649-656.
[13]Bums CM,Rutherford MA,Boardman JP,et al.Patterns of cerebral injury and neuro-developmental outcomes after symptomatic neonatal hypoglycemia [J].Pediatrics,2008,122(1):65-74.
, 百拇医药
[14]Heinz ER,Provenzale JM.Imaging findings in neonatal hypoxia:apractical review [J].Am JRoentgenol,2009,192(1):41-47.
[15]Tam EW,Haeusslein LA,Bonifacio SL,et al.Hypoglycemia is associated with increased risk for brain injury and adverse neurodevelopmental outcome in neonates at risk for encephalopathy[J].JPediat,2012,161(1):88-93.
[16]Sweet CB,Grayson S,Polak M.Management strategies for neonatal hypoglycemia[J].J Pediatr Pharmacol Ther,2013,18(3):199-208., 百拇医药
广西壮族自治区妇幼保健院儿科,广西南宁 530000
新生儿低血糖是一种临床常见的糖代谢问题,大 多数低血糖新生儿症状隐匿,且易与新生儿其他疾病相混淆。既往研究资料显示,新生儿低血糖如果未能及时发现和妥善地处理,有可能导致永久性脑损伤,严重者会导致脑性瘫痪、癫痫等[1-2]。本研究选择广西壮族自治区妇幼保健院(以下简称“我院”)新生儿科住院的90例低血糖患儿的临床资料进行分析,寻找导致低血糖性脑损伤的可能危险因素,为新生儿低血糖所致脑损伤的预防及临床治疗提供依据。
1 资料与方法
1.1 一般资料
选择2009年1月~2010年12月在我院新生儿科住院的低血糖新生儿90例,其中男59例,女31例,男女之比 1.9∶1;胎龄 29~40 周,平均(33.70±2.56)周;体重 1.03~3.20 kg,平均(1.80±0.39)kg;糖尿病母亲婴儿14例;妊娠高血压母亲婴儿12例。该研究经我院医学伦理委员会批准,所有入组患儿均由家长签署知情同意书。
, 百拇医药
1.2 观察指标及诊断标准
临床表现可无症状或表现为反应差、吸吮力差、嗜睡、体温低下、发绀、呼吸异常、易激惹、震颤、抽搐、肌张力低等。收集所有入组病例的胎龄、出生体重、Apgar评分、临床表现及母亲围生期资料,动态监测治疗前后患儿血糖值变化及低血糖持续时间。应用微量血糖仪监测,取足跟血检测血糖,同时抽静脉血立刻送化验室检测全血血糖水平作对照,二者检测结果比较差异无统计学意义。所有患儿均常规行头颅MRI检查。低血糖指1次全血或血浆葡萄糖水平≤2.2 mmol/L[3]。低血糖性脑损伤:①符合低血糖诊断标准;②合并低血糖伴随的临床表现或低血糖时和血糖纠正后一段时间表现有神经系统功能障碍;③头颅MRI有明显脑损伤改变;④除外缺氧缺血性脑病、颅内感染、败血症、脑发育异常、严重的颅内出血、内分泌疾病及先天性代谢性疾病所致的脑病。
1.3 治疗方法
, 百拇医药
血糖<1.5 mmol/L或有临床表现的患儿立即静脉推注10%葡萄糖1~2 mg/kg,然后予以葡萄糖6~8 mg/(kg·min)静脉输注维持至正常血糖;凡血糖为1.5~2.2mmol/L 的患儿予以葡萄糖 6~8 mg/(kg·min)静脉输注维持至血糖正常。所有患儿治疗后或每次调整葡萄糖静脉输注速度后均于半小时后监测血糖,如果治疗后血糖恢复正常则每4~6小时监测血糖1次,若连续3次血糖测定均≥2.8 mmol/L,则下调葡萄糖静脉输注速度;如果治疗后血糖仍不能维持正常,则继续每半小时复查血糖并调节葡萄糖静脉输注速度,直至血糖正常。对于持续或反复发作的严重低血糖患儿如治疗后血糖仍不能维持正常,则加用氢化可的松治疗。
1.4 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
, 百拇医药
2 结果
2.1 分娩情况
本组90例低血糖患儿中,早产儿占83.3%(75/90),显著高于足月儿16.7%(15/90),差异有高度统计学意义(χ2=80.000,P < 0.01)。39例发生脑损伤,脑损伤发生率为43.33%(39/90)。其中早产儿脑损伤发生率为45.3%(34/75),较足月儿 33.3%(5/15)增高,但两组间差异无统计学意义(χ2=0.733,P > 0.05)。
2.2 母围生因素与低血糖性脑损伤关系
脑损伤组中,母亲患妊娠期糖尿病者显著高于无脑损伤组,两组间差异有高度统计学意义(P<0.01);母亲患妊娠高血压、剖宫产两组比较差异均无统计学意义(P > 0.05)。 见表 1。

, 百拇医药
表1 母围生因素与脑损伤关系[n(%)]
2.3 婴儿围生因素与脑损伤关系
脑损伤组胎龄、5 min及10 min Apgar评分显著低于无脑损伤组,差异均有高度统计学意义 (P<0.01),出生体重及1 min Apgar评分两组比较差异均无统计学意义(P>0.05)。见表2。

表2 婴儿围生因素与脑损伤关系(x±s)
2.4 临床表现与脑损伤关系
与无脑损伤组比较,脑损伤组出现临床症状者增多,最低血糖值降低,低血糖持续时间长,两组间差异均有高度统计学意义(P<0.01)。见表3。

, http://www.100md.com
表3 临床表现与脑损伤关系(x±s)
3 讨论
葡萄糖是脑细胞代谢的主要能量来源,新生儿脑代谢最旺盛,由于脑组织不储备糖原,且不能利用各种戊糖底物作为脑细胞代谢的部分能量,因此有赖于血糖的不断补充和供应。低血糖可使脑细胞失去基本能量来源,如不及时纠正会造成脑损伤。本组资料中,低血糖性脑损伤发生率为43.33%。动物实验已经证实,在低血糖性脑损伤发生过程中,存在细胞内钙离子超载和突触释放过多的谷氨酸,产生细胞毒性损伤的病变过程,也有选择性神经元坏死现象,并且影响到小胶质细胞的免疫防护作用。而早产儿及小于胎龄儿糖原储备更少,脑相对较大,脑细胞代谢需糖量亦大,肝糖原异生酶发育不成熟,糖原分解功能差,皮下脂肪及游离脂肪少,供能底物少,更易发生低血糖[4]。本组90例低血糖患儿中,早产儿占83.3%,显著高于足月儿。虽早产儿脑损伤发生率与足月儿比较差异无统计学意义,但显示出升高的趋势,进一步分析发现,脑损伤组胎龄显著低于无脑损伤组。
, 百拇医药
母亲的慢性高血糖症导致胎儿在母体中同样有慢性高血糖症状,因此引起胎儿胰岛素生成增加发生胎儿高胰岛素血症。当胎儿娩出后,母体的高血糖来源突然中断,患儿本身又存在高胰岛素血症,导致新生儿低血糖发生,故母亲糖尿病是新生儿低血糖性脑损伤的高危因素[5]。本组资料中,脑损伤组母亲患妊娠期糖尿病者显著高于无脑损伤组,与既往研究相符[6]。新生儿窒息的缺氧、缺血病理过程对机体代谢的主要影响之一是糖代谢紊乱[7]。本研究中尽管单独应用Apgar评分定义新生儿窒息有其局限性,但Apgar评分是目前大多数产科应用最多的评估窒息的方法。本组资料中,脑损伤组5 min及10 min Apgar评分均显著低于无脑损伤组,1 min Apgar评分两组间差异无统计学意义,提示长时间窒息未及时复苏者可导致脑损伤发生。缺氧缺血时无氧酵解加速了脑组织内葡萄糖的消耗,低血糖时则抑制了低氧时的脑血管扩张,阻断了通过其他途径改善供氧的代偿机制,新生儿脑缺氧缺血和低血糖两因素叠加加重脑损伤[8]。有文献报道,新生儿缺血缺氧性脑病同时血糖 <2.6 mmol/L,影响24个月龄时神经系统发育[9]。
, 百拇医药
新生儿低血糖发生时多为无症状或者暂时性的,但当新生儿出现嗜睡、惊厥、呼吸暂停等神经功能紊乱症状时,提示此时新生儿已出现脑损伤[10]。本研究中,脑损伤组以症状性低血糖者为多,表明新生儿症状性低血糖对低血糖性脑损伤的提示作用,与既往研究相符[11]。Montassir等[12]随访低血糖患儿神经系统发育情况,发现神经系统发育异常的患儿血糖<15 mg/L(0.74 mmol/L)的发生率明显高于神经系统发育正常的患儿,低血糖持续时间异常组高于正常组,和本组资料结果基本相符,提示低血糖性脑损伤的发生与低血糖水平和低血糖持续时间密切相关,这是由于低血糖过程会造成患儿脑部能量代谢的缺乏,且长时间的低血糖状态会导致脑部神经处于低营养状态下,因此低血糖水平与低血糖持续时间也是脑损伤的重要因素[13-14]。
新生儿低血糖性脑损伤及其后遗症并无有效治疗方法,所以重在预防新生儿低血糖[15]。通过识别母亲妊娠、分娩及新生儿出生时的高危因素,早期筛查血糖十分必要。同时,及时发现低血糖的临床症状并正确治疗,维持正常稳定的血糖浓度,以预防神经系统后遗症的发生。目前,新生儿低血糖的防治已有规范化的处理方案[16]。
, 百拇医药
[1]Okereafor A,Allsop J,Counsell SJ,et al.Patterns of brain injury in neonates exposed to perinatal sentinel events[J].Pediatrics,2008,121(5):906-914.
[2]Udani V,Munot P,Ursekar M,et al.Neonatal hypoglycemic brain-injuryacommoncauseof infantileonsetremotesymptomatic epilepsy[J].Indian Pediatr,2009,46(2):127-132.
[3]Wight N,Marinelli KA,Academy of Breastfeeding Medicine Protocol Committee.ABM clinical protocol#l:guidelines for glucose monitoring and treatment of hypoglycemia in breastfed neonates[J].Breastfeeding Medieine,2006,1(3):178-184.
, http://www.100md.com
[4]Drenekpohl D,McConnell C,Gaffney S,et al.Randomized trail of very low birth weight infants receiving higher rates of infusion of intravenous fat emulsions during the first week of life[J].Pediatrics,2008,122(4):743-751.
[5]Arya VB,Senniappan S,Guemes M,et al.Neonatal hypoglycemia[J].Indian JPediatr,2014,81(1):58-65.
[6]Rozance PJ,Hay W.Hypoglycemia in newborn infants:featuresassociated with adverse outcomes[J].Biol Neonate,2006,90(2):74-86.
, 百拇医药
[7]Chandran S,Rajadurai VS,Abdul Haium AA,et al.Current perspectives on neonatal hypoglycemia,its management,and cerebral injury risk[J].Research and Reports in Neonatology,2015,5:17-30.
[8]Tam EW,Haeusslein LA,Bonifacio SL,et al.Hypoglycemia is associated with increased risk for brain injury and adverse neurodevelopmental outcome in neonates at risk for encephalopathy[J].JPediatr,2012,161(1):88-93.
[9]Nedeem M,Murray DM,Boylan GB,et al.Early blood glucoseprofileand neurodevelopmental outcomeat twoyearsin neonatal hypoxic-ischaemic encephalopathy[J].BMC Pediatr,2011,11:10.
, 百拇医药
[10]Li Y,Xu X,Wu K,et al.Monitoring of lead load and its effect on neonatal behavioral neurological assessment scores in Guiyu[J].JEnviron Monit,2008,10(10):1233-1238.
[11]Vannucci RC,Vannucci SJ.Hypoglycemic brain injury[J].Semin Neonatol,2001,6(2):147-155.
[12]Montassir H,Maegaki Y,Ogura K,et al.Associated factors inneonatal hypoglycemic brain Injury[J].Brain Dev,2009,31(9):649-656.
[13]Bums CM,Rutherford MA,Boardman JP,et al.Patterns of cerebral injury and neuro-developmental outcomes after symptomatic neonatal hypoglycemia [J].Pediatrics,2008,122(1):65-74.
, 百拇医药
[14]Heinz ER,Provenzale JM.Imaging findings in neonatal hypoxia:apractical review [J].Am JRoentgenol,2009,192(1):41-47.
[15]Tam EW,Haeusslein LA,Bonifacio SL,et al.Hypoglycemia is associated with increased risk for brain injury and adverse neurodevelopmental outcome in neonates at risk for encephalopathy[J].JPediat,2012,161(1):88-93.
[16]Sweet CB,Grayson S,Polak M.Management strategies for neonatal hypoglycemia[J].J Pediatr Pharmacol Ther,2013,18(3):199-208., 百拇医药