直肠癌组织uPA系统和VEGF表达与浸润转移的关系(2)
 |
 |
尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator,uPA)是一种蛋白水解酶,其介导的纤维蛋白降解作用能破坏细胞外基质和基底膜,在肿瘤浸润转移中起重要作用[1-2]。肿瘤诱导的血管生成反应亦与其生物学行为密切相关,血管内皮生长因子(vascular endothelial growth factor,VEGF)被认为是作用最强、特异性最高的血管生成调控因子[3]。笔者采用免疫组织化学方法检测67例直肠癌组织中uPA,uPAR,PAI-1及VEGF的表达,探讨其与直肠癌生物学行为的关系。现报告如下。
1 资料与方法
1.1 一般资料 本院2005年1月至2008年1月直肠癌手术切除标本67例,术前未接受过抗肿瘤治疗。男54例,女13例,年龄34~78岁。所有病例均经病理诊断证实。其中溃疡型37例(55.2%),肿块型5例(7.5%),浸润型25例(37.3%);腺瘤癌变4例(5.9%),高分化腺癌20例(29.9%),中分化腺癌26例(38.8%),粘液腺癌14例(20.9%),印戒细胞癌3例(4.5%)。Dukes A期3例(4.5%),B期55例(82.1%),C期8例(11.9%),D期1例(1.5%)。以癌旁组织为对照。所有标本组织经40 g/L多聚甲醛固定,常规石蜡包埋。4 μm厚连续切片。
, http://www.100md.com
1.2 方法 采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶(S-P)方法。兔抗人uPA蛋白多克隆抗体(BA0405)、兔抗人uPAR蛋白多克隆抗体(BA1368)、兔抗人PAI-1蛋白多克隆抗体(BA1334)均购自军事医学科学院,工作浓度分别为1∶50,1∶100,1∶100。VEGF多克隆抗体、免疫组化S-P试剂盒均购自福州迈新生物技术公司,VEGF工作浓度为1∶50。每批染色均用已知阳性切片作阳性对照,用PBS代替一抗作阴性对照.染色结果判断分别按阳性细胞百分数及染色强度计分。阳性细胞数为0,计0分;1%~25%计1分;26%~50%计2分;>50%计3分。染色阴性计0分;淡黄色计1分;棕黄色计2分;棕褐色计3分。两种积分相加,积分为0~2分,表示阴性(-);积分为3~4分,表示阳性(+);积分为5~6分,表示阳性(++)。+、++均视为阳性表达。
2 结果
2.1 uPA,uPAR,PAI-1蛋白的表达 uPA,uPAR蛋白的阳性产物主要位于直肠癌细胞的胞质中,强度深浅不一。肿瘤内少量成纤维细胞、血管内皮细胞可见较弱的阳性表达。PAI-1蛋白的阳性产物也主要定位于直肠癌细胞的胞质中,但与分化程度有关:在分化高的直肠癌组织,肿瘤细胞呈弥漫性胞质着色;随着分化程度降低,染色有加深趋势,部分胞质中出现棕褐色颗粒。上述三种蛋白在癌旁组织都有不同程度的阳性表达。正常直肠黏膜上皮多呈阴性表达。VEGF蛋白阳性信号主要定位于癌细胞胞质,其表达呈明显异质性,在低分化癌和印戒细胞癌中的表达多呈强阳性,一些血管内皮细胞也可见弱的VEGF表达。在癌旁组织中,大部分腺上皮呈阴性表达。直肠癌组织中uPA,uPAR,PAI-1,VEGF蛋白的阳性表达率分别为68.7%,68.7%,70.1%和76.2%,明显高于他们在癌旁组织中的阳性表达,分别为28.4%,31.3%,40.3%和20.9%,差异具有显著性意义(P<0.01)。
, 百拇医药
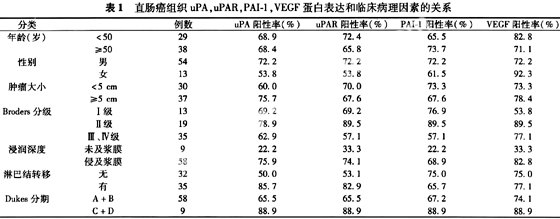
2.2 uPA,uPAR,PAI-1,VEGF蛋白表达和临床病理因素的关系 uPA,uPAR,PAI-1,VEGF蛋白在侵及浆膜组中的阳性表达率明显高于未及浆膜组,差异具有显著性意义(表1)。uPA,uPAR蛋白在淋巴结转移组中的阳性率明显高于无淋巴结转移组,差异具有显著性意义。PAI-1蛋白在低分化组中的阳性率明显低于中分化和高分化组,差异有显著性(P<0.05)。uPA,uPAR,VEGF蛋白阳性率在不同分化程度间差异无显著性。在直肠癌组织中uPA与uPAR蛋白的表达具有极显著正相关性(r=0.653,P<0.001)。在uPA,uPAR蛋白同时阳性的41例病例中,有28例发生淋巴结转移,与阴性组(4/15)相比,转移发生率明显增高(P<0.01)。
2.3 uPA,uPAR,PAI-1与VEGF蛋白表达和淋巴结转移的相关性 直肠癌组织中uPA蛋白表达与VEGF蛋白表达显著正相关(r=0.300,P=0.014<0.05)。PAI-1蛋白的表达与VEGF蛋白表达具有极显著正相关性(r=0.413,P=0.001<0.01)。uPAR与VEGF蛋白表达呈正相关(r=0.206,P=0.095)。应用COX回归模型进行多变量分析并采用向前逐步回归法,得出在诸多临床病理因素以及uPA,uPAR,PAI-1和VEGF蛋白等指标中,仅浸润深度、uPA表达和病理类型被引进方程,对淋巴结转移有影响(表2)。
, http://www.100md.com
3 讨论
uPA介导的纤溶酶降解系统在肿瘤浸润转移过程中发挥重要作用。uPA是一种丝氨酸蛋白酶,由多种肿瘤细胞或其他细胞分泌,通过与细胞膜上的特异性受体uPAR结合发挥作用,激活纤溶酶原成为纤溶酶。另外,uPA还激活潜在活性的胶原酶,与纤溶酶一起均促使细胞外基质(包括层粘连蛋白、纤维连接蛋白、蛋白多糖和Ⅳ型胶原等)和血管基膜的降解,最终导致肿瘤细胞的浸润和转移[4]。uPA的活性被他的特异性抑制剂PAI-1所调控。本研究的结果显示uPA,uPAR,PAI-1蛋白主要定位于直肠癌组织中的癌细胞胞质,肿瘤内少量成纤维细胞、血管内皮细胞可见较弱的uPA,uPAR蛋白阳性表达。uPA,uPAR,PAI-1蛋白在直肠癌组织中的表达较癌旁组织明显增高(P<0.01),表明随着细胞恶性程度的增高,uPA,uPAR,PAI-1蛋白表达呈增高趋势。其他学者利用ELISA和免疫组织化学方法检测uPA,uPAR蛋白表达水平时,亦发现癌中心、癌边缘和正常组织中uPA、uPAR、PAI-1蛋白活性逐渐降低[5-6],与本结果基本一致。笔者还发现uPA,uPAR蛋白在侵及浆膜组中的阳性表达率明显高于未及浆膜组(P<0.05),在淋巴结转移组中的阳性率明显高于无淋巴结转移组(P<0.01),差异均具有显著性意义,进一步证实了uPA/uPAR系统参与了直肠癌的侵袭和转移过程,这可能是因为高表达uPA和uPAR蛋白的癌细胞降解细胞外基质和基底膜成分的能力增强,使这部分细胞更易向组织深层和淋巴管浸润,并导致远处转移。结果显示,在直肠癌组织中uPA和uPAR蛋白的表达存在显著的正相关(r= 0.653,P<0.001),提示在直肠癌侵袭转移过程中,对细胞外基质和基底膜的降解作用是二者共同作用的结果。在uPA,uPAR蛋白同时阳性的41例病例中,有28例发生淋巴结转移,与阴性组(4/15)相比,转移发生率明显增高(P<0.01),提示在直肠癌侵袭转移过程中,uPA,uPAR协同高表达时,肿瘤细胞可能具有更高的移动性和侵袭力。最近的研究表明,uPA和uPAR结合后可促进整合素介导的信号传导作用,而这一信号传导作用又进一步促进肿瘤的转移[7-8]。目前有关PAI-1在肿瘤生物学中的确切作用还不清楚,他在纤溶酶原激活系统中可能担当重要的调节剂或者是肿瘤细胞防止自身降解的保护剂而不是这个系统单纯的抑制剂[9]。也有学者认为,PAI-1在肿瘤浸润转移中与uPA,uPAR有协同和调节作用。, 百拇医药(闫春生 战学雷)