原料药无菌工艺模拟验证国际认证要求
1各国GMP法规指南对无菌工艺验证的要求,2无菌原料药工艺模拟验证介绍,1无菌原料药工艺模拟验证方法学问题,2无菌工艺模拟验证的介质选择问题,3无菌工艺模拟验证的前提条件,4无菌工艺模拟验证的文件管理问题,5无菌工艺模拟验证
高海燕 陈军丽 丁恩峰(1. 石药集团恩必普药业有限公司,石家庄 050031;2. 石家庄市第三医院制剂科,石家庄 050031;3. 英国施达化学集团公司中国代表处,石家庄 050031)
在欧美药政法规体系里面,如果无菌制剂采用无菌原料药(API)来制备,那么,无菌原料药的无菌性质对于制剂来说是至关重要的。无菌原料药一般采用两种方法来制造:灭菌工艺和无菌工艺。当原料药采用无菌工艺制造时,因为这种工艺无菌保证水平(SAL)较低,因此,需要采用模拟验证来评估无菌工艺的保证能力。在目前制药行业,通常采用无菌工艺模拟验证(也称为培养基灌装)方式评估工艺无菌保证能力。
目前制药行业对于无菌制剂的工艺模拟验证研究较多,而对于无菌原料药的工艺模拟验证研究较少。例如,工艺模拟验证实施细节问题、最后判定标准选择问题等,都存在很多模糊或者错误的认识。
1 各国GMP法规指南对无菌工艺验证的要求
对于原料药的管理,中国药政法规和欧美药政法规是不同的。在欧美国家,原料药不被作为药品来管理,而是作为活性物质(API)来管理。因为欧美药政法规对于原料药的无菌工艺模拟验证没有很明确的要求,目前法规和指南中可以找到关于无菌工艺模拟验证的要求,主要适用于无菌制剂的工艺模拟验证。中国药政法规由于建设较晚,还没有很完善的体系,对于无菌原料药工艺模拟验证,也没有针对性的要求。下面列表给出了各国对于无菌工艺模拟药政的要求。
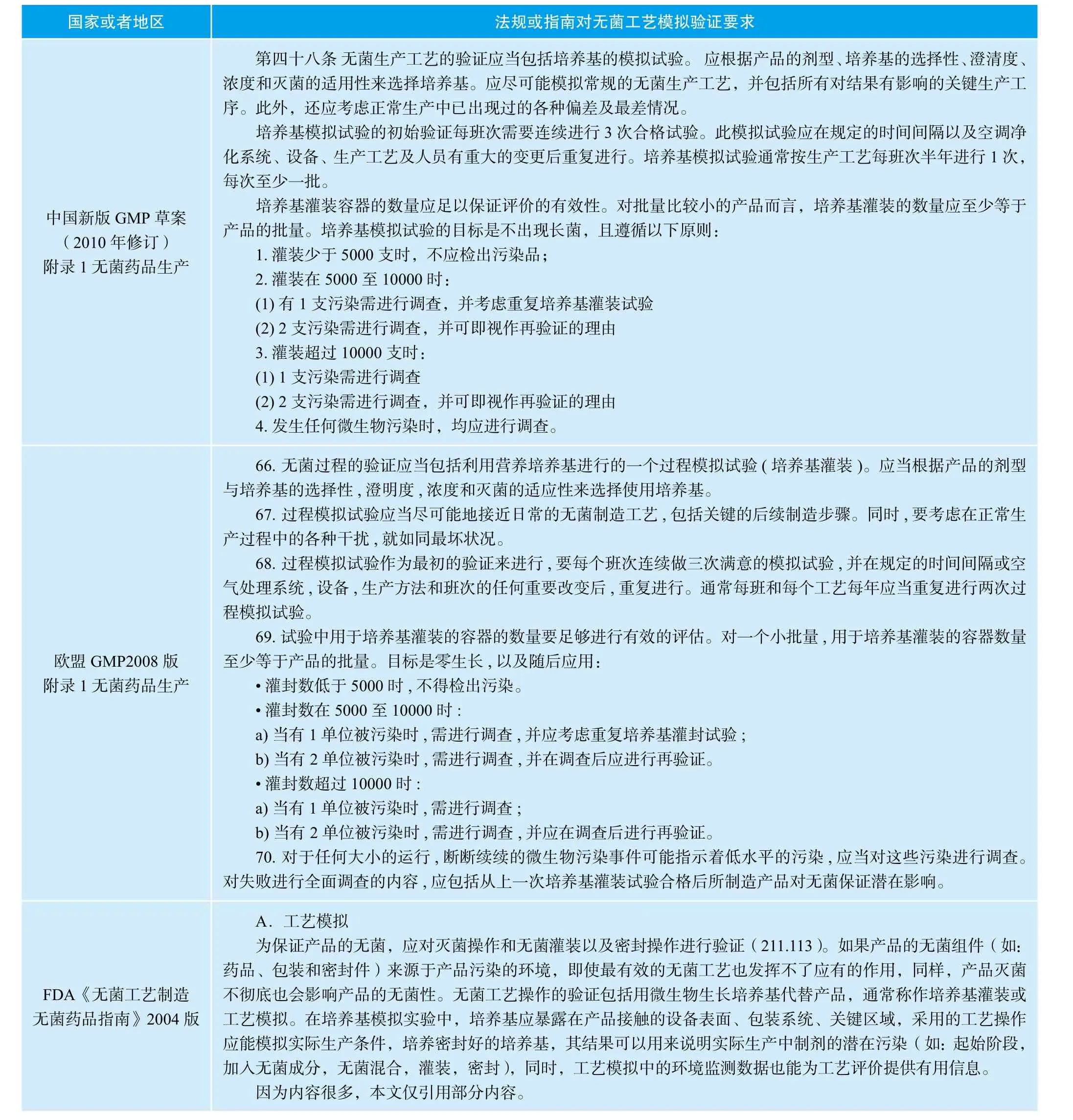
表1 各国GMP法规指南对无菌工艺验证的要求
2 无菌原料药工艺模拟验证介绍
2.1 无菌原料药工艺模拟验证方法学问题
在进行无菌原料药工艺模拟验证之前,验证人员必须全面深刻地评估无菌原料药制造工艺,并确定无菌工艺模拟验证的范围,这是无菌工艺模拟验证成功的关键。
由于无菌原料药生产工艺一般包括多个步骤,模拟验证可以采取2种方式:第一种方式:分别评估每部操作的无菌保证能力;第二种方式:综合评估无菌操作步骤组合的无菌保证能力。下面介绍这2种方式。
2.1.1 一次性全部工艺模拟方法(Total Process Simulation)
分析比较,可以得到第一种方式的优点和缺点如下:
优点:
— 这种组合模拟方法比那些分段模拟方法更接近实际工艺; ......
您现在查看是摘要页,全文长 17601 字符。